Татяна Василиева
1 Московски физико-технически институт, Институтски пер., 9, Долгопруден, 141700 Москва, Русия; ur.liam@veragisaa (A.S.); ur.relbmar@6002veilisavnm (M.V.)
Дмитрий Чухчин
2-ядрен център за подпомагане „Арктика”, Северен (Арктически) федерален университет, наб. Северна Двина, 17, 163002 Архангелск, Русия; ur.liamg@hcstamid
Сергей Лопатин
3 Федерална държавна институция, Федерален изследователски център, Основи на биотехнологиите на RAS, Институт по биоинженерство, 60 let Oktjabrja pr-t, 7/1, 117312 Москва, Русия; ur.ca.igneib@nitapol (S.L.); ur.ca.igneib@vomalrav (V.V.)
Валери Върламов
3 Федерална държавна институция, Федерален изследователски център, Основи на биотехнологиите на RAS, Институт по биоинженерство, 60 let Oktjabrja pr-t, 7/1, 117312 Москва, Русия; ur.ca.igneib@nitapol (S.L.); ur.ca.igneib@vomalrav (V.V.)
Андрей Сигарев
1 Московски физико-технически институт, Институтски пер., 9, Долгопруден, 141700 Москва, Русия; ur.liam@veragisaa (A.S.); ur.relbmar@6002veilisavnm (M.V.)
Михаил Василиев
1 Московски физико-технически институт, Институтски пер., 9, Долгопруден, 141700 Москва, Русия; ur.liam@veragisaa (A.S.); ur.relbmar@6002veilisavnm (M.V.)
Резюме
1. Въведение
Два естествени възобновяеми биополимери, а именно целулоза (линейна верига от няколко стотици до много хиляди β-1,4-свързани d-глюкозни единици) и хитин (линеен хетерокополимер на β-1,4-свързана 2-амино-2-дезокси- d -глюкопираноза и 2-ацет-амидо-2-дезокси- d -глюкопираноза единици), са най-разпространените полизахариди на земята. Производните на целулоза, хитин и хитозан са много обещаващи за технологични и промишлени приложения като земеделие, микробиология, хранително-вкусова промишленост, медицина и подсектор целулоза и хартия [1,2,3,4,5,6].
Въпреки че полимерите притежават уникални свойства (висока биосъвместимост с живи тъкани, биоразградимост, способност за комплексообразуване, ниска токсичност и др.), Те имат ограничено приложение в много индустриални области поради тяхната неразтворимост в повечето разтворители. Например, водоразтворими нискомолекулни хитоолигозахариди (COS) (по-малко от 10 kDa) обикновено се изискват в медицината, фармацевтиката и селското стопанство [5,6,7,8,9,10]. Нискомолекулните целулозни фрагменти са перспективни субстрати за микробиологията, тъй като те могат да бъдат превърнати в монозахариди и редица продукти, ферментиращи захари за синтез на биоетанол чрез микробиална ферментация сред тях [11].
Обикновената и относително евтина химическа хидролиза в концентрирани киселини или основи при високи температури е конвенционален метод. Тези техники обаче обикновено отнемат няколко часа или дори дни и оборудването за обработка е повредено поради корозия и са необходими процедури за неутрализация [12,13,14,15]. Освен това токсичните отпадъци и замърсяването на околната среда са присъщи на химическата обработка на полизахариди. Друг проблем при химичните методи е образуването на продукти с модифицирана химическа структура. Например, химичното разграждане на хитина може да доведе до образуването на деацетилирани COS, но за по-нататъшни (био) химични реакции обикновено се изискват стабилни N-ацетилови групи, налични в структурата на хитина [12,13].
Ензимите често са за предпочитане пред неорганичните съединения с каталитичен капацитет, тъй като са устойчиви на околната среда. Ензимната хидролиза на целулозата обаче често е непълна и образуваните продукти имат висок индекс на полидисперсност [16].
По този начин усилията за разработване на нови икономически осъществими и екологични методи за разграждане на полизахариди изглеждат разумни. Плазмохимичните технологии, използващи неравновесна нискотемпературна плазма, могат да бъдат обещаваща алтернатива на споменатите по-горе методи за хидролиза. Нашите предишни статии показаха, че електронно-лъчевата плазма (EBP) може да бъде приложена за ефективното и контролируемо унищожаване на хитозан, а високи добиви на водоразтворим COS могат да бъдат постигнати чрез оптимизиране на процедурата за EBP-обработка [17].
Целите на настоящото проучване бяха следните:
Да се изследва EBP-обработката на хитин и целулоза и да се разкрие зависимостта от времето за EBP-стимулирано образуване на водоразтворими продукти с ниско молекулно тегло (LMWP).
Да се характеризира химическата структура и молекулната маса на произведените LMWP.
Да се предложат възможни механизми на действие на EBP върху полизахаридите.
2. Резултати
2.1. EBP Обработката на полизахариди
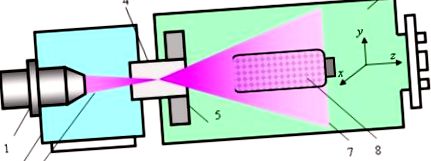
Фигура 1 илюстрира проектирането и функционирането на електронно-лъчевия плазмохимичен реактор (EBPR). EBPR, неговите режими на работа и оптимизирането на режимите за третиране на биоматериали, както и свойствата на EBP, са описани подробно в [18,19].
Електронно-лъчев плазмохимичен реактор и схема на процедурата за третиране: 1 - електронно-лъчева пушка; 2 - висока вакуумна камера; 3 - електронен лъч; 4 - инжекционен прозорец; 5 — система за електромагнитно сканиране; 6 — работна камера; 7 — EBP облак; 8 - устройство за смесване с полизахариден прах, който ще се третира.
Накратко, фокусираният EB 3, генериран от електронно-лъчевия пистолет 1, който е разположен във високата вакуумна камера 2, се инжектира в работната камера 6, пълна с плазмообразуващ газ през инжекционния прозорец 4. При преминаване през газа EB се разсейва при еластични сблъсъци и енергията на бързите електрони постепенно намалява при различни нееластични взаимодействия със средата (йонизация, възбуждане, дисоциация). В резултат на това се генерира EBP облак 7, като всички параметри на плазмата са функции на координатите x, y и z (z е оста на инжектирането на EB).
Електромагнитната сканираща система 5, поставена вътре в работната камера близо до инжекционния прозорец, е в състояние да отклонява инжектираната ос EB в посоките x и y и следователно да контролира пространственото разпределение на плазмените частици в плазмения обем. Работната камера се евакуира предварително под налягане
1 Pa и след това се пълни с плазмообразуваща среда - химически чист кислород (Sigma-Aldrich, Мюнхен, Германия) до 670 Pa.
Полизахаридните прахове се обработват в специален реактор за смесване 8. Устройството (Фигура 2а) съдържа цилиндричен кварцов съд 1а с вътрешни ребра 3а; той е оборудван със стъпков двигател, въртящ съда в различни режими (непрекъснат, прекъсващ, реверсивен и т.н.). Когато съдът се върти, прахообразният материал, който ще се обработва (4а), се смесва. Устройството се поставя в работната камера на EBPR, пълна с плазмообразуващ газ при необходимото налягане и EB 2a се инжектира през отворения край на реактора. В резултат на това аерозолната реакционна зона 5а се образува вътре в съда. Продължителността на лечението (τ) на полизахаридите варира в рамките на 1–20 минути. За да се предотврати термичното разрушаване на полизахаридите, те се обработват при температура на материала Ts = 40 ° C. Температурата на пробата по време на обработката се наблюдава с оптичен IR-пирометър Optris LS (Optris GmbH, Portsmouth, NH, USA) или с миниатюрен термосензор, вкаран в реакционната зона. Температурата на материала се контролира чрез промяна на EB тока.
Обработка на полизахаридни прахове в смесителното устройство: (а) Дизайн на смесителното устройство за EBP-обработка на полизахаридни прахове: 1а - цилиндричен кварцов съд; 2а - EBP облак; 3а - вътрешни дялове; 4а - полизахариди на прах; 5а - аерозолна реакционна зона. (б) Хитинов прах в снимката на реакционната зона на EBP.
2.2. Характеризиране на третирани с EBP полизахариди
2.2.1. Характеристика на молекулярната маса
Оригиналните полизахариди са неразтворими във вода и обработката с EBP (τ = 1–10 min) увеличава тяхната разтворимост във вода и някои други разтворители поради намаляването на степента на полимеризация и образуването на продукти с ниско молекулно тегло (LMWP). Таблица 1 илюстрира промените в разтворимостта на обработения с EBP целулозен сулфат в дестилирана вода и 5% NaOH. Добивът на разтворима целулозна LMWP се увеличава с продължителността на EBP-обработката и достига 77,4% (за водоразтворима LMWP) след 10-минутна обработка. EBP-обработката за 2 минути значително намалява степента на полимеризация на неразтворимата фракция.
маса 1
Промените в разтворимостта на обработения с EBP целулозен сулфат в дестилирана вода и 5% NaOH.
| 0 | 1.8 | 6.8 | 93.2 | 960 |
| 2 | 22.7 | 45.3 | 54.7 | 460 |
| 10 | 77.4 | 100 | 0 | - |
1 Неразтворимият остатък съответства на продукти, които не се разтварят нито в 5% NaOH, нито в дестилирана вода.
Сместа от продукти със степени на полимеризация, вариращи от 10 и по-високи до глюкозни мономери, бяха открити в екстрактите от обработена с EBP целулоза чрез хроматографска техника, колона за изключване на йони Rezex RSO-олигозахарид Ag + (4%) (Phenomenex, Torrance, Калифорния, САЩ). Водоразтворимите LMWP имат степени на полимеризация най-вече в диапазона 3-10. Наблюдавани са и продукти с по-ниски (до глюкозни мономери) и по-високи молекулни тегла (Фигура 3). Отначало концентрацията на LMWP спада с намаляването на степента на полимеризация до 6 и след това се повишава отново. Разпределението на молекулното тегло на образуваните продукти е представено на фигура 4. Образуването на LMWP с преобладаващ тетрамер също се потвърждава от 13 C-NMR анализ.
Лиганд-обменната хроматограма на водоразтворимата целулоза LMWP, получена благодарение на EBP-обработката: 1 - глюкоза; 2–10 — LMWP с различни степени на полимеризация (числата съответстват на степента на полимеризация); RI - показател на пречупване.
Разпределението на молекулното тегло на продуктите, образувани при преработката на целулоза EBP: 1 - оригинална целулоза; 2 - целулоза, обработена в EBP за 2 минути; 3 - целулоза, обработена в EBP за 10 минути.
Изключителната хроматография на третиран с EBP хитин разкрива образуване на нискомолекулни хитоолигозахариди (COS) със средна молекулна маса, Mw = 1000-2000 Da и индекс на полидисперсност 2.2.
Тъй като образуването на COS с Mw = 800–2000 Da и степента на полимеризация, варираща от димери до хептамери по време на EBP-стимулираното разрушаване на хитозана е доказано преди [17], същият механизъм на EBP-стимулираната обработка за всички полизахариди може да бъде предполагаем.
2.2.2. Основни характеристики на полизахаридите EBP-обработка
Нашите настоящи експерименти разкриха зависимостта на водоразтворимия добив на LMWP от времето на третиране и бяха открити и някои други присъщи характеристики на обработката на хитин и целулоза EBP:
При оптимизирани условия на обработка (налягане на генериращата среда, характеристики на електронния лъч, дизайн на смесителното устройство) бяха необходими само 2 минути, за да се получи 85% добив на COS с ниско молекулно тегло от оригинален хитинов прах [17]. Максималният добив на водоразтворим целулозен LMWP (77,4%) е получен след 10 минути (Таблица 1).
Праговата връзка между добива на LMWP и продължителността на EBP-лечението. При оптимизирани условия на лечение разрушаването на хитин и целулоза спира, когато времето за обработка достигне съответно 7 и 15 минути.
2.2.3. Характеристика на химичната структура
Установено е 30% намаление на подредената фаза в третираните целулозни проби спрямо тази на оригиналното вещество, докато съдържанието на аморфна фракция е увеличено. Индексът на кристалност на целулозата (CI) се определя чрез XRD техниката. Установено е, че аморфността се увеличава след плазмохимично третиране: CI на модифицираната целулоза е 76.4%, докато CI на необработеното вещество е 86.4%. Същата тенденция беше показана и за хитина. Предварителните експерименти разкриват загубата на CI в следните граници: от 61,1% до 65,9% (оригинален хитин) до 50,9-55,2% след третиране с EBP в кислородсъдържаща среда.
Нискотемпературният EBP е източник на няколко активни кислородни вида (O, O •, синглетен кислород, OH • и др.) (Фигура 5), които се получават в плазмени химични процеси в много високи концентрации (до 10 10 –10 11 cm −3) [18]. Тези частици могат да бъдат отговорни както за разрушаването на полизахаридите, така и за тяхното окисляване. За да се разкрият окислителните промени в полизахаридните молекули, дължащи се на обработката в кислорода, беше приложена FTIR-спектроскопия. Анализът на IR-спектрите на целулозата показа интензивна абсорбция при 1720–1750 cm -1 (Фигура 6), което може да се отдаде на значителното увеличение на карбонилните C = O групи [20].
Оптичният спектър на кислород EBP във видими и NIR диапазони; пиковете, приписани на различните видове кислород, са в съответствие с [21,22].
- Обработка на хитин и целулоза в нискотемпературна плазма с електронни лъчи - PubMed
- Окончателен доклад Екокомпозити, подсилени с целулозни наночастици Алтернатива на съществуващите
- Събиране и оценка на реконвалесцентна плазма за лечение на COVID ‐ 19 защо и как Tiberghien - 2020
- Повишеният плазмен ендотелин-1 е свързан с намалена загуба на тегло след вертикална гастректомия на ръкава
- Обработка на тегло на улова с управление на складовете - Управление на веригата за доставки Dynamics 365