Siying Wei
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Румей Хан
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Jingyu Zhao
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Шуо Уанг
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Мейцин Хуанг
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Yining Wang
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Ян Чен
Ключова лаборатория по хранене, метаболизъм и безопасност на храните, Шанхайски институт по хранене и здраве, Шанхайски институти за биологични науки, Университет на Китайската академия на науките, Китайска академия на науките, 320 Yueyang Rd, Шанхай, 200031 Китай
Свързани данни
Използваните данни и материали са на разположение при поискване.
Резюме
Електронен допълнителен материал
Онлайн версията на тази статия (10.1186/s12986-018-0318-3) съдържа допълнителен материал, който е достъпен за оторизирани потребители.
Въведение
В това проучване имахме за цел да проучим дали нов тип нискобелтъчна нисковъглехидратна ящурна болест е успяла да се намеси в диабет тип 2 при мишки. По-специално, ние имахме за цел да проучим дали периодичното приложение на тази ящур може да възстанови функцията на β клетки, които са били загубени при db/db мишки; и дали чревната микробиота може да допринесе за интервенционния ефект на ящура.
Методи и материали
Модел на мишка
Шестседмични мъжки мишки C57BL/ksJ-db (db/db), закупени от SLAC (Шанхай, Китай), се поддържат в условия, свободни от патогени и се държат на 12-часов цикъл светлина/тъмнина в Института за хранителните науки. Всички мишки бяха претеглени в началото на проучването и разпределени на случаен принцип в две групи: стандартна чау със свободен достъп до храна и вода (CTRL) и периодично гладуване с ящур (
30% от дневния прием на калории от групата CTRL) в продължение на 1 седмица, последвано от хранене ad libitum за още една седмица (ящур). За модел на мишки с диабет тип 1, ниски дози стрептозотоцин (STZ) (40 mg/kg) се инжектират интраперитонеално в продължение на пет последователни дни. Мишките се претеглят и гладуват 8 часа преди STZ инжектиране. STZ се разтваря в натриев цитратен буфер (рН 4,5) и се инжектира равен обем цитратен буфер в контролни мишки. Тези експерименти са проведени в съответствие с насоките на Институционалния комитет по грижа и употреба на животните към Института по хранителни науки, Шанхайски институти за биологични науки (SIBS), Китайска академия на науките (CAS) с номер на одобрение 2010-AN-8.
Миша на гладно, имитираща диета
Ящурът (наречен Gembynear Nutrition Bar или Zhenbainian на китайски), използван в това проучване, е любезно предоставен от Пекинския изследователски институт по хранене, здравеопазване, наука за храните и технологии в Пекин (Пекин, Китай). Съставът и хранителните данни на ящура са дадени в Допълнителен файл 1: Таблици S1 и S2. Всички мишки бяха снабдени с прясна храна сутрин (9:00 ч. До 10:00 ч.). Обикновено мишките с ящур консумират доставената храна през първите няколко часа.
Събиране на фекални проби от мишки
Всички мишки бяха поставени в клетки поотделно. Пресни фекални проби от всички мишки бяха събрани в 14:00 ч.
15:00 ч. за да сведе до минимум възможните циркадни ефекти. Пробите се събират в празни микротръби върху лед и веднага се съхраняват при - 80 ° C за бъдеща употреба.
Измерване на кръвната глюкоза и инсулина
Мишките бяха на гладно в продължение на 6 часа (9:00 ч. Сутринта.
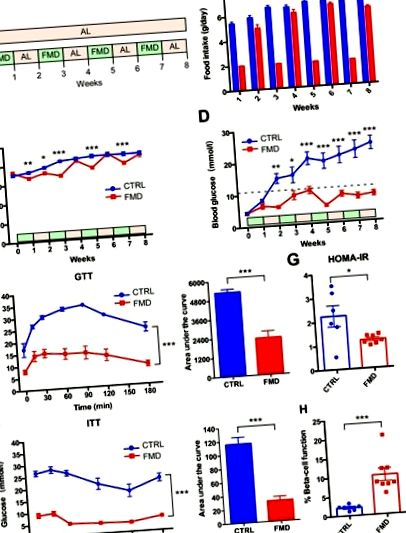
15:00 ч.) Преди измерване на кръвната захар. Кръвната глюкоза се измерва през опашната вена с помощта на системата за мониторинг на глюкоза в кръвта OneTouch UltraEasy (Lifescan, Milpitas, Калифорния, САЩ). Нивата на серумен инсулин се определят чрез анализ на миши ензим-свързан имуносорбент (Shanghai Enzyme-linked Biotechnology Co., Shanghai, China). Цялата кръв се изтегля от очната ябълка и плазмата се отделя чрез центрофугиране при 3000 rpm за 15 минути в микротрубички, третирани с EDTA-K2 (Kangjian Medical, Китай). Оценката на хомеостатичния модел (HOMA) се използва за количествено определяне на инсулиновата резистентност (HOMA-IR) и функцията на β-клетките (% B). HOMA-IR се изчислява, като се използва следната формула: HOMA-IR = (глюкоза на гладно × инсулин на гладно) /22,5. HOMA% B се изчислява, като се използва следната формула: HOMA-% B = (20 × инсулин на гладно)/(глюкоза на гладно - 3,5)%.
Тест за толерантност към глюкоза (GTT) и тестване за инсулинов толеранс (ITT)
Мишките бяха поставени в отделни клетки и гладувани в продължение на 4 часа за ITT (сутрешно гладуване) и гладувани цяла нощ за GTT. Интраперитонеално се инжектира глюкоза (2 g/kg) или инсулин (2 единици/kg). Нивата на кръвната глюкоза се измерват на 0, 15, 30, 60 и 90 минути след всяка инжекция.
Измерване на серумните и чернодробните параметри
Мишките бяха евтаназирани и кръвта бе незабавно събрана от орбиталния синус в третирани с EDTA-K2 микроепруветки (Kangjian Medical, Китай). След това микроепруветките бяха центрофугирани при 3000 rpm в продължение на 15 минути и плазмената супернатанта беше разделена на 3 порции за различни приложения. Всички плазмени проби, с изключение на тези за незабавна употреба, се съхраняват при - 80 ° C. Чернодробните липиди се екстрахират с хлороформ/метанол (2: 1). Плазмените нива на аспартат трансаминаза (AST) и аланин трансаминаза (ALT) се определят чрез комплект за определяне на AST/ALT (ShenSuo UNF, Китай). Плазмените и чернодробните нива на триглицеридите (TG) и общия холестерол (TC) се определят чрез колориметрични методи със съответните набори (ShenSuo UNF, Китай). Всички тези анализи бяха проведени в съответствие с инструкциите на производителя.
Имунофлуоресцентен анализ
Тъканите на мишката бяха фиксирани в 4% параформалдехид, дехидратирани и вградени в парафин. Тъканите бяха разделени на дебели филийки (4 μm), депарафинизирани в ксилол и рехидратирани чрез степенувана етанолова серия (100%, 90%, 70%, 50% и 30%) и вода. Антигенът се извлича чрез термична обработка с 0,1 М цитратен буфер (рН = 6,0) и срезовете се блокират с блокиращ буфер (PBS + 1% нормален кози серум + 0,1% трикстон-100). Използвани са следните първични антитела: анти-инсулин (C27C9 от Cell Signaling Technology, Бостън, Масачузетс, САЩ), анти-глюкагон (ab10988 от Abcam, MA, САЩ), анти-Ngn3 (sc-374442 от Santa Cruz Biotechnology, Далас, Тексас, САЩ) и anti-Ki67 (550609 от BD Biosciences, Ню Джърси САЩ). Секциите бяха инкубирани с първични антитела в овлажнена камера за една нощ. След измиване с PBS, срезовете бяха инкубирани в продължение на 1 h при RT с вторични антитела (Alexa Fluor 488 магарешко анти-заешко IgG, Alexa Fluor 546 магарешко анти-мишка, разреждане 1/500). Всички вторични конюгирани с флуорохром антитела са закупени от Life Technologies (Eugene, OR, USA). Изображенията на оцветените участъци са заснети с помощта на 40x обектив с конфокален микроскоп LSM 510 (Zeiss, Йена, Германия).
H&E оцветяване на чернодробни проби
Черният дроб на мишката се дисектира и промива в PBS. Всички тъкани бяха фиксирани в 4% параформалдехид за 48 h при стайна температура, дехидратирани и вградени в парафин. След това тъканите бяха разделени на дебели филийки (4 μm) и оцветени с хематоксилин и еозин (H&E).
Изолация на РНК, RT-PCR и PCR в реално време
Тъканите на черния дроб на мишките се лизират в реагент TRIzol (Invitrogen, СА, САЩ). Общата РНК се пречиства в съответствие с инструкциите на производителя, преписва се обратно и се синтезира до допълнителна ДНК с помощта на FastQuant RT Kit (с gDNase) (Tiangen Biotech Co., LTD, Пекин, Китай). PCR в реално време се провежда със системата за откриване на последователност ABI Prism 7900 в съответствие с препоръките на производителя (Applied Biosystems, CA, USA). Относителните нива на иРНК се определят количествено, използвайки сравнителния ΔCT метод и се нормализират до актин с последователностите на праймери, написани в Допълнителен файл 1: Таблица S4.
Анализ на чревната микробиота
Статистически анализ
Всички данни са изразени като средна стойност ± SEM. Значителните разлики се оценяват или чрез двустранни t-тестове на Student или чрез еднопосочен ANOVA, последван от теста Student-Newman-Keuls, където е подходящо.
Резултати
Интермитентното приложение на ящур се намесва в патологията на диабет тип 2 при db/db мишки без значителни промени в телесното тегло
Чернодробната стеатоза се подобрява чрез периодично приложение на ящур
- Прекъсващо гладуване с диетата 5 2 - Диабет онлайн
- Безопасно ли е периодичното гладуване за хората с диабет в ежедневието
- Здравословни храни за сърцето, които да включите във вашата диабетна диета
- Как да използваме растителна диета и периодично гладуване за отслабване
- Добре ли е периодичното гладуване за човек с диабет тип 2