Хроничният атрофичен гастрит (CAG) е често срещано заболяване на храносмилателната система с патологични характеристики с намаляващ брой или изчезване на присъщите жлези на стомашната лигавица. CAG е определена като предраково състояние на стомашния рак. Чревната метаплазия или интраепителната неоплазия, придружаваща атрофиралите жлези на стомаха, се счита за една от най-важните предракови лезии на рак на стомаха. Като често срещан злокачествен тумор, ракът на стомаха остава без задоволителна терапия и неговата патогенеза остава неясна, сериозно застрашаваща човешкия живот. Ето защо някои учени предлагат да се предотврати честотата на рак на стомаха, като се избягват предракови лезии. Ако CAG може да се обърне, честотата на рак на стомаха може да бъде значително намалена. За да се обърне и предотврати CAG и да се проучи нейната патогенеза и терапия, е необходимо да се разработи идеален, безопасен, стабилен, животински модел.
Да се изучи бърз, стабилен и безопасен метод за установяване на миши модел на човешка CAG.
Шестседмични мишки Kunming бяха разделени в контролна група с фосфатен буфер, a Helicobacter pylori (H. pylori) група, N-метил-N'-нитрогуанидин (MNNG) група, амонячна водна група и група, комбинираща H. pylori, MNNG и амонячна вода (наричана по-долу комбинираната група). Мишките се администрират с питейна вода, съдържаща амоняк, или се заразяват с H. pylori чрез сондаж. На 30-ия, 60-ия, 90-ия и 120-ия ден след последния H. pylori инфекция, мишките бяха избрани на случаен принцип, за да съберат стомашната си лигавица за оцветяване с хематоксилин еозин, откриване на оцветяване на терминален ник-край и имунохистохимично оцветяване за Bax и Bcl-2. В допълнение, H. pylori е изолиран, култивиран и идентифициран и е изчислена степента на колонизация. Кръв беше събрана за откриване на възпалителни фактори интерлевкин (IL) -1β, IL-8 и фактор на туморна некроза (TNF) -α и маркери на имунната функция CD4 и CD8, за да се потвърди успешното установяване на CAG модела.
Комбинираната група показва лека CAG на 90-ия ден и умерена CAG на 120-ия ден, докато други групи не показват CAG по това време.
Комбинацията от H. pylori, MNNG и амонякът е ефективен метод за разработване на миши модел на човешка CAG.
Основен съвет: Модел за хроничен атрофичен гастрит (CAG) беше успешно установен на 90-ия ден след последния Helicobacter pylori (H. pylori) инфекция на шестседмични мишки, като процентът на успеваемост достига 90%. Методът преодолява трудностите при колонизиране H. pylori при мишки и факта, че времето за колонизация е кратко. Освен това плъховете се заменят с мишки и по този начин методът е по-опростен и освен това по-евтин. Установените модели са стабилни и безопасни, следователно методът е относително идеален метод за установяване на миши модел на CAG. Той предоставя значителна помощ при проучване на механизмите за възникване и превенция на CAG.
- Цитат: Wei X, Feng XP, Wang LY, Huang YQ, Liang LL, Mo XQ, Wei HY. Подобрен метод за предизвикване на хроничен атрофичен гастрит при мишки. World J Gastrointest Oncol 2019; 11 (12): 1115-1125
- URL:https://www.wjgnet.com/1948-5204/full/v11/i12/1115.htm
- DOI:https://dx.doi.org/10.4251/wjgo.v11.i12.1115
Женски шестседмични куммински мишки с тегло между 180 и 200 g са закупени от Експерименталния център за животни, Медицински университет за националности Youjiang. Животните бяха настанени при контролирана влажност (50% ± 5%) и температура (25 ± 2 ° C) с цикъл светлина-тъмнина от 12 часа. Лечението на животните е било в съответствие с насоките на Националния институт по здравеопазване, а експерименталните протоколи са одобрени от Институционалния комитет за грижа и употреба на животните към Медицинския университет за националности Youjiang.
Проучването включва H. pylori щамове (Свързана болница на Медицински университет за националности Youjiang), MNNG (BIDE PHARMATECH Co., ltd), амонячна вода (Sinopharm Chemical Reagent Co., Ltd.), IL-1β, IL-8, TNF-α, CD4, CD8, CagA, Bax, комплект Bcl-2 (Beijing Solarbio Science and Technology Co., ltd.) И ДНК комплект (TIANGEN, BIOTECH Co., ltd.). Всички реактиви са с аналитично качество.
Общо 220 шестседмични мишки Kunming бяха произволно разделени в контролна група с фосфатен буферен разтвор, H. pylori група, група за MNNG, група с амонячна вода и група, комбинираща H. pylori, MNNG и амонячна вода (наричана по-долу комбинираната група). Всяка група съдържа равен брой мъжки и женски мишки.
Мишките в MNNG и комбинираните групи бяха администрирани с MNNG (5 mL/kg телесна маса) при концентрация 120 μg/mL чрез ежедневна сонда в продължение на седем последователни дни.
Мишките бяха хранени с питейна вода, съдържаща 0,02 тегл.% Амоняк през цялото време. Мишките от контролната група бяха хранени редовно без намеса.
Клинично изолиран H. pylori са използвани щамове и са били подложени на оцветяване по Грам, тестване на уреаза, тестване на оксидаза и каталаза и са идентифицирани като H. pylori чрез 16S рибозомно РНК секвениране. Щамовете са CagA и VagA положителни и се разпространяват и култивират в продължение на три дни. Концентрацията на биосинтетична човешка инсулинова среда (BHI) беше коригирана до 1 х 109 CFU/ml. H. pylori се прилага върху мишки чрез сонда след интрагастрално приложение на MNNG. Мишките са гладували в продължение на 12 часа преди сонда. Мишките в H. pylori и комбинираните групи се прилагат интрагастрално с 5 × 10 8 CFU от H. pylori. След това мишките се гладуват за твърди вещества и течности в продължение на 2 часа. Администрирането се провеждаше през ден, пет пъти последователно. За сравнение, 0,5 ml BHI среда бяха приложени към всяка мишка в контролната група чрез сондаж (също пет пъти).
Пет мъжки и пет женски мишки бяха избрани от всяка група на 30-ия, 60-ия, 90-ия и 120-ия ден. След това, проби от стомашна лигавица бяха събрани за патологично изследване чрез оцветяване с хематоксилин еозин (HE), оцветяване на крайни никели (TUNEL) и имунохистохимично оцветяване за Bax и Bcl-2. В допълнение, H. pylori е изолиран, култивиран и идентифициран и е изчислена степента на неговата колонизация. Кръв се събира за откриване на възпалителни фактори IL-1β, IL-8 и TNF-α и маркери на имунната функция CD4 и CD8. Освен това пробите от черния дроб, бъбреците и далака на групите за моделиране бяха открити чрез оцветяване с НЕ, за да се потвърди дали CAG е индуцирана успешно или не.
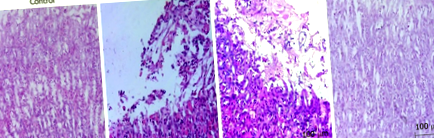
На 30-ия ден след инфекцията е установено, че всички мишки от комбинираната група са развили остър гастрит, докато няма CAG мишки. Не е показана значителна разлика на 60-ия ден в сравнение с тази на 30-ия ден. На 90-ия ден 90% (девет от десет) мишки са развили леко CAG, което се е развило до умерено CAG на 120-ия ден, както е показано на Фигура 1.
Откриването на оцветена с TUNEL стомашна лигавица на мишки в комбинираната група на 30-ия, 60-ия, 90-ия и 120-ия ден след инфекцията разкри, че епителните клетки на стомашната лигавица представляват значителна апоптоза. На 30-ия ден имаше по-голяма апоптоза на клетките, докато на 90-ия и 120-ия ден беше открита подобна, по-малко тежка апоптоза от тази на 30-ия ден, както е показано на Фигура 2.
Bax, директно активиран от p53, може да подобри апоптотичната чувствителност и да насърчи p53-медиирана клетъчна апоптоза. Bcl-2 протеинът може да образува хетеродимер с други про-апоптотични протеини, за да инхибира клетъчната апоптоза. Той също така играе анти-апоптозен ефект, като взаимодейства с апоптотичен протеазен активиращ фактор или инхибира освобождаването на цитохром с, активатор на митохондриални каспази. Следователно, клетъчната апоптоза може да бъде изследвана чрез откриване на експресията на Bcl-xL и Bax. Експресията на Bax в комбинираната група е била регулирана нагоре на 90-ия и 120-ия ден, докато тази на Bcl-2 е била регулирана надолу, което показва, че мишките в комбинираната група са претърпели значителна клетъчна апоптоза, в съответствие с характеристиките на CAG, както е показано на фигура 3.
Според постулатите на Робърт Кох, заразяване H. pylori трябва да бъде изолиран и култивиран от групите за моделиране, така че стомашната лигавица е събрана за изолиране и култивиране на H. pylori, и културите бяха идентифицирани. Конкретните резултати са описани по-долу.
Грам оцветяване: За оцветяване по Gram бяха избрани изолирани култури. Бактериите са грамотрицателни под микроскоп и криви, което е в съответствие с морфологичните характеристики на оцветените H. pylori, както е показано на фигура 4.
Откриване на CagA: CagA е типичен фактор на вирулентност на H. pylori. Беше проверено, че заразяващият H. pylori щамове съдържат CagA гена преди H. pylori инфекция чрез сонда. Следователно, ако изолираната бактерия беше H. pylori, геномът трябваше да съдържа CagA гена. Беше проверено, че изолираните култури съдържат CagA ген, както е показано на Фигура 5.
Откриване на оксидаза, пероксидаза и уреаза:H. pylori показва биохимичните характеристики на положителната оксидаза, пероксидаза и уреаза, така че трите фактора обикновено се използват като биохимични индекси за идентифициране H. pylori. Откриването на изолираните култури показа, че и трите са положителни, което съответства на биохимичните характеристики на H. pylori, както е обобщено в таблица 1.
| Група | Оксидаза | Пероксидаза | Уреаза |
| Положителен контрол | + | + | + |
| Отрицателен контрол | - | - | - |
| Изолирана култура | + | + | + |
Степен на H. pylori колонизация: Горните идентификации разкриха, че изолираната и култивирана бактерия е била H. pylori, чието население беше изчислено тогава, за да се оцени степента на неговата колонизация. На 30-ия, 60-ия, 90-ия и 120-ия ден след инфекцията е установено, че всеки грам стомашна лигавица на мишки от комбинираната група съдържа 1 × 10 4 до 1 × 10 5 CFU от H. pylori, и нямаше значителна разлика в различните периоди от време. Това показва, че колонизацията на H. pylori не намалява в рамките на 120 дни след H. pylori инфекция, така че H. pylori вероятно е изиграл значителна роля в патогенния процес на CAG, както е показано на Фигура 6.
Честотата и развитието на CAG може да предизвика освобождаването на различни възпалителни фактори като IL-1β, IL-8 и TNF-α. Установено е, че възпалителните фактори IL-1α, IL-8 и TNF-α имат повишена експресия на 30-ия, 90-ия и 120-ия ден, след като мишките в комбинираната група са заразени с H. pylori. Увеличението е по-голямо през първия месец, докато възпалителните фактори имат еквивалентна експресия през 90-ия и 120-ия ден, като и двата са по-ниски от тези на 30-ия ден. Резултатите са в съответствие с резултатите от оцветяване с TUNEL, като също така показват повишаване на регулацията на възпалителните фактори на CAG, както е показано на Фигура 7.
Експресията на CD4 + и CD8 + имунни клетки на мишки в комбинираната група и двете бяха намалени до 30-ия, 90-ия и 120-ия ден след инфекцията. Експресията се регулира значително надолу към 30-ия ден, докато двете имунни клетки се експресират по подобен начин на 90-ия и 120-ия ден, като и двете са били регулирани надолу в по-малка степен от тази на 30-ия ден. Това беше главно защото до 30-ия ден мишките все още бяха засегнати от имуносупресора MNNG и техните имунологични функции бяха нарушени. След елиминиране на влиянието на имуносупресора, имунологичните функции се подобряват, докато не могат да се възстановят до нормалните нива. Това е вероятно и защото самата CAG се характеризира с увреждане на имунологичната функция, както се вижда от Таблица 2.
| Група | CD4+ | CD8+ | ||||
| 30-ти г. | 90-та д | 120-та д | 30-ти г. | 90-та д | 120-та д | |
| PBS контрол | 52,56 ± 1,82 | 51,27 ± 2,05 | 52,84 ± 1,49 | 28,13 ± 1,92 | 29,41 ± 2,39 | 30,07 ± 1,24 |
| Комбиниран | 40,17 ± 1,36 | 44,38 ± 2,11 | 43,97 ± 2,08 | 22,08 ± 1,42 | 25,53 ± 1,87 | 25,19 ± 1,53 |
Тъй като химическите и биологични методи са комбинирани в проучването за установяване на модела, химическите реагенти вероятно ще доведат до нарушаване на функциите на органите на мишките и дори рак в тях. Следователно е необходимо да се открие увреждането на органите на мишките. Чрез събиране и оцветяване на тъканите на черния дроб, бъбреците и далака с HE, той разкрива, че няма увреждане. Това показва, че методът на моделиране не предизвиква усложнения на черния дроб, бъбреците и далака, с изключение на развитието на CAG, така че методът може да се счита за безопасен, както е показано на Фигура 8.
Гореспоменатите идентификации доказаха, че установените животински модели са модели на CAG. Статистическият анализ разкри, че 90% от мишките в комбинираната група развиват CAG на 90-ия и 120-ия ден след инфекцията и H. pylori колонизация е открита при всички такива мишки. За разлика от тях H. pylori група показа H. pylori колонизация, но няма CAG. Други групи не показват CAG или H. pylori колонизация, както се вижда от данните в таблица 3.
| Група | Броят на мишките, развиващи CAG | Броят на мишките с Hp колонизация | Степен на успех | ||
| 90-и ден след инфекцията | 120-и ден след инфекцията | 90-и ден след инфекцията | 120-и ден след инфекцията | ||
| PBS контрол | 0 | 0 | 0 | 0 | 0 |
| Hp | 0 | 0 | 90% (9/10) | 100% (10/10) | 0 |
| MNNG | 0 | 0 | 0 | 0 | 0 |
| Амонячна вода | 0 | 0 | 0 | 0 | 0 |
| Комбиниран | 90% (9/10) | 90 (9/10) | 100% (10/10) | 100% (10/10) | 90% |
Във връзка с методите на Бергин и др [16], Нагахара и др [17] и Джин и др [18], това проучване установява CAG модел с мишки Kunming чрез комбиниране H. pylori, MNNG и амонячна вода. Методът е предложен въз основа на факта, че инфекцията с H. pylori може да индуцира гастрит [19, 20], функциите на MNNG като химичен мутаген и канцероген [21, 22] и ролята на амонячната вода за неутрализиране на стомашната киселина и увреждане на стомашната лигавица [23, 24]. Модел на CAG беше успешно създаден до 90-ия ден след последния H. pylori инфекция на шестседмични мишки, като процентът на успеваемост достига 90%. Методът преодолява трудностите при колонизиране H. pylori при мишки и факта, че времето за колонизация е кратко. Освен това плъховете се заменят с мишки и по този начин методът е по-опростен и освен това по-евтин. Установените модели са стабилни и безопасни, следователно методът е относително идеален метод за установяване на миши модел на CAG. Доказано е, че е възможно да се изгради животински модел, аналогичен на човешкия CAG, който предоставя значителна помощ при изследване на механизмите на възникване и предотвратяване на CAG.
Хроничният атрофичен гастрит (CAG) е предракова лезия на рак на стомаха. Ако се лекува ефективно, GC ще бъде предотвратен. Така че превенцията и лечението на CAG са много важни. Той се нуждае от добър животински модел, който може да осигури етиологични изследвания и скрининг на терапевтични лекарства. Това е важен инструмент за изучаване на CAG.
Настоящите животински модели на хроничен атрофичен гастрит не са идеални, дълъг цикъл, висока цена, трудни за работа и нестабилни, така че са необходими по-добри животински модели.
Да се изгради по-бърз, безопасен, стабилен и ефективен модел на хроничен атрофичен гастрит с мишки.
Мишките, избрани за този метод, бяха шестседмични куммински мишки и Helicobacter pylori, N-метил-N'-нитрогуанидин и амонячна вода се комбинират за разработване на CAG модел.
Методът показва лека CAG на 90-ия ден и умерена CAG на 120-ия ден.
Представеният тук метод е по-бърз, безопасен, стабилен и ефективен.
Като се започне от етиологията на хроничния атрофичен гастрит, ходът на заболяването се симулира, за да се изследва прост, бърз, удобен и стабилен метод за моделиране.
Източник на ръкописа: Непоискан ръкопис
Тип специалност: Онкология
Страна на произход: Китай
Класификация на доклада за партньорска проверка
Степен А (отличен): 0
Степен B (много добър): B
Степен C (Добър): C, C
P-рецензент: Kay TM, Lin JK, Wittkopf N S-редактор: Zhang L L-редактор: Wang TQ E-редактор: Qi LL
- Сигнализирането за лептинов рецептор е необходимо за индуциран от диета атрофичен гастрит с високо съдържание на мазнини при мишки
- Синдром на раздразнените черва и хроничен гастрит, хемороиди, уролитиаза
- Helicobacter pylori, диетични фактори и атрофичен гастрит при пет японски популации с
- Билкови лекарства за хроничен гастрит, аюрведично лечение - причини; Симптоми
- Как диетата, имитираща гладуване, може да помогне за излекуване на рак, диабет и други хронични заболявания