Член
Концепцията за ензимната терапия датира поне от 19-ти век, когато панкреатичните ензими се предлагат на пациенти с екзокринна панкреатична недостатъчност. 1 През 1964 г. Кристиан де Дюве предлага ензимно лечение като терапевтична стратегия за лизозомно разстройство: три десетилетия по-късно заместването на глюкоцереброзидаза става стандарт за лечение на болестта на Гоше. 2 Наскоро Long et al. 3 са описани експерименти, предназначени да сондират ензимна активност, която генерира клас аминокиселини, способни на късо съединение на потока на митохондриалната енергия, подобно на, но независимо от разединяващия протеин 1 (UCP1) на кафява мастна тъкан. Мишките, лекувани с ензима или неговите метаболити, губят тегло в резултат на несвързано „разхищение на енергия“ в клетки, различни от кафявите адипоцити. Тези открития повишават възможността за борба със затлъстяването чрез добавки с този ензим или неговите биохимични продукти.
Създаването на отрицателен енергиен баланс за отслабване е принципно лесно, но трудно на практика в заседнало общество. Всъщност постигането на трайно увеличаване на енергийните разходи чрез редовни упражнения е изключително трудно за повечето, ако не и за всички хора с наднормено тегло или затлъстяване. Следователно химическото отделяне е привлекателна стратегия за разсейване на излишната енергия, тъй като излишните калории се „губят“ (под формата на топлина) чрез биохимично безполезно циклиране на метаболитни субстрати без необходимост от физически механични усилия. Тази стратегия не е нова: фармакологичният разединител 2,4-динитрофенол се използва широко като средство за отслабване през предходния век, но употребата му е прекратена поради системните токсични ефекти. 4
Фигура 1. 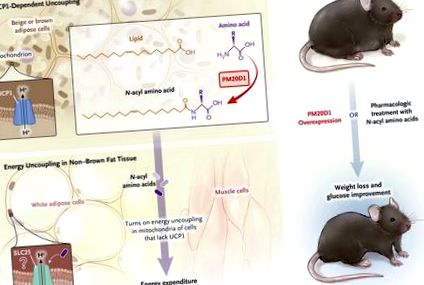
Химичното разединяване възниква в митохондриите чрез протонно шунтиране по разединяващ протеин 1 (UCP1) - зависим начин (UCP1 е уникален за кафява и бежова мазнина 5) и независим от UCP1 начин (като например с фармакологичен разединител 4). Индукцията на разединяване води до разсейване на излишната енергия и загуба на тегло при мишки. Лонг и колеги 3 съобщават, че съдържащият домен 1 пептидаза М20 (PM20D1) е ензим, който е обогатен с класически кафяви и бежови („кафяви мазнини“) адипоцити и се секретира в циркулацията и катализира синтеза на н-ацилни аминокиселини (панел А). Както ензимът, така и неговите продукти са способни да предизвикат отделяне на енергия в некафява мастна тъкан, като бяла мазнина и скелетни мускули, хипотетично, като служат като лиганди за митохондриални носители на семейство SLC25, които действат като протонни транслокатори (Панел Б). Свръхекспресия на PM20D1 или фармакологично лечение с н-ацилните аминокиселини водят до загуба на тегло и подобряване на метаболизма на глюкозата.
В проучвания върху гризачи Long и колеги идентифицират неизучен преди това ензим, известен като пептидаза M20 домейн, съдържащ 1 (PM20D1), който има разединяващо действие и изгаряне на мазнини. Този ензим отговаря на някои от критериите за ензимна терапия срещу затлъстяване. Първо, той се секретира, открива се в плазмата и се произвежда ендогенно. Освен това, PM20D1, който се генерира от вирусен вектор, е устойчив на разграждане в кръвта. Второ, експериментално повишените нива на PM20D1 влияят на катаболизма на мазнините при животните, което води до загуба на тегло и гликемично подобрение без компенсаторна орексигенова адаптация. Трето, за разлика от разединяването, което се медиира от кафява мастна тъкан, което изисква активиране на студа, индуцираната от PM20D1 загуба на тегло настъпва без излагане на студ и следователно е подходяща за термонеутрална среда (Фигура 1).
Как PM20D1 предизвиква загуба на тегло? Лонг и др. установи, че този ензим зашива липиди върху аминокиселини, за да генерира н-ацил аминокиселини. Тези новосинтезирани липидирани метаболити включват разединяване в клетки, които нямат UCP1, включително бели адипоцити и мускулни клетки. Въпреки че основните механизми очакват по-нататъшно изясняване, предварителните резултати разкриха обвързване на н-ацилни аминокиселини към митохондриални транспортери (като семейството SLC25), които могат да подхранват протонното шунтиране и по този начин да имитират UCP1 функция. Забележително е лечението на мишки с н-ацил аминокиселините увеличават енергийните разходи и намаляват глюкозата, като по този начин рекапитулират метаболитните ползи, наблюдавани при мишки, които свръхекспресират PM20D1. Ето защо, допълването на тези изгаряне на мазнини н-ацилните аминокиселини също представляват правдоподобна експериментална терапевтична стратегия.
PM20D1 не се намира в белите мастни клетки и се намира само в адипоцитите, експресиращи UCP1. Те включват класически междускапуларни кафяви и бежови адипоцити; последните са клетки, подобни на кафява мазнина, които се индуцират в ингвиналната бяла мазнина след излагане на студ. Въпреки че кафявата мастна тъкан намалява след ранна детска възраст, значително изобилие от адипоцити - които могат да бъдат индуцирани да станат бежови адипоцити - се намират в шията и подкожната бяла мазнина на възрастни хора. 5 Експресията на PM20D1 в термогенни UCP1-експресиращи адипоцити може да бъде намек относно неговия еволюционен произход. При хипотермична заплаха постепенно се набират неподвижна (медиирана от кафява мастна тъкан) и трепереща (медиирана от мускулите) термогенеза за защита на температурата на сърцевината. Треперещи недостатъци лов и събиране на ефективност и оцеляване в студа и следователно подборът може да е благоприятствал експресията на ензим, секретиран от кафява мастна тъкан, който запалва термогенезата в други видове тъкани (като бяла мастна тъкан и мускули) - като че ли представлява, дежурен спасителен корпус от хипотермия - докато индуцируемите бели адипоцити с времето не бъдат „оградени“.
Освен това, въпреки че плазмените нива на PM20D1 са непроменени при студеноаклиматизирани мишки, излагането на студ увеличава циркулиращите нива на много н-ацил аминокиселини. От диагностична гледна точка, средата ензим – субстрат – метаболит PM20D1 може да съдържа сурогат, който е показателен за резерва „кафяво-бежово“ на цялото тяло. Плазма „изложена на студ“ н-ацил аминокиселинен метаболомен подпис може да бъде използваем като проследим биомаркер на термогенен капацитет при хората.
Има, разбира се, много въпроси, които трябва да бъдат разгледани преди PM20D1 или неговите продукти могат да се разглеждат като кандидати за лекарства срещу затлъстяване. Физиологичните характеристики на PM20D1 трябва да бъдат напълно проучени при хората, а нецелевите токсични ефекти трябва да бъдат изследвани в предклинични модели, както се подчертава от смъртните случаи, причинени от 2,4-динитрофенол. Изследването на Long et al. осветява неизследвана изследователска територия на терапевтичната арена за затлъстяване и осигурява добре дошъл - макар и условен - контекст за много н-ацилни аминокиселини, които са открити при бозайници и чието биологично значение остава до голяма степен неизвестно.
- Синтетичното покритие за стомашно-чревния тракт може да предложи нова стратегия за лечение на диабет или затлъстяване
- Използвайки модела за хронична грижа за профилактика, лекувайте затлъстяването 3 съвета
- Ветеринарен дирлотапид, лекарство, използвано за лечение на затлъстяване при кучета; Нови одобрения за лекарства
- Епидемията от затлъстяване Последица от намалените енергийни разходи и отделянето на енергия
- Най-добрият подход за контрол на диабета - лечение на глюкоза или затлъстяване
