1 Катедра по клинична биохимия, болница Royal Prince Alfred, Сидни, Camperdown, NSW 2050, Австралия
2 Катедра по медицина, Университет в Сидни, NSW 2006, Австралия
3 Катедра по биохимия, болница Джон Хънтър, Нюкасъл, NSW 2305, Австралия
4 Национална реферална лаборатория за лизозомни, пероксизомни и свързани с тях генетични заболявания, патология на SA в женската и детска болница, Северна Аделаида, SA 5006, Австралия
5 Училище за молекулярни и биомедицински науки, Университет в Аделаида, Аделаида, SA 5005, Австралия
Резюме
Refsum's Disease е наследствено метаболитно разстройство, при което метаболитът от разклонени верижни мастни киселини се натрупва поради липса на подходящи окислителни ензими. Пациентите имат повишени нива на фитанова киселина в плазмата и високи концентрации на фитанова киселина в различни тъкани, което води до прогресивно увреждане на тъканите. Освен дегенерация на ретината или дистрофия на ретината, свързани с пигментоза на ретинит при възрастни, допълнителни симптоми включват хронична полиневропатия, церебеларна атаксия, сензоневрална загуба на слуха, аносмия, ихтиоза, както и скелетни, сърдечни, чернодробни и бъбречни аномалии. Настоящото управление включва избягване на хранителни източници на разклонени верижни мастни киселини и редовна плазмафереза, за да се предотврати натрупването на тези съединения за облекчаване на прогресиращия неврологичен дефицит. Двама братя с болестта на Refsum, които са имали прогресиращи симптоми въпреки оптималната диета и плазмафереза, са започнали нова терапия. Ние съобщаваме за ефекта на инхибитора на чревната липаза, Orlistat, който доведе до значително намаляване (
на 2 проби несдвоени т-тест) на средни нива на преплазмафереза на фитанова киселина със забавяне на прогресията на повечето от техните дерматологични и неврологични симптоми.
1. Въведение
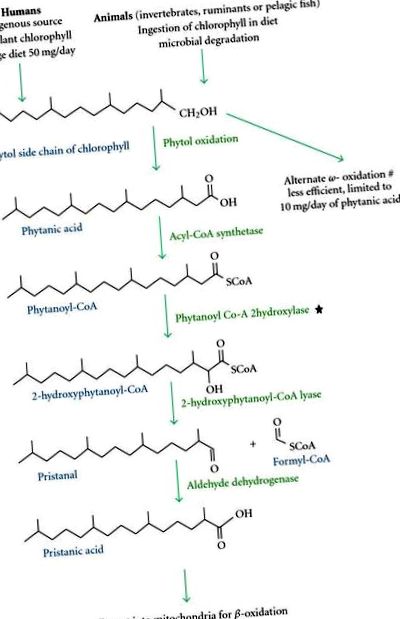
Refsum’s Disease, известна още като heredopathia atactica polyneuritiformis (HAP), е описана от норвежкия невролог Sigvald Refsum през 1946 г. Това е рядко сложно разстройство, което засяга много органи. Той има автозомно-рецесивен модел на наследяване поради мутации на хромозома 10р13. Носителите не са засегнати, но те могат асимптоматично да показват леко повишени нива на фитанова киселина, докато пациентите с болест на Refsum имат значително повишени нива (нормални
-път на окисление поради дефицит на пероксизомния ензим фитаноил-КоА хидроксилаза (PAHX) [2–5] (Фигура 1). От съществено значение е 3-метиловата група в позицията на този BCFA да бъде отстранена чрез
-етап на окисление, активиран от PAHX (в рамките на ендоплазмения ретикулум), за да се продължи по пътя на окислението. Пероксизомното окисляване е най-ефективният механизъм за метаболизма на фитанова киселина. В резултат на това високите нива на фитанова киселина се натрупват в кръвта и други тъкани, особено в мастната тъкан, нервната тъкан и астроцитите, където причиняват оксидативен стрес в митохондриите и окислително увреждане по време на хронично излагане [3, 6, 7]. При подгрупа пациенти, мутация на втори ген, кодиращ PEX7-пероксин 7 рецепторен протеин, участващ в пероксизомния внос на протеини, е идентифицирана като причина за фенотипа на болестта Refsum [2, 5].
-окислителни пътища в пероксизомите и митохондриите. ⋆ обозначава ензима с дефицит при пациенти с Refsum заболяване. # означава алтернативния по-малко ефективен
Хората имат вторичен, по-малко ефективен път за метаболизъм на фитанова киселина чрез -окисление, което не се засяга при тези пациенти [2, 5] (Фигура 1). Капацитетът на -окислението обаче е ограничен и е достатъчно само да се обработи намаленото снабдяване с фитанова киселина, свързано с диетични ограничения. В проучвания с животни се съобщава, че фибратните лекарства могат да индуцират този -окислителен път на метаболизма на фитанова киселина [2].
1.1. Текущо управление
Пациентите с болест на Refsum се нуждаят от мултидисциплинарен мониторинг за откриване на сърдечни, офталмологични и неврологични прояви. Хората не синтезират фитанова киселина, набавяйки я почти изключително от диетата си. Фитанова киселина се съдържа в месото, пелагичната риба и млечните продукти [2]. Хората също превръщат фитола, странична верига от хлорофил, намираща се в зелените листни зеленчуци, във фитанова киселина. Невъзможно е да се постигне диета, която е напълно без фитанова киселина. Управлението на болестта Refsum изисква ограничаване на приема на фитанова киселина с диета до фигура 2
След потвърждаване на диагнозата чрез измервания на серумна фитанова киселина и двамата братя започнаха ниско фитанова диета и плазмафереза. Нивата на плазмената фитанова киселина на изходно ниво и с диетично лечение плюс плазмафереза са показани на Фигура 3 (а). Въпреки това интензивно лечение, двамата братя продължават да имат прогресиращи симптоми и непълен контрол на плазмените нива на фитанова киселина (над 10 пъти горната граница на нормата). Препоръчват се значително по-ниски цели на лечението, за да се минимизират усложненията или прогресията на заболяването.
На този етап те бяха насочени към клиниката за липиди и метаболитни разстройства в болница Royal Prince Alfred в Сидни за по-нататъшна оптимизация на лечението.
2.1. Метод
AF и VF започнаха лечение с Orlistat в стандартната доза от 120 mg три пъти дневно преди хранене. Въпреки това тяхното съответствие беше непълно и те успяха само две дози на ден през първите няколко месеца. Те продължиха подходяща диета с ниско ниво на фитанова киселина с достатъчен прием на калории, за да се избегне загуба на тегло и редовен (на всеки 3 седмици) плазмен обмен. Средните нива на фитанова киселина преди плазмаферезата са изчислени за периодите преди (април 2000 - юни 2005) и по време (юни 2005 - януари 2010) терапия с орлистат, (Фигура 3 (b)). Хранителните биохимични маркери, включително нивата на мастноразтворими витамини, се наблюдават на изходно ниво и на редовни интервали, но не се изискват добавки. Фитановата киселина се измерва чрез газова хроматография, използвайки 25 m × 0,32 mm i.d. Капилярна колона SGE BP-20; метилестер на нонадеканова киселина (19: 0) е използван като вътрешен стандарт и е калибриран срещу метилов естер на фитанова киселина (Ultra Scientific, САЩ).
3. Резултати
При AF средното ниво на фитанова киселина в плазмата (Фигура 3 (b)) при диета и плазмафереза на всеки 3 седмици е 14,8 mg/dL (SD 10 mg/dL), падайки до 6,7 mg/dL (SD 2,8 mg/dL) след добавяне на незаслепена терапия с орлистат (P -Тест). Той съобщава за клинично подобрение на симптомите на полиневропатия, атаксия, ихтиоза, синдром на раздразнените черва и сърдечна аритмия. При VF средното ниво на плазмена фитанова киселина (Фигура 3 (b)) при диета и плазмафереза е 19,0 mg/dL (SD 13,0 mg/dL), падайки до 8,2 mg/dL (SD 5,5 mg/dL) по време на неслепена терапия с орлистат (P -Тест). Това е свързано с подобряване на симптомите на атаксия, загуба на слуха и сърбеж. Въпреки това VF продължава да страда от прогресивно увреждане на зрението, което се е подобрило след двустранна операция на катаракта. През този период AF и VF поддържат стабилно тегло през по-голямата част от времето с кратки периоди на загуба на тегло, свързани с леко повишаване на измерените нива на фитанова киселина, решаващи със стабилизиране на теглото,.
4. Дискусия
Орлистат може да бъде полезен при лечението на други метаболитни нарушения, при които разтворимите в липиди материали от червата допринасят за патологията. По-специфично лечение за ситостеролемия се предлага чрез инхибитора NPC1-L1, езетимиб. Използвали сме Орлистат за лечение на хиломикронемия, свързана с масивна хипертриглицеридемия, която крие риск от остър панкреатит. Тези пациенти са останали свободни от панкреатит по време на терапията с Orlistat, но нивата на триглицеридите и клиничното протичане на това състояние са известни променливи. Ще се изисква широкомащабно рандомизирано клинично изпитване на употребата на Orlistat, за да се оцени потенциалът му за профилактика на панкреатит при хиломикронемия. Този доклад за терапевтичния ефект на Орлистат при болестта на Refsum изисква потвърждение при други пациенти. Използването на Орлистат за намаляване на плазмените нива на фитанова киселина може да позволи намаляване на интензивността на диетичната терапия и плазмаферезата, което би довело до значителна полза за пациента и намаляване на разходите за здравните системи. Той може също така да промени благоприятно прогресията на клиничните прояви на болестта Refsum.
Конфликт на интереси
Авторите съобщават, че няма конфликт на интереси.
Благодарности
Авторите са длъжници на Здравните служби за деца, младежи и жени, Катедра по генетична медицина в Северна Аделаида, Южна Австралия, за анализ на фитанова киселина, отделението по плазмафереза в болница Джон Хънтър, Нюкасъл, Болничния комитет по лекарствата в болница RPA за доставката на Орлистат . Те също така признават продължаващата координация и сътрудничество между мултидисциплинарните екипи, които се грижат за тези пациенти.
Препратки
- A. J. Wills, N. J. Manning и M. M. Reilly, „Рефсумова болест“ Месечен вестник на Асоциацията на лекарите, об. 94, бр. 8, стр. 403–406, 2001. Изглед в: Google Scholar
- A. S. Wierzbicki, M. D. Lloyd, C. J. Schofield, M. D. Feher и F. B. Gibberd, „Рефсумова болест: пероксизомно разстройство, засягащо фитанова киселина α-окисляване, " Вестник по неврохимия, об. 80, бр. 5, стр. 727–735, 2002. Преглед на: Сайт на издателя | Google Scholar
- P. Schönfeld и G. Reiser, „Ротеноноподобното действие на фитановата киселина с разклонена верига предизвиква оксидативен стрес в митохондриите,“ Списанието за биологична химия, об. 281, бр. 11, стр. 7136–7142, 2006. Преглед на: Сайт на издателя | Google Scholar
- M. A. McDonough, K. L. Kavanagh, D. Butler, T. Searls, U. Oppermann и C. J. Schofield, „Структурата на човешката фитаноил-CoA 2-хидроксилаза идентифицира молекулярните механизми на болестта Refsum,“ Списанието за биологична химия, об. 280, бр. 49, стр. 41101–41110, 2005. Преглед на: Издателски сайт | Google Scholar
- D. M. Van Den Brink, P. Brites, J. Haasjes et al., „Идентифициране на PEX7 като втория ген, участващ в болестта Refsum“, Американски вестник за човешката генетика, об. 72, бр. 2, стр. 471–477, 2003. Преглед на: Издателски сайт | Google Scholar
- G. Reiser, P. Schonfeld и S. Kahlert, „Механизъм на токсичност на разклонена верига мастна киселина фитанова киселина, маркер на Refsum’s Disease, в астроцитите, включващи митохондриално увреждане,“ Международно списание за неврология в развитието, об. 24, бр. 2-3, стр. 7136–7142, 2006. Изглед на: Google Scholar
- S. Idel, P. Ellinghaus, C. Wolfrum et al., "Разклонените верижни мастни киселини индуцират зависима от азотен оксид апоптоза в съдовите гладки мускулни клетки", Списанието за биологична химия, об. 277, бр. 51, стр. 49319–49325, 2002. Преглед на: Сайт на издателя | Google Scholar
- К. Рутер, „Болест на Refsum за възрастни, дистрофия на ретината с терапевтични възможности, резюме“, Офталмолог, об. 102, бр. 8, стр. 772–777, 2005. Изглед в: Google Scholar
- B. C. Ramsay, K. Meeran, D. Woodrow et al., „Кожни аспекти на болестта на Refsum“, Вестник на Кралското общество по медицина, об. 84, бр. 9, стр. 559–560, 1991. Изглед в: Google Scholar
- T. C. Britton и F. B. Gibberd, „Семейство с heredopathia atactica polyneuritiformis (болест на Refsum)“, Вестник на Кралското общество по медицина, об. 81, бр. 10, стр. 602–603, 1988. Преглед в: Google Scholar
- J. P. R. Dick, K. Meeran, F. B. Gibbert и F. C. Rose, „Хипокалиемия при остра болест на Refsum“, Вестник на Кралското общество по медицина, об. 86, бр. 3, стр. 171–172, 1993. Изглед в: Google Scholar
- Клиничен подход на полиартрит към медицинско заболяване на ставите (Сборник) DVM 360
- Нов подход за перфорация на пептична язва - Ahmadinejad - 2020 - Доклади за клинични случаи -
- Омега-3 мастни киселини; Обещаваща нова терапия за безалкохолна мастна чернодробна болест Клинична
- Лечение с орлистат на неконюгирана хипербилирубинемия при болест на Crigler-Najjar A, рандомизирано
- Укрепване на слузта нов терапевтичен подход за улцерозен колит