Резюме
Чревната микробиота поддържа симбиотична връзка с гостоприемника и регулира няколко важни функции, включително метаболизма на гостоприемника, имунитета и чревната бариерна функция. Чревните възпаления и възпалителните заболявания на червата (IBD) са често свързани с дисбиоза на чревната микробиота. Промените в чревната микробиота и свързаните с тях промени в метаболитите, както и нарушения в чревната бариера са доказателство за връзката между чревната микробиота и чревното възпаление. Последните проучвания са установили, че много фактори могат да променят чревната микробиота, като ефектите от диетата се изучават често. Вътрешните стресови фактори, включително стресови фактори от околната среда, излагане на антибиотици, нарушение на съня, физическа активност и психологически стрес, също могат да играят важна роля за промяна на състава на чревната микробиота. Тук обсъждаме ролята на чревната микробиота при чревно възпаление във връзка с диетата и други външни стресови фактори.
1. Въведение
Микроорганизмите се намират на почти всички открити повърхности на човешкото тяло и са еволюирали, за да развият мутуалистични взаимоотношения със своите домакини в продължение на милиони години [1]. Микробната общност процъфтява в рамките на своя гостоприемник, като поддържа балансиран състав и има роли в поддържането на хомеостазата на гостоприемника [2]. По-специално чревната микробиота е оформила развитието и функцията на имунната, метаболитната и нервната системи [3,4,5]. По този начин неестествените промени в състава на чревната микробиота, известни като дисбиоза, могат да доведат до няколко патологични нарушения [6,7]. Чревните заболявания са особено разпространени в западните общества. Повишената честота на тези заболявания предполага, че специфични фактори, включително диета, промени в околната среда, излагане на антибиотици, нарушение на съня, физическа активност и патологични стимули могат да предизвикат промени в състава в чревната микробиота [8,9].
2. Чревната микробиота и чревни възпаления
3. Ролята на диетата и чревната микробиота при чревни възпаления
Диетата е един от много важни фактори, които могат да повлияят на чревната микробиота и много други аспекти на човешкото здраве и болести. Чревната микробиота използва погълнатите хранителни вещества като енергиен източник във фундаментални биологични процеси и промените в типа или схемата на хранене могат да променят състава на чревната микробиота, тъй като видовете, по-подходящи за метаболизиране на нови видове диети, ще се увеличават в популацията, докато други видове могат да станат по-малко изобилие. Тези промени в състава на чревната микробиота могат да повлияят на физиологията на гостоприемника и устойчивостта на болестта [10].
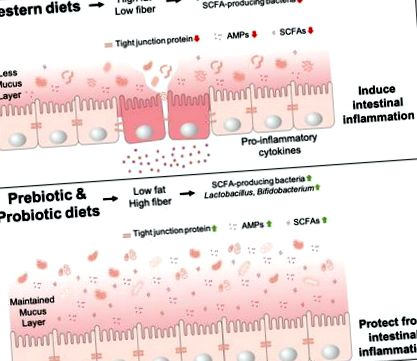
3.1. Западните диети
Диетата променя чревната микробиота, свързана с чревни възпаления. Западните диети, съдържащи високо съдържание на мазнини и липса на фибри, променят популацията на микробиотата в червата, което води до намаляване на бактериалните SCFA, приемащите AMP и производството на слуз, както и до силно експресиране на протеини. Освен това нарушава чревната бариера, води до бактериална транслокация и увеличава производството на провъзпалителни цитокини - което води до чревно възпаление. Междувременно, пребиотичните и пробиотичните диети осигуряват високо съдържание на фибри, което увеличава производството на SCFAs, AMPs, слуз и експресия на протеини с плътно свързване, което води до непокътната чревна бариера и предотвратява чревни възпаления.
3.2. Пребиотични диети
Вегетарианските диети и средиземноморските диети обикновено имат високо съдържание на диетични фибри, които съставляват основните източници на хранителни въглехидрати, достъпни за микробиота (MAC), които могат да бъдат усвоени от чревната микробиота [10,47]. Сред MACs има специфична подгрупа от въглехидрати, известни като пребиотици, които включват несмилаеми олигозахариди и по-точно фрукто-олигозахариди. Пребиотиците могат да подобрят растежа на пробиотици като Lactobacillus и Bifidobacterium [48]. Въпреки това, намаляването на количеството налични MAC предизвиква намаляване на производството на SCFA, което е от полза за гостоприемника, като служи като енергиен източник за недостъпни въглехидрати и мощни регулаторни молекули с физиологични ефекти [10,49].
При животински модели диетите, допълнени с фибри, състоящи се от късоверижни фруктоолигозахариди (SC-FOS) или късоверижни инулиноподобни фруктани със степен 4 на полимеризация (DP4), до тринитробензен сулфонова киселина (TNBS) модел на колит на плъхове намаляват чревното възпаление, както се доказва от намалени нива на TNF-α и NOS, докато делът на Lactobacillus и Bifidobacterium се увеличава [50,51,52]. В допълнение, приложението на перорален инулин намалява тежестта на индуцирания от декстран натриев сулфат (DSS) колит при плъхове и увеличава пропорциите на Lactobacillus и Bifidobacterium при спонтанни колити, трансгенни плъхове, третирани с обогатен с олиго-фруктоза инулин (OF-IN) или FOS [53,54,55]. Освен това, добавянето на OF-IN към тези трансгенни плъхове също повишава Bifidobacterium spp., Намалява нивото на провъзпалителните цитокини и увеличава имуномодулиращите молекули [55]. В обобщение, богатите на фибри диети могат да предпазят от чревни възпаления, като увеличат производството на SCFA и дела на противовъзпалителните бактерии, включително Lactobacillus и Bifidobacterium.
FODMAP диетите се считат за пребиотични диети, които служат като субстрати за бактериална ферментация, давайки SCFAs, включително бутират [56]. Нещо повече, диетите, които се различават по съдържанието на FODMAP, показват, че са свързани с вариации във фекалната микробиота [56]. Поглъщането на диети с нисък FODMAP служи за облекчаване на синдрома на раздразнените черва (IBS) и намаляване на общото бактериално изобилие, включително това на полезни бактерии като Bifidobacterium; бактерии, произвеждащи бутират, като Lachnospiraceae; и бактерии, разграждащи слуз, включително Ruminococcus gnavus и Akkermansia muciniphila [56,57,58]. Намалената консумация на въглехидрати може да обясни намаляването на изобилието на тези бактерии, тъй като те метаболизират въглехидратите за техните първични хранителни източници [56]. Следователно е важно да се контролира употребата на FODMAP диети при безсимптомната популация, като същевременно се избягва продължителната консумация. IBS често се среща при пациенти с IBD, докато диетите с ниско съдържание на FODMAP показват, че облекчават симптомите на IBS, директният ефект на FODMAP при чревно възпаление и IBD все още трябва да бъде разгледан (Фигура 1) [59,60].
3.3. Пробиотични диети
Няколко ферментирали храни съдържат пробиотици (като Lactobacillus и Bifidobacterium), включително познати храни като кимчи, кефир, суха ферментирала наденица, кисело мляко, сирене, комбуча и мисо, които съдържат жизнеспособни клетки в забележими количества, вариращи от 10 6 до 10 9 клетки/g или клетки/mL [13]. Пробиотиците са полезни за приемането на здравето чрез интегриране в чревната микробиота и въздействие върху нейния състав и активност чрез поне три различни механизма [61]. Те са в състояние да стимулират растежа на пребиваващите бактерии, като доставят метаболити като SCFA, витамини и други хранителни източници, произведени чрез разграждането на муцин. Пробиотиците могат директно да повлияят на изобилието от бактериални патогени чрез намаляване на рН, производството на лактат и SCFA, конкуренция на ниша или чрез производството на екзополизахариди (EPS) и бактериоцини. Някои щамове също могат да повлияят на пребиваващите бактерии, като взаимодействат с имунната система на гостоприемника [61].
Млечнокиселите бактерии (LAB) се използват широко при производството на ферментирали храни и се намират също в чревния тракт, както се потвърждава от откриването на Lactobacillus в човешки фекални проби [62]. Lactobacillus gasseri и L. reuteri се оказаха истински комменсали на червата, докато други видове, като L. plantarum, L. rhamnosus и L. paracasei, изглежда са преходни микробни таксони [63]. Пробиотиците също могат да играят противовъзпалителна роля, тъй като клиничните проучвания са установили, че консумацията на пробиотици може да се използва за лечение на чревни заболявания на червата [33]. Лечението на пробиотици, включително L. reuteri, L. salvarius UCC118, B. infantis, L. plantarum 299v и L. rhamnosus GG, имаше благоприятни ефекти при животински модели [64]. Компромисите в целостта на червата могат да обяснят развитието на чревни заболявания [40]. Следователно способността на пробиотиците да укрепват чревната бариера може да осигури известна защита от тези заболявания. Съобщава се, че лактобацилус подобрява функцията на чревната бариера чрез модулиране на експресията на гени, участващи в сигнализирането на стегнати връзки [65]. Лечението с VSL3 (смес от пребиотици и пробиотици) насърчава експресията на MUC2 и секрецията на слуз, които помагат за укрепване на чревната бариера [66].
Групите Lactobacillus (особено L. reuteri) и Bifidobacterium animalis subp. протеини от млечна продукция, които насърчават адхезията на слуз, наричани мукус-свързващи протеини (MUB), които подобряват взаимодействието между пробиотиците и гостоприемника [67,68]. LABs могат да предотвратят патогенна инвазия, като произвеждат антимикробни пептиди (AMP) като бактериоцини, които могат да унищожат патогенните бактерии, като образуват пори в бактериалните клетъчни стени и инхибират синтеза на клетъчната стена [69]. Освен това пробиотиците модулират микросредата, като произвеждат млечна и оцетна киселини, които имат антимикробни ефекти и създават киселинна среда, предотвратявайки растежа на бактериални патогени [70,71]. Регулирането на имунната система на гостоприемника и цитокиновия профил може да бъде един от основните механизми, чрез които пробиотиците са полезни. Взаимодействията между пробиотиците и имунната система на гостоприемника са видими в асоциираните с микроби молекулни модели, включително компоненти на клетъчната стена като полизахариди, пептидогликани, липопротеини и липотейхоеви киселини, които се разпознават от рецепторите за разпознаване на образи (PRR), изразени в епителни или имунни клетки на гостоприемника. . Един от по-известните PRR, който се задейства от видовете Lactobacillus е TLR2 (Фигура 1) [72].
4. Външни стресори и чревната микробиота при чревни възпаления
Вътрешните стресори са част от нашето ежедневие и могат да модулират състава и функцията на чревната микробиота. Вътрешните стресори могат да бъдат класифицирани в много категории в зависимост от конкретни дейности като излагане на околната среда, консумация на антибиотици, физическа активност, цикъл на съня и психологически стимули. Тези външни стресови фактори могат да взаимодействат с чревната микробиота, свързана с чревно възпаление.
4.1. Стресори за околната среда
Има много двупосочни взаимодействия между чревната микробиота и гостоприемника. По този начин факторите на околната среда, на които са изложени гостоприемниците, могат да повлияят на състава и функцията на чревната микробиота, което води до дисбиоза [73]. Няколко екологични фактора могат да повлияят на чревната микробиота, включително температура, голяма надморска височина (HA), шум, токсични вещества и замърсители [8].
Установено е, че излагането на топлина или топлинния стрес при хора и плъхове увеличава провъзпалителните цитокини, като IL-1β, IL-6 и TNF-α, за които е известно, че намаляват експресията на протеини в плътни връзки, включително оклудин, клаудин-2 и ZO-1, съответно [76,77,78]. Освен това, това може да увеличи дисфункцията на чревната бариера и може да доведе до повишена пропускливост на червата за ендотоксини, причинявайки възпаление и сепсис [79]. Чревната микробиота също може да бъде засегната от топлинен стрес. Изобилието на ентеробактерии (Enterobacteriaceae) и Staphylococcus се увеличава в илеума на плъхове след излагане на топлина [80]. Нещо повече, възпалените черва водят до цъфтеж на Enterobacteriaceae при пациенти с болест на Crohn или улцерозен колит, което може да усложни диагнозата на IBD [18]. Топлинният стрес има два важни фактора, които могат да причинят чревно възпаление и да усложнят IBD. Освен увеличаване на дисфункцията на чревната бариера чрез увеличаване на провъзпалителните цитокини, топлинният стрес също увеличава изобилието от ентеробактерии, което води до по-сложно чревно възпаление и потенциално до развитие на IBD. Все пак са необходими допълнителни проучвания, за да се обърне внимание на прякото взаимодействие между топлинния стрес, чревната микробиота и чревното възпаление.
Излагането на HA (около 3000 до 5000 m) може да доведе до хипобарна хипоксия (HH). HH е състояние, характеризиращо се с намалено парциално налягане на кислорода, което причинява кислороден дисбаланс в тъканите, което потенциално води до тежка физиологична и психологическа дисфункция както при хората, така и при животните [81]. Малко проучвания съобщават за ефектите на HH върху състава на чревната микробиота; въпреки това, някои проучвания са установили, че HH може да причини чревна дисфункция и да предизвика симптоми, подобни на тези, развити след излагане на HA [82,83]. Освен това, HH може да увреди чревната епителна бариера чрез скъсяване на ворсинките, разширяване на стегнатите връзки, намаляване на експресията на протеини в стегнати връзки и причиняване на дисбаланс в чревната микробиота [84]. Намаляването на полезните бактерии като Lactobacillus и промяната в чревната микробиота може да обясни как HH причинява нарушаване на чревната бариера и възпаление [84]. Известно е, че лактобацилусът предотвратява чревни възпаления, като увеличава експресията на протеин с плътно свързване, секреция на муцин и произвежда AMP за борба с патогенната инвазия [65,66,69]. Необходими са обаче допълнителни проучвания за изясняване на взаимодействието между HA или HH и IBD по отношение на чревната микробиота.
Промяната на чревната микробиота от стрес в околната среда влияе върху възпалението на червата. Излагането на студ променя чревната микробиота, което може да бъде свързано с увеличаването на популацията на бактерии, индуциращи ЕИО и да повлияе на чревната бариерна функция. Междувременно топлинният стрес увеличава популацията на Enterobactericeae и нарушаване на чревната бариера, което води до чревно възпаление. Други стресови фактори като голяма надморска височина, шум, замърсители и токсиканти намаляват противовъзпалителната чревна микробиота - включително Lactobacillus, Faecalibacterium и Lachnospiraceae - увеличават нарушаването на чревната бариера, което води до чревно възпаление.
4.2. Излагане на антибиотици
4.3. Нарушаване на съня
4.4. Физическа дейност
4.5. Психологически стрес
Чрез проучване in silico беше установено, че промяната на чревната микробиота при стрес намалява биосинтеза и метаболизма на мастни киселини като SCFA. Това може да предостави допълнително обяснение за негативните ефекти на стреса след чревно патогенно предизвикателство, тъй като бутиратът е добре известен, че предотвратява чревни възпаления [124]. Нещо повече, излагането на стрес намалява експресията на муцин-2 и лизозим, което може да допринесе за дисбиозата на чревната микробиота, като увеличи изобилието от провъзпалителни бактерии и намали изобилието от бактерии, произвеждащи бутират, като Lachnospiraceae. В допълнение, прехвърлянето на чревни микробиоти от изложени на стрес мишки осигури достатъчно условия, за да предизвика развитието на DSS-индуциран колит [125]. В обобщение, психологическият стрес намалява противовъзпалителните бактерии; Lactobacillus, Lachnospiraceae и SFCA, които могат да повишат чувствителността към чревно възпаление и допълнително IBD.
5. Заключения
Дисбиозата на чревната микробиота поради диета и външни стресови фактори, като фактори на околната среда, излагане на антибиотици, нарушение на съня, физическа активност и психологически стрес, води до промени в състава на чревната микробиота и производството на бактериални метаболити, нарушения на целостта на чревната бариера на гостоприемника и имунна система, което води до развитие на чревно възпаление и IBD (Фигура 3). Ето защо е важно да се разберат ефектите от диетата и външните стресови фактори върху чревната микробиота, за да се предотврати и излекува чревното възпаление. Необходими са обаче допълнителни изследвания, за да се разгледат изцяло преките взаимодействия между диетата, външните стресови фактори и чревната микробиота при чревно възпаление.
Диетични и външни стресови фактори, които променят състава на чревната микробиота и са свързани с чревни възпаления. Западната диета намалява бактериите, произвеждащи SCFA. Стресорите за околната среда, включително топлина, шум, голяма надморска височина, токсични вещества и замърсители намаляват Faecalibacterium, Lactobacillus и Lachnospiraceae, като същевременно увеличават Enterobacteriaceae. В допълнение, психологическият стрес намалява дела на Lactobacillus и Lachnospiraceae. Тези промени в чревната микробиота могат да намалят производството на слуз, SCFA и AMP, както и експресията на протеини в плътна връзка, което води до чревно възпаление.
Принос на автора
Концептуализация, S.L. и Y.K.L .; писане-преглед и редактиране, S.L., P.S., H.Y.K. и Y.K.L.
Финансиране
Тази работа беше подкрепена от безвъзмездни средства от Националната изследователска фондация на Корея (2018M3A9H3025030, 2017M2A2A6A01020874 и 2017M3A9F3043849) за Y.K.L.
Конфликт на интереси
Авторите не декларират конфликт на интереси. Финансистите не са играли роля в дизайна на проучването; при събирането, анализите или интерпретацията на данни; в написването на ръкописа или в решението за публикуване на резултатите.
- Ролята на диетата на лабораторните животни в оформянето на чревната микробиота
- Възникващата роля на затлъстяването, диетата и липидния метаболизъм при рак на простатата
- Разбиране на ролята на диетата при запек при възрастни
- Каква е основната роля на протеина в диетата за здравословно хранене SF Gate
- Каква роля играят морските дарове при диабетна диета; Ясни Спрингс храни