Едита Адамска
1 Център за клинични изследвания, Медицински университет в Белосток, Полша
Луцина Островска
2 Катедра по диететика и клинично хранене, Медицински университет в Белосток, Полша
Мария Горска
3 Катедра по ендокринология, диабетология и вътрешни болести, Медицински университет в Белосток, Полша
Адам Кретовски
1 Център за клинични изследвания, Медицински университет в Белосток, Полша
3 Катедра по ендокринология, диабетология и вътрешни болести, Медицински университет в Белосток, Полша
Резюме
Затлъстяването, влияещо върху увеличаването на честотата на диабет тип 2, сърдечно-съдови усложнения и рак, е нарастващ медицински проблем в световен мащаб. Чувството за глад и ситост се стимулира от „оста на червата и мозъка“, където решаваща роля играят стомашно-чревните хормони: глюкагоноподобен пептид 1, глюкозозависим инсулинотропен полипептид, панкреатичен полипептид, пептид YY, оксинтомодулин, холецистокинин и грелин . Тези хормони засягат не само функционирането на храносмилателния тракт, но също така могат да имат ефект върху секрецията на инсулин и са медиатори, които засягат мозъчните области, участващи в регулирането на приема на храна. Ефектът от действията им може да бъде както антагонистичен, така и добавен или синергичен, а секрецията им зависи от много фактори, като хранителни хранителни вещества или енергийното състояние на тялото. Промените в концентрациите на циркулиращите чревни хормони водят до активиране на различни пътища предимно в зоните на хипоталамуса и мозъчния ствол, които модулират поведението на хранене и редица метаболитни процеси.
Регулиране на оста на мозъка и червата
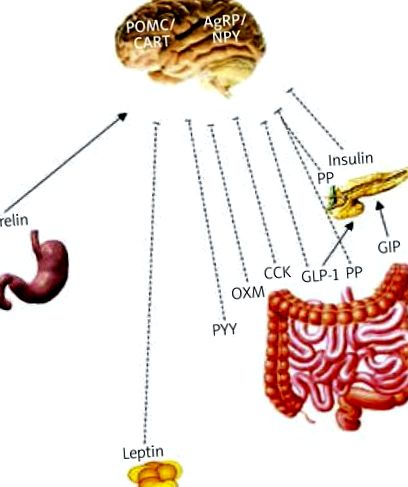
Централната нервна система (ЦНС) (паравентрикуларното ядро и дъговидното ядро на хипоталамуса), която приема сигнали от храносмилателния тракт, както и от мастната тъкан, играе ключова роля в енергийния баланс на тялото. Чувството на глад и ситост се регулира в ЦНС чрез оста мозък-черва, като редица хормони играят критична роля (Таблица I). Грелинът е основният и, както изглежда, единственият известен стомашно-чревен хормон, стимулиращ апетита. Неговите нива се увеличават с гладуване и стимулират приема на храна чрез блуждаещия нерв, мозъчния ствол и дъгообразното ядро на хипоталамуса; като има предвид, че стимулиращите ситостта хормони като панкреатичен полипептид (PP), пептид YY (PYY), оксинтомодулин (OXM), холецистокинин (CCK) и глюкагон-подобен пептид-1 (GLP-1) се освобождават по време на хранене (Фигура 1) [1 –6]. Някои от тези хормони влияят и върху секрецията на инсулин. Глюкагоноподобният пептид-1 и глюкозозависимият инсулинотропен пептид (GIP) са хормони, които стимулират секрецията на инсулин след хранене.
Регулация на глада/ситостта в ЦНС („ос на червата и мозъка“)
---I аноректичен ефект, → орексигенен/стимулиращ ефект, NPY - невропептид Y, AgRP - свързан с Агути пептид, POMC - проопиомеланокортин, CART - кокаин и амфетамин регулиран транскрипт, GLP-1 - глюкагоноподобен пептид-1, GIP - глюкозозависим инсулинотропен пептид, PP - панкреатичен полипептид, PYY - пептид YY, OXM - оксинтомодулин
Таблица I
Основните механизми на действие на чревните хормони и „сигнали за затлъстяване“ (модифициран съгласно Suzuki et al. Endocr J 2010) [6]
| Стомашно-чревни хормони - „сигнали за ситост“, регулиращи началото, края и интервалите между храненията | |
| GLP-1 | Инкретинов ефект, регулиране на ситостта, забавено изпразване на стомаха |
| GLP-2 | Влияе върху стомашно-чревната подвижност и трофичния ефект в чревния тракт |
| Грелин | Стимулиране на глада |
| ПИЙ | Регулация на ситост, забавено изпразване на стомаха |
| PP | Влияе върху стомашната моторика, регулиране на ситостта |
| OXM | Регулирането на ситостта, влияе върху секрецията на HCl, инкретиновите свойства |
| CCK | Влияе върху стомашно-чревната подвижност, екзокринната секреция на панкреатичния ензим, секреторната функция на жлъчния мехур |
| GIP | Инкретинов ефект |
| Амилин | Влияе на хомеостазата на глюкозата, стомашната моторика |
| „Сигнал за затлъстяване” хормони - роля в регулирането на образуването на енергийни резерви | |
| Инсулин | Влияе върху хомеостазата на глюкозата, синтеза на гликоген |
| Лептин | Регулира енергийния метаболизъм |
Стомашно-чревни хормони, влияещи върху глада/ситостта
Грелин
Грелинът, известен също като „хормонът на глада“, произведен в така наречените Х/А-подобни ендокринни клетки на стомашния фон, е единственият известен апетит-стимулиращ стомашно-чревен хормон [7]. Грелинът е признат като хормон, иницииращ храненето. Нивата му се повишават след гладуване през нощта, те се покачват приблизително два пъти непосредствено преди хранене и намаляват до най-ниските си стойности 1 час след всяко хранене (Фигура 2) [8, 9]. Намаляването на нивата на грелин след хранене допълнително зависи от калорийната стойност и състава на храната; например намалението е по-ниско след хранене на базата на мазнини в сравнение с хранене на базата на въглехидрати или протеини [10, 11]. Основните нива на грелин реагират компенсаторно на енергийния дефицит/излишък: ниски нива на грелин се наблюдават при затлъстяване, докато високи нива при анорексия (Фигура 2) [12, 13]. По-ниско намаление на нивата на грелин спрямо стойностите на гладно се наблюдава при лица със затлъстяване след хранене [14].
Средни 24-часови плазмени профили на грелин при пациенти с нормално тегло и затлъстяване (модифицирани от Cummings et al. NEJM 2002) [9]
Грелин се ацилира в позиция 3 в активна, ацилирана форма, която може да премине кръвно-мозъчната бариера и да се свърже с рецептор, който стимулира секрецията на растежен хормон (GH). В ЦНС грелинът стимулира производството на хипоталамус на невропептид Y (NPY) и протеин Agouti (AgRP), като влияе на разединяващите протеини на митохондриите (UCP2) [15–17]. Неутрализирането на ацилиран грелин намалява приема на храна и води до загуба на тегло при индуцирани от диета затлъстели мишки [18]. Дългосрочното приложение на грелин при експериментални животни води до увеличаване на теглото в резултат на хиперфагия и повишена експресия на ензими, които насърчават натрупването на мазнини в адипоцитите [19].
Холецистокинин
Холецистокининът (CCK) е първият стомашно-чревен хормон, за който е установено, че действа като подтискащ глада [20]. Холецистокининът се произвежда главно в L-клетките на дванадесетопръстника и тънките черва [21] в отговор на хранене, за да стимулира секрецията на панкреатичен хормон, жлъчната секреция [22] и инхибирането на изпразването на стомаха [23]. Повишаване на нивата на CCK в кръвта се наблюдава приблизително 15 минути след започване на храненето [22]. Терапевтичната употреба на CCK е ограничена поради неговия полуживот от 1-2 минути. Прилагането на CCK по-рано от 15 минути преди хранене не води до намаляване на размера на храненето [20].
Има няколко известни биоактивни форми на CCK, като CCK-8, CCK-22, CCK-33 и CCK-58, които се различават по броя на аминокиселините. Холецистокинин-33 е преобладаващата форма, открита в плазмата и червата [24]. Холецистокининът е широко разпространен в ЦНС, включително хипоталамуса, където най-често присъства в дорзомедиалното ядро и средната еминента на хипоталамуса [25].
Известни са два вида CCK рецептори, CCKA и CCKB [26, 27]. CCKA (известен също като CCK1) изглежда играе по-важна роля в регулирането на приема на храна. Администрирането на селективни антагонисти за този рецептор при експериментални животни премахва инхибиторните ефекти на интраперитонеалната инфузия CCK-8 [28]. Плъхове, без експресия на CCKA (Otsuka Long Evans Tokushima Fatty Rats), присъстващи с висок прием на храна, затлъстяване и хипергликемия [29]. Проучванията при нокаутиращи мишки обаче не потвърждават дългосрочните ефекти върху телесното тегло [30]. CCKA рецепторите се експресират в панкреаса, аферентните и еферентните неврони на блуждаещия нерв, ядрото на самотния тракт (NTS), областта postrema и хипоталамусното дорзомедиално ядро, които са ключовите региони, регулиращи приема на храна [26].
Влиянието на екзогенния CCK върху намаляването на приема на храна зависи от дозата на хормона както при плъхове [20], така и при хора [31].
Стомашната или коремна ваготомия премахва ефекта на ситост, индуциран от CCK-8, прилаган периферно, което показва, че CCKA рецепторите на блуждаещия нерв могат да играят решаваща роля в регулирането на приема на храна [32]. Периферното приемане на CCK намалява приема на храна, като намалява продължителността на храненето, както и количеството на погълнатата храна [31]. Доказано е, че CCK, прилаган във високи дози, причинява гадене и отвращение към вкуса [33–35]. Въпреки това, аноректичният ефект на ниски дози и неразположение при опитни животни не са свързани [36]. Централно администрираната CCK също намалява приема на храна и ефектът се усилва от едновременното приложение на лептин. CCK, заедно с лептина, вероятно ще играе важна роля в дългосрочното регулиране на теглото [37].
Проучвания върху използването на CCK при лечение на затлъстяване показват, че периодичните вливания на CCK в продължение на 6 дни намаляват размера на погълнатото хранене с поне 44%; обаче увеличава честотата на хранене с 162% или повече, но без ефект върху телесното тегло [38]. Освен това беше показано, че 2-седмична непрекъсната интраперитонеална инфузия на CCK води до бързо развитие на толерантност и следователно липса на ефект върху приема на храна или телесното тегло [39].
Проучванията показват, че при слабите индивиди нарастването на нивата на CCK след хранене е високо и бързо, което може да доведе до по-ранна поява на ситост, докато при затлъстели индивиди нивата на CCK след хранене остават повишени за по-дълго [40]. Нивата на CCK след хранене също могат да зависят от пола и състава на храненето. По-високи нива на CCK се наблюдават след поглъщане на храна с високо съдържание на мазнини. Увеличението на нивата на CCK е по-високо при жените [41].
Пептид YY
Пептидът YY е 36-аминокиселинен протеин с NPY и панкреатична хормоноподобна структура, произведен в стомашно-чревните L-клетки, главно в дебелото черво и ректума. Името му произлиза от две молекули тирозин (Y) в началната и крайната част на пептида. Фрагментът PYY3-36, който е активна форма, се открива главно в периферната циркулация [42, 43].
Физиологичната роля на PYY е свързана със сигнала за „прекратяване“ на храненето; Нивата на PYY са ниски след нощно гладуване, най-високите през 2-ия час след започване на храненето и постепенно намаляват в рамките на 6 часа от достигане на най-високата си стойност. Пептидът YY действа главно чрез Y2R рецептора в невроните, продуциращи NPY в хипоталамусовото дъгообразно ядро [42, 44].
Пептидът YY показва свойства на „ситния пептид“. Предишни проучвания разкриват ниски нива на PYY при пациенти със затлъстяване [45]. Периферното приложение на PYY при хора води до 30% или по-високо намаляване на калоричността на хранене, консумирано 2 часа след инфузията на PYY, и до 33% намаляване на количеството консумирана храна за 24 часа [44, 45]. Пикът на PYY след хранене допълнително зависи от калорийната стойност на храната и състава на храната (Фигура 3) [46].
- Ролята на чревните хормони в патогенезата и управлението на затлъстяването - ScienceDirect
- Ролята на лептина в затлъстяването, диабет тип 2, други метаболитни състояния HCPLive
- Ролята на стомашно-чревните хормони в патогенезата на затлъстяването и диабет тип 2 при Curtin
- Ролята на диетата и упражненията в превенцията на диабет тип 2 Nursing Times
- Ролята на свободното ежедневно ходене при увеличаване на телесното тегло и затлъстяване при диабет