Дейвид Л. Морис
От катедрата по молекулярна и интегративна физиология, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган.
Kae Won Cho
От катедрата по молекулярна и интегративна физиология, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган.
Yingjiang Zhou
От катедрата по молекулярна и интегративна физиология, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган.
Liangyou Rui
От катедрата по молекулярна и интегративна физиология, Медицински факултет на Университета в Мичиган, Ан Арбър, Мичиган.
Резюме
ОБЕКТИВЕН
SH2B1 е SH2 домейн-съдържащ адаптер протеин, експресиран както в централната нервна система, така и в периферните тъкани. Neuronal SH2B1 контролира телесното тегло; функциите на периферния SH2B1 обаче остават неизвестни. Тук изследвахме периферна регулация на SH2B1 на инсулиновата чувствителност и метаболизма на глюкозата.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Генерирахме мишки TgKO, експресиращи SH2B1 в мозъка, но не и периферни тъкани. Различни метаболитни параметри и инсулинова сигнализация бяха изследвани при мишки TgKO, хранени с диета с високо съдържание на мазнини (HFD). Ефектът на SH2B1 върху каталитичната активност на инсулиновия рецептор и инсулиновия рецепторен субстрат (IRS) -1/IRS-2 дефосфорилиране се изследва, като се използват съответно тестове in vitro киназа и in vitro дефосфорилиране. SH2B1 се експресира съвместно с PTP1B и се изследва медиирано от инсулинови рецептори фосфорилиране на IRS-1.
РЕЗУЛТАТИ
Делецията на периферна SH2B1 значително изостря индуцирана от HFD хипергликемия, хиперинсулинемия и непоносимост към глюкоза при мишки TgKO. Инсулиновата сигнализация е драматично нарушена в мускулите, черния дроб и мастната тъкан при мишки TgKO. Делецията на SH2B1 нарушена инсулинова сигнализация в първичните хепатоцити, докато свръхекспресията на SH2B1 стимулира автофосфорилирането на инсулиновия рецептор и фосфорилирането на тирозин на IRS. Пречистен SH2B1 стимулира каталитичната активност на инсулиновия рецептор in vitro. SH2 домейнът на SH2B1 е необходим и достатъчен, за да стимулира активирането на инсулиновия рецептор. Инсулинът стимулира свързването на SH2B1 с IRS-1 или IRS-2. Това физическо взаимодействие инхибира тирозин дефосфорилирането на IRS-1 или IRS-2 и повишава способността на IRS протеините да активират фосфатидилинозитол 3-киназния път.
ЗАКЛЮЧЕНИЯ
SH2B1 е ендогенен инсулинов сенсибилизатор. Той се свързва директно с инсулиновите рецептори, IRS-1 и IRS-2, и повишава инсулиновата чувствителност чрез насърчаване на каталитичната активност на инсулиновите рецептори и чрез инхибиране на тирозин дефосфорилирането на IRS протеините.
Инсулинът намалява кръвната глюкоза както чрез насърчаване на поглъщането на глюкоза в скелетните мускули и мастната тъкан, така и чрез потискане на производството на чернодробна глюкоза. При диабет тип 2 способността на инсулина да намалява кръвната глюкоза е нарушена (инсулинова резистентност) поради комбинация от генетични и екологични фактори, водещи до хипергликемия. Инсулиновата резистентност е не само отличителен белег, но и определящ фактор за диабет тип 2.
Инсулинът се свързва и активира инсулиновия рецептор. Инсулиновият рецептор тирозил фосфорилира субстратите на инсулиновия рецептор (IRS-1, -2, -3 и -4). IRS протеините, по-специално IRS-1 и IRS-2, инициират и координират множество пътища надолу по веригата, включително пътя на фосфатидилинозитол 3-киназата/Akt (1). Генетичната делеция на IRS-1, IRS-2 или Akt2 причинява инсулинова резистентност при мишки, което показва, че IRS протеин/фосфатидилинозитол 3-киназа/Akt2 е необходим за регулиране на холеостазата на глюкозата чрез инсулин (2–5). Инсулиновите рецептори и IRS протеините се регулират отрицателно от различни вътреклетъчни молекули, включително PTP1B, Grb10, Grb14, SOCS1, SOCS3, JNK, PKCθ, S6K и IKKβ (6-23). Относителният принос на тези отрицателни регулатори за прогресирането на инсулиновата резистентност е широко проучен (6–24). Въпреки това, инсулиновата сигнализация вероятно също ще бъде модулирана от положителни регулатори. В това проучване ние демонстрираме, че SH2B1 е нов ендогенен инсулинов сенсибилизатор.
Ние генерирахме модел на мишка, в който рекомбинантен SH2B1 се експресира специално в мозъка на SH2B1-нулеви мишки (TgKO), използвайки трансгенни подходи (31). Специфичното за невроните възстановяване на SH2B1 коригира както лептиновата резистентност, така и затлъстяването, което предполага, че невроналният SH2B1 регулира енергийния баланс и телесното тегло чрез повишаване на лептиновата чувствителност (31). В съответствие с тези заключения, полиморфизмите в локусите SH2B1 са свързани с лептинова резистентност и затлъстяване при хората (34–36). В тази работа ние демонстрираме, че делецията на SH2B1 в периферните тъкани уврежда инсулиновата чувствителност, независимо от затлъстяването при мишки TgKO. Нещо повече, ние демонстрираме, че SH2B1 директно насърчава инсулиновите отговори чрез стимулиране на каталитичната активност на инсулиновия рецептор и чрез защита на IRS протеините от тирозин дефосфорилиране.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Изследвания върху животни.
Клетъчни линии и трансфекция.
Клетките COS7 и HEK293 бяха отгледани в DMEM, допълнена с 5% говежди серум и трансфектирани с посочени плазмиди, използвайки Lipofectamine 2000 (Invitrogen). Клетки от яйчници на китайски хамстер (CHO IR и CHO IR/IRS − 1) бяха култивирани в среда на F-12 на Ham, допълнена с 8% FBS. Клетките са лишени от серум в продължение на 16 часа в DMEM (COS7 и HEK293) или F-12 (CHO), съдържащи 0.6% BSA, преди да бъдат третирани. Първичните чернодробни клетки се изолират от мъжки мишки (8 седмици) чрез перфузия на черния дроб с колагеназа тип II (Worthington Biochem) и се насаждат върху покрити с колаген плочи в M199, съдържащи 10% FBS, 100 единици/ml пеницилин и 100 μg/ml стрептомицин. След 2 часа първичните клетки се изплакват в PBS и се култивират в продължение на още 16 часа в средата E на Уилямс (Sigma), допълнена с 0.6% BSA, 100 единици/ml пеницилин и 100 μg/ml стрептомицин.
Имунопреципитация и имуноблотинг.
Имунопреципитацията и имуноблотингът се провеждат, както е описано по-горе (29,37). Протеините се визуализират с помощта на системата за инфрачервено изображение на Odyssey (Li-Cor Biosciences) или ECL (Amersham) и се определя количествено с помощта на софтуера Odyssey 1.2 (Li-Cor). Актин, фосфоАкт (Thr 308), Akt, инсулинови рецептори β, Myc, Shc и тубулинови антитела са от Санта Круз. Специфичното за фосфотирозин антитяло е от Upstate. AS160 антитялото е от Millipore, а фосфо Akt субстратното антитяло е от Cell Signaling. Phospho Akt (Ser 473) е от BioSource. Описани са антитела SH2B1 и IRS-1 (14,37).
Анализ на инсулинова рецепторна киназа.
Клетките бяха лишени от серум в продължение на 16 h, третирани с инсулин и разтворени в буфер за лизис на киназа (50 mmol/l Tris HCl [pH 7.5], 0.1% Triton X-100, 150 mmol/l NaCl, 1 mmol/l EDTA, 1 mmol/l Na3VO4, 1 mmol/l PMSF, 10 μg/ml апротинин, 10 μg/ml левпептин). Инсулиновият рецептор се утаява със зърнени агарозни зърна, свързани с пшеничен зародиш (WGA), промиват се три пъти в буфер за промиване (50 mmol/l Tris HCl [pH 7,5], 0,5 mol/l NaCl, 0,1% Triton X-100) и два пъти в буфер за реакция на киназа (20 mmol/l HEPES [pH 7,6], 0,1% Triton X-100, 5 mmol/l MgCl2, 100 μmol/l Na3VO4). WGA-имобилизираните протеини бяха предварително инкубирани в киназен реакционен буфер, допълнен с разтворим глутатион S-трансфераза (GST) самостоятелно, GST-SH2B1 или GST-SH2 слети протеини при 37 ° C. GST-IRS-1 (5–10 μg) и ATP (50 μmol/l) бяха добавени за иницииране на киназни реакции при 37 ° C. Реакциите бяха спрени чрез добавяне на SDS-PAGE зареждащ буфер и реакционните смеси бяха незабавно сварени. Протеините се разделят чрез SDS-PAGE и се имуноблотират с посочени антитела.
Анализи за дефосфорилиране.
Имунопречистените протеини се промиват в лизисен буфер и предварително се инкубират с GST-SH2B1 или GST (2 μg) във фосфатазен реакционен буфер (50 mmol/l Tris-HCl [pH 8.2], 100 nmol/l NaCl, 10 mmol/l MgCl2, 1 mmol/l DTT) за 15 минути при стайна температура с постоянно смесване. Алкална фосфатаза (New England Biolabs) се добавя при посочената концентрация и смесите се инкубират още 30 минути при стайна температура. Реакциите бяха спрени чрез добавяне на буфер за зареждане на SDS-PAGE и смесите бяха незабавно сварени. Протеините се разделят чрез SDS-PAGE и се имуноблотират с посочени антитела.
Статистически анализ.
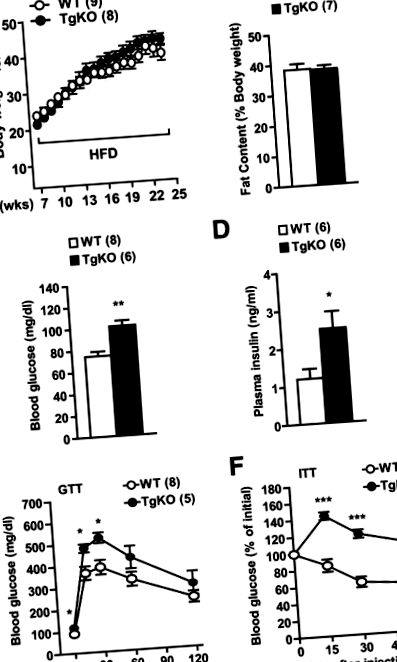
Данните са представени като средни стойности ± SE. Разликите между групите се определят чрез двустранни t-тестове на Student или ANOVA. P Фиг. 1 A и B). Въпреки това, нивата на кръвната захар на гладно (16 часа) са били 1,3 пъти по-високи при мишки TgKO, отколкото при мишки от див тип, хранени с HFD в продължение на 16 седмици (фиг. 1 С). Плазмените нива на инсулин на гладно са двойно по-високи при мишки TgKO, отколкото при мишки от див тип (фиг. 1 D). За изследване на инсулиновата чувствителност бяха извършени GTT и ITT. Нивата на кръвната глюкоза са били 23-26% по-високи при мишки TgKO от мишки от див тип 15 и 30 минути след инжектиране на d-глюкоза (фиг. 1 Д). Екзогенният инсулин значително намалява кръвната глюкоза при див тип, но не и при мишки TgKO по време на ITT (фиг. 1 F). Тези резултати показват, че загубата на периферен SH2B1 изостря индуцирана от HFD инсулинова резистентност, хипергликемия и глюкозна непоносимост, независимо от затлъстяването.
Клетката SH2B1 автономно насърчава инсулиновата сигнализация чрез своя SH2 домейн.
SH2B1 стимулира каталитичната активност на инсулиновия рецептор чрез свързването на неговия SH2 домен с Tyr 1158 в инсулиновия рецептор.
SH2B1 предпазва IRS протеините срещу дефосфорилиране на тирозин.
SH2B1 директно се свързва с IRS-1 и IRS-2 in vitro (37) и стимулирано от инсулина коимунопреципитация на SH2B1 с IRS-1 в клетките (фиг. 5 А). За да се определи дали това физическо взаимодействие инхибира дефосфорилирането на IRS-1 от фосфатази, клетките CHO IR/IRS-1, които стабилно експресират инсулиновия рецептор и IRS-1, са стимулирани с инсулин за насърчаване на фосфорилирането на тирозин на IRS-1. Фосфорилираният IRS-1 се имунопречиства, преинкубира с GST или GST-SH2B1 и се подлага на in vitro анализи за дефосфорилиране. IRS-1 е обвързан с GST-SH2B1, но не и с GST (данните не са показани). Алкална фосфатаза, дозозависима дефосфорилирана IRS-1 върху тирозини в предварително обработени GST проби; за разлика от това, алкалната фосфатаза не е в състояние да дефосфорилира IRS-1, свързан с SH2B1 (фиг. 5 Б). Инсулинът също така насърчава асоциирането на SH2B1 с IRS-2 и SH2B1 инхибира по подобен начин тирозин дефосфорилирането на IRS-2 (данните не са показани).
За да се определи дали SH2B1 инхибира IRS-1 дефосфорилирането в клетките, IRS-1 се коекспресира с PTP1B (протеинова тирозин фосфатаза) в отсъствие или присъствие на SH2B1. PTP1B дефосфорилиран IRS-1 и SH2B1 дозозависимо отслабват способността на PTP1B да дефосфорилира IRS-1 (фиг. 5 С). За да се определи дали SH2B1 е способен да стимулира IRS-1 фосфорилиране, без да стимулира активността на инсулиновия рецептор киназа, Y1158F се експресира съвместно с SH2B1. Въпреки че SH2B1 не беше в състояние да стимулира Y1158F киназната активност (фиг. 4 Д), SH2B1 все още значително засили фосфорилирането на тирозин на IRS-1 в клетки, експресиращи Y1158F (фиг. 5 D). По този начин, SH2B1 е вероятно да увеличи фосфорилирането на IRS-1, медиирано от Y1158F, като инхибира дефосфорилирането на IRS-1 чрез ендогенна протеинова фосфатаза (и).
За да се определи дали взаимодействието SH2B1-IRS стерично инхибира свързването на IRS протеини с фосфатидилинозитол 3-киназа, IRS-1 и Y1158F са коекспресирани със или без SH2B1 в клетки HEK293 и IRS-1-p85 асоциацията е изследвана чрез анализи за коимунопреципитация. Инсулин стимулира коимунопреципитацията на IRS-1 с р85, регулаторната субединица на фосфатидилинозитол 3-киназата; важното е, че SH2B1 значително подобрява инсулин-стимулираното p85 свързване с IRS-1 (фиг. 5 Д). Тези данни показват, че взаимодействието SH2B1-IRS не пречи на взаимодействието IRS-фосфатидилинозитол 3-киназа, а по-скоро увеличава асоциацията на IRS-фосфатидилинозитол 3-киназа чрез инхибиране на IRS дефосфорилирането. В съответствие с тези наблюдения, SH2B1 също подобрява стимулираното от инсулин, медиирано от Y1158F Akt фосфорилиране (Фиг. 5 F). Като цяло тези данни предполагат, че в допълнение към засилването на каталитичната активност на инсулиновия рецептор чрез свързване с Tyr 1158, SH2B1 също така насърчава активирането на IRS протеин/фосфатидилинозитол 3-киназа/Akt чрез инхибиране на IRS дефосфорилирането.
ДИСКУСИЯ
Инсулиновата резистентност е основният рисков фактор за различни метаболитни заболявания, включително диабет тип 2, неалкохолна мастна чернодробна болест, дислипидемия и сърдечно-съдови заболявания. Молекулните механизми, залегнали в основата на инсулиновата резистентност, са изключително сложни и не са напълно разбрани. Общоприето е, че нарушенията в предаването на инсулиновия сигнал играят ключова роля в развитието на инсулинова резистентност. По-рано забелязахме, че инсулиновата сигнализация се засилва от SH2B1 (29). Свръхекспресията на SH2B1 увеличава автофосфорилирането на инсулиновия рецептор и фосфорилирането на тирозин на IRS-1 и IRS-2 в култивирани клетки (29,43). Подобни наблюдения са докладвани независимо от две други групи (44,45). Освен това показахме, че генетичното заличаване на SH2B1 води до тежка инсулинова резистентност и диабет тип 2 при мишки (29). Въпреки това, SH2B1-нулевите мишки също са силно затлъстели поради резистентност към лептин (30–32), което увеличава възможността инсулиновата резистентност да е вторична спрямо затлъстяването при SH2B1-нулеви мишки. Следователно не е ясно дали периферният SH2B1 директно регулира инсулиновата чувствителност в инсулиновите целеви тъкани in vivo.
В заключение изглежда, че SH2B1 насърчава инсулиновата чувствителност при животните чрез множество механизми (фиг. 6). Neuronal SH2B1 повишава инсулиновата чувствителност индиректно чрез намаляване на затлъстяването (31). В мускулите, черния дроб и мастната тъкан SH2B1 се свързва с инсулиновия рецептор и стимулира каталитичната активност на инсулиновия рецептор, за да активира глобално пътищата надолу по веригата на инсулиновия рецептор. SH2B1 се свързва както с IRS-1, така и с IRS-2 и защитава IRS протеините от тирозин дефосфорилиране, увеличаване и/или удължаване на IRS протеин-медиирани пътища. В допълнение, SH2B1 образува димери и всяка молекула SH2B1 в димер SH2B1 може едновременно да се свърже с инсулиновия рецептор и IRS-1 (или IRS-2), като по този начин стабилизира инсулиновия рецептор/IRS-1 (или инсулиновия рецептор/IRS-2) комплекси . Следователно, SH2B1 и молекулите, които имитират тези функции на SH2B1, са потенциални терапевтични цели за лечение на затлъстяване и/или диабет тип 2.
Модел за регулиране на SH2B1 на инсулиновата сигнализация. В отговор на инсулин, SH2B1 се свързва директно с фосфо-Tyr 1158 в инсулиновия рецептор чрез своя SH2 домейн и стимулира киназната активност на инсулиновия рецептор, като по този начин засилва активирането на множество сигнални пътища надолу по веригата на инсулиновия рецептор (напр. Shc/MAPK и IRS/фосфатидилинозитол 3-киназни пътища). SH2B1 също се свързва с IRS-1 или IRS-2 и инхибира тяхното дефосфорилиране върху тирозини, за да насърчи конкретно активирането на IRS протеиново-медиирани пътища. Тъй като SH2B1 се димеризира чрез своя димеризационен домен, димеризираният SH2B1 може допълнително да подобри инсулиновата сигнализация чрез едновременно свързване както към инсулиновия рецептор, така и към IRS-1, за да стабилизира активния инсулинов рецептор с IRS-1 или да наеме IRS-1 към инсулиновия рецептор. PTP: протеин тирозин фосфатаза; P: фосфатна група.
Благодарности
Това проучване беше подкрепено от Националните здравни институти RO1 DK-065122, RO1 DK-073601 (за L.R.) и F31NS056575 (за D.L.M.) и от наградата на Американската диабетна асоциация 1-09-RA-156 (за L.R.). Тази работа използва ядрата, подкрепени от Центъра за изследване и обучение на диабет в Мичиган (финансиран от Националните здравни институти 5P60 DK-20572), Центъра за рак на Университета в Мичиган (финансиран от Националните здравни институти 5 P30 CA-46592), Университета на Шок центърът на Мичиган Нейтън (финансиран от Националните здравни институти P30AG013283) и Изследователския център за чревни пептиди на Университета в Мичиган (финансиран от Националните здравни институти DK-34933).
Не са докладвани потенциални конфликти на интереси, свързани с тази статия.
Благодарим на Xiao Jian Sun (Чикагски университет) за предоставянето на плазмиди GST-IRS-1 и Liang Sheng за помощта му в първични хепатоцитни култури.
- 14-годишната ми дъщеря няма диабет, но е диагностицирана с инсулинова резистентност и
- Естествено лечение СПКЯ 30 начина за подпомагане на хормони, инсулин и др
- Pro) Рениновият рецептор медиира индуцирана от затлъстяването антинатриуреза и повишено кръвно налягане чрез
- Роля на подкожната мастна тъкан в патогенезата на инсулиновата резистентност
- Няма ефект на Trp64Arg вариант на гена на β3-адренергичен рецептор върху загуба на тегло чрез диета и