Катедра по физиология,
Институт за изследвания на здравето на жените и децата,
Център за сърдечно-съдови изследвания,
Институт за сърце на Мазанковски Алберта, Университет на Алберта, Едмънтън, Канада
Катедра по акушерство и гинекология,
Институт за изследвания на здравето на жените и децата,
Център за сърдечно-съдови изследвания,
Институт за сърце на Мазанковски Алберта, Университет на Алберта, Едмънтън, Канада
Институт за изследвания на здравето на жените и децата,
Център за сърдечно-съдови изследвания,
Институт за сърце на Мазанковски Алберта, Университет на Алберта, Едмънтън, Канада
Институт за изследвания на здравето на жените и децата,
Център за сърдечно-съдови изследвания,
Институт за сърце на Мазанковски Алберта, Университет на Алберта, Едмънтън, Канада
Катедра по физиология,
Катедра по акушерство и гинекология,
Институт за изследвания на здравето на жените и децата,
Център за сърдечно-съдови изследвания,
Институт за сърце на Мазанковски Алберта, Университет на Алберта, Едмънтън, Канада
Адрес за заявки за повторно отпечатване и друга кореспонденция: S. T. Davidge, катедра по акушерство и гинекология/физиология, 220 HMRC, Унив. на Алберта, Едмънтън, AB, Канада T6G 2S2 (имейл: [имейл защитен]).
Резюме
Използвайки модел на гризачи на IUGR, индуциран от хипоксия, преди това нашата група предостави подробна характеристика на дългосрочните ефекти на пренаталната хипоксия върху съдовата функция (25, 26), както и върху сърдечната морфология, функция, метаболизъм и чувствителност ex vivo до увреждане на исхемия-реперфузия (IR) (33, 34, 47). Интересното е, че забелязахме, че някои от сърдечните и съдовите патологии, свързани с раждането от бременност, усложнена с IUGR (като ендотелна дисфункция, диастолна дисфункция на лявата камера и белодробна хипертония), са били на възраст (12 месеца), но не и при млади, възрастни (4 месеца) животни (33). Нещо повече, онези сърдечно-съдови патологии, присъстващи при млади възрастни потомци, изложени на хипоксия по време на развитието на плода (като повишена податливост към IR увреждане), изглежда се влошават от стареенето (26). Тези резултати предполагат, че предизвиканото от хипоксия програмиране може да увеличи податливостта към допълнителни обиди (като СН диети).
Последните проучвания от нашата група също описват, че потомците, изложени на пренатална хипоксична обида, са по-податливи на вторични обиди като затлъстяване, включено в диетата (15, 32). Например, постнаталната консумация на диети с високо съдържание на мазнини (HF; 45% съдържание на мазнини) от момента на отбиването до ранната зряла възраст от потомство, пренатално изложено на хипоксия, води до по-ранното и по-тежко развитие на компонентите на метаболитния синдром (MetS) . Те включват по-високи нива на инсулинова резистентност, дислипидемия, отлагане на мазнини в корема и циркулиращи възпалителни маркери (32). Способността на постнаталните хранителни обиди (като излагане на високочестотна диета) да изострят/индуцират сърдечно-съдови патологии при млади възрастни потомци, изложени на индуциран от хипоксия IUGR, е неизвестна.
Ресвератролът (Resv), известен също като 3,5,4′-трихидрокси-транс-стилбен, е молекула, за която е доказано, че предотвратява атеросклерозата, подобрява съдовата функция, отслабва хипертрофията на лявата камера и придава устойчивост на сърдечна исхемична травма (14 ). Наскоро демонстрирахме, че Resv подобрява повишената чувствителност към индуциран от диетата MetS, наблюдаван при млади възрастни потомци, които са били изложени на хипоксия вътреутробно (15). Ефектите на Resv върху сърдечно-съдовата система на млади възрастни потомци, изложени на пренатална хипоксична обида, не са изследвани. Следователно, ние допълнително предположихме, че допълването на високочестотни диети, изложени на хипоксия вътреутробно с Resv, също може да предотврати патологични сърдечно-съдови състояния, свързани с ранното начало на MetS.
Целта на настоящото проучване е да се изследва дали прилагането на високочестотна диета при потомство, родено от IUGR, може да предизвика по-ранна поява на хипертония, съдова дисфункция и/или анормална сърдечна функция или морфология. Вторична цел на това проучване беше да се определи дали постнаталното приложение на Resv може да подобри сърдечно-съдовите състояния, свързани с консумацията на високочестотна диета от потомство, изложено на IUGR, индуциран от хипоксия.
Животински модели и експериментални интервенции
Всички процедури в това проучване са одобрени от Комитета за хуманно отношение към животните към Университета на Алберта (протокол № 301/11/09D) и са в съответствие с насоките на Канадския съвет за грижа за животните и „Ръководство за грижа и използване на лабораторията Животни ”, публикуван от Националните здравни институти.
Индуциран от хипоксия IUGR модел (проучвания А и В).
Постнатално затлъстяване, предизвикано от диета (проучване А).
След отбиването на възраст 3 седмици мъжки потомци от всяко котило (IUGR; н = 22 потомство от 6 котила и контроли; н = 24 потомци от 6 котила) са разпределени на случаен принцип, за да получат или LF диета (-1 g g сухо тегло -1) и изчислени, както е описано по-рано (34, 45, 46). Измерванията на сърдечната функция се извършват на всеки 10 минути по време на 90-минутен протокол, който включва 40-минутен период на стабилизиране (аеробен), 10 минути исхемия без поток и 40 минути реперфузия (реперфузия). Продължителността на нарушението на исхемията без поток се основава на предишни експерименти от нашата група, използвайки подобен модел и методи (34). Сърца, които са показали необратима сърдечна аритмия (н = 5) бяха изключени.
Съдови изследвания (проучване А).
Веднага след сърдечна екстракция се извършват дисекции на съдови тъкани в ледено-физиологичен солев разтвор (PSS) (в mmol/l): 10 HEPES, 5,5 глюкоза, 1,56 CaCl2, 4,7 KCl, 142 NaCl, 1,17 MgSO4 и 1,18 KH2PO4, pH 7.4. Малки мезентериални артерии бяха изолирани и почистени от всички околни мастни и съединителни тъкани. Артериите бяха монтирани на миограф под налягане (Living Systems, Burlington, VT), за да позволят изобарни измервания на промените във вътрешния диаметър.
По време на 30-минутен период на уравновесяване съдовете бяха изложени на постепенно повишаване на налягането до 80 mmHg, последвано от връщане до 60 mmHg. За останалата част от експеримента съдовете се поддържат при 60 mmHg. За да се изследват съдовите отговори на метилхолин (MCh; 0,1 nmol/l до 100 μmol/l), беше извършена крива концентрация-отговор (CCRC) в отсъствие или присъствие на инхибитори след предварително свиване с фенилефрин (PE, 1 μmol/l). На първо място, една баня е избрана на случаен принцип, за да включва инхибитора на азотния оксид синтаза (NOS) н ω-нитро-1 -аргинин метилов естер хидрохлорид (1 -NAME, 100 μmol/l), докато втората баня се поддържа като контрола. След завършване на MCh CCRC и последващ период на измиване, l -NAME се прилага отново в допълнение към циклооксигеназния инхибитор меклофенамат (1 μmol/l). След това беше извършен втори MCh CCRC в присъствието на комбинираното инхибиране на простагландини и азотен оксид. И накрая, пасивните характеристики на съдовете бяха оценени чрез постепенно повишаване на налягането от 0 до 140 mmHg в присъствието на без съдържание на Ca 2+ PSS плюс папаверин (10 μmol/l).
Статистически анализ
За анализ се използва само по едно поколение от всеки язовир за всяко определяне. Следователно язовирите се считат за експериментална единица. Данните са представени като средни стойности ± SE, освен ако не е посочено друго. Разпределението на данните беше тествано с помощта на теста за нормалност D'Agostino и Pearson. Сравненията между две групи бяха оценени с помощта на несдвоени т-тест или тест на Ман-Уитни в зависимост от разпределението на данните. Разликите в измерванията, извършени между четири групи след хранителна интервенция, бяха тествани с помощта на двупосочен ANOVA с диета и IUGR като източници на вариация. След това беше използван post hoc тест на Bonferroni за сравняване на реплицирани средства по групи. A P стойност
Таблица 1. Хемодинамични параметри при съзнателни плъхове в покой и след стрес, предизвикан от остър въздух
Стойности, отчетени като средни стойности ± SE; н = 6 във всяка група. Resv, ресвератрол.
Таблица 2. Ехокардиографски параметри при IUGR и контрол на потомството, изложено на диети с ниско и високо съдържание на мазнини
Стойности, отчетени като средни стойности ± SE; н = 6 във всяка група.
RVET, време на изтласкване на дясната камера; PAAT, време за ускоряване на белодробната артерия; LV, лява камера; Ао, аорта; IVRT, изоволумно време за релаксация.
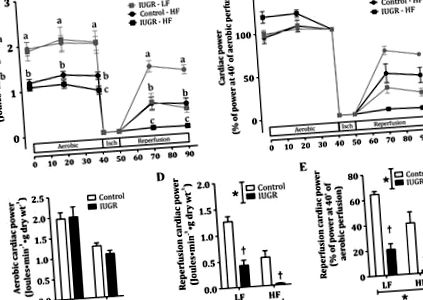
Фиг. 1.Проучване А: сърдечни показатели след стабилизиране (аеробно) и реперфузия след 10 минути исхемия без изтичане (isch) при контрол и вътрематочно ограничаване на растежа (IUGR), потомство, приемащо диета с ниско съдържание на мазнини (LF) или с високо съдържание на мазнини (HF). Данни за сърдечната ефективност ex vivo, представени като средни стойности ± SE от общата сърдечна мощност, отчетени като (джаули · мин −1 · g сухо тегло −1) (A) (34, 45, 46) и сърдечни показатели спрямо сърдечната мощност след 40 минути аеробна перфузия (Б.). Сърца от контрола (кръгове) и IUGR (квадратчета) хранеха LF (сенчести символи и линии) или HF (плътни символи и линии) диета за 9 седмици. ° С и д: средна максимална сърдечна мощност, развита съответно по време на аеробни и реперфузионни периоди. Е.: относително възстановяване на сърдечната мощност по време на реперфузия. н = 6 до 10 на група. *P
Фиг. 2.Проучване Б: сърдечни показатели след стабилизиране (аеробно) и реперфузия след 10 минути исхемия без изтичане (isch) в контрола и IUGR потомство, получаващи HF или HF + ресвератрол (Resv) диета. Данни за сърдечната ефективност ex vivo, представени като средни стойности ± SE от общата сърдечна мощност [(пиково систолично налягане - максимално предварително натоварване · сърдечен дебит · 0,13)/g сухо тегло]] (джаули · мин -1 - g сухо тегло -1) (A) и сърдечни показатели спрямо сърдечната мощност след 40 минути аеробна перфузия (Б.). Сърца от контрола (кръгове) и IUGR (квадратчета), хранени с високочестотна диета с (отворени символи и пунктирани линии) или без (плътни символи и линии) Resv за 9 седмици. ° С и д: средна максимална сърдечна мощност, развита съответно по време на аеробни и реперфузионни периоди. Е.: относително възстановяване на сърдечната мощност по време на реперфузия. н = 6 на група. *P
Ефект на IUGR и диета след раждането върху съдова функция Ex Vivo
При липса на инхибитори, сегментите на мезентериалната артерия от всички експериментални групи показват сравним контрактилен отговор на 1 μmol/l PE (Фиг. 3A). Инкубацията с l -NAME предизвика значително увеличаване на контрактилния отговор на РЕ от артериалните сегменти от всички експериментални групи, с изключение на онези потомци, изложени на пренатална хипоксична обида и получаващи СН диета. Нямаше разлики в съдовия отговор на PE след инкубация както с l -NAME, така и с MCh (Фиг. 3Б.).
Фиг. 3.Параметри Ex vivo на съдовата функция. Съдова констрикция в отговор на 1 μmol/l фенилефрин (PE) при отсъствие (Контрол) или наличие на инхибитор на азотен оксид (NO) синтаза н ω-нитро- 1 -аргинин метилов естер хидрохлорид (l -NAME, 100 μmol/l) (A) или l -NAME плюс инхибитора на циклооксигеназата меклофенамат (Meclo, 1 μmol/l) (Б.). ° С: прогнозен процент принос на NO, простаноиди или не-NO, непростаноидни механизми в общата ваксидилация, предизвикана от метилхолин (MCh). д: пасивни реакции, промени в диаметъра на съда, до увеличаване на налягането от 0 до 140 mmHg. Различни букви (а и б) представляват статистически значими разлики между експериментални групи във всеки момент от време след тест Bonferroni post hoc. †P
Не са наблюдавани различия между групите в съдовите отговори на MCh или прогнозния принос на основните вазодилататорни механизми (като азотен оксид и простаноиди) в съдовия отговор на MCh (Фиг. 3° С). Нито IUGR, нито СН имат ефект върху първоначалните диаметри на мезентериалните артерии. Пасивният отговор на промените в интралуминалното налягане обаче демонстрира, че артериалните сегменти от потомството, получаващи високочестотна диета, показват повишаване на съдовата съвместимост независимо от пренаталната анамнеза (Фиг. 3д).
Тези наблюдения имат много важни клинични последици. Първо, те предполагат, че дългосрочните последици от излагането на пренатална хипоксия могат да засегнат активно биологичните системи в потомството от ранните етапи на живота въпреки липсата на явни прояви на заболяването. Второ, тези резултати предполагат, че постнаталните интервенции, насочени към намаляване на експозицията на някои постнатални стресори, могат да бъдат ефективни за намаляване на бъдещия риск от нежелани сърдечно-съдови и метаболитни нарушения, въпреки че нямат ефект върху самото рано програмирано състояние. Следователно, идентифицирането и потенциалът за ранна намеса при субекти с някаква степен на „ранно програмиране“ ще има огромния потенциал за намаляване на тежестта на хроничните заболявания върху здравната система.
Друго интересно откритие от нашето проучване е, че не се наблюдават разлики в изходното кръвно налягане в никоя от експерименталните групи. Въпреки че анализирахме само шест животни на група, нашите методи бяха достатъчно чувствителни, за да наблюдават физиологично значимо повишаване на систоличното кръвно налягане непосредствено след остър стрес при потомството, което получава HF диета (както контролна, така и IUGR). Тези открития са съвместими с предишни доклади, свързващи метаболитния синдром и хипертонията (36) със сърдечно-съдовата автономна дерегулация (31).
В нашето изследване на съдовата функция, ние наблюдавахме значително намаляване на приноса на азотен оксид за базалния съдов тонус в групата на IUGR, хранена с високочестотна диета, както се наблюдава от липсата на увеличаване на стеснението на PE в присъствието на l -NAME в това група. Интересното е, че тази разлика не е очевидна след комбинирано инхибиране на азотен оксид и простаноиди. Това обаче може да е резултат от намален съдосвиващ капацитет с времето, тъй като чувствителността към MCh намалява с времето само в тази група. Следователно, комбинацията от ограничаване на растежа и високочестотна диета изглежда са вредни за съдовата функция, докато отделните обиди не са. Освен това се наблюдава значително увеличаване на съдовото съответствие с високочестотна диета, което не се наблюдава при IUGR. Следователно промените в съдовото ремоделиране изглежда зависят само от диетата и не зависят от ограничаването на растежа.
В заключение, резултатите, представени в това проучване, са в съответствие с предишните ни констатации, показващи, че пренаталните обиди, причиняващи IUGR, могат да доведат до дългосрочни промени в сърдечно-съдовата функция и да допринесат за по-голямата податливост към вторични обиди при възрастното потомство. По-конкретно, ние демонстрирахме, че постнаталното приложение на богата на мазнини диета е особено вредно за сърдечно-съдовата функция на потомството, изложено на пренатална хипоксична обида и води до по-ранното развитие на сърдечни патологии. Нещо повече, ние показахме, че добавянето на високочестотни диети с Resv подобрява сърдечната податливост към исхемия поради консумацията на високочестотни диети от потомство, изложено на хипоксия по време на развитието на плода. И накрая, демонстрирахме, че пренаталните хипоксични обиди, водещи до IUGR, могат да причинят дълготрайни промени в механизмите, които регулират сърдечната честота при възрастни потомци.
Перспективи и значение
Това проучване илюстрира как някои постнатални хранителни обиди могат да действат като „втори удар“ с вредни сърдечно-съдови ефекти върху податливи популации (като родените IUGR) и предоставя доказателства, които предполагат, че тази придобита чувствителност може да бъде подобрена с помощта на постнатални фармакологични интервенции. Взети заедно, нашите открития подчертават значението на пренаталния етап в развитието на сърдечно-съдови патологии и дават представа защо популациите, живеещи в западния свят и родени IUGR, може да изискват по-внимателно клинично наблюдение. Тъй като 15% от западното население се ражда с ограничен растеж и близо 50% са с наднормено тегло или затлъстяване, нашите открития имат важни клинични последици за голяма част от нашето общество.
Тази работа беше подкрепена с грант за научни изследвания от Института за изследване на здравето на жените и децата (WCHRI), Канадските институти за здравни изследвания (CIHR) и награда за персонал от фондацията за сърдечни и инсулти в Канада (H&S) C. F. Rueda-Clausen, J. S. Morton и V. W. Dolinsky са подкрепени от H&S и Фондация за медицински изследвания Alberta Heritage (AHFMR). S. T. Davidge е учен от AHFMR, подкрепен от Alberta Innovates-Health Solutions (AI-HS) и канадски изследователски стол в областта на сърдечно-съдовото здраве на жените. J. R. B. Dyck е старши стипендиант на AHFMR, подкрепен от AI-HS.
Не се декларират конфликти на интереси, финансови или други, от автора (авторите).
Принос на автора: C.F.R.-C., J.S.M., V.W.D., J.R.D. и S.T.D. концепция и дизайн на научните изследвания; C.F.R.-C., J.S.M. и V.W.D. проведени експерименти; C.F.R.-C. и J.S.M. анализирани данни; C.F.R.-C., J.S.M., V.W.D., J.R.D. и S.T.D. интерпретирани резултати от експерименти; C.F.R.-C. подготвени фигури; C.F.R.-C. изготвен ръкопис; C.F.R.-C., J.S.M., V.W.D., J.R.D. и S.T.D. редактиран и преработен ръкопис; C.F.R.-C., J.S.M., V.W.D., J.R.D. и S.T.D. одобрена окончателна версия на ръкописа.
ПРИЗНАВАНИЯ
Настоящ адрес на В. У. Долински: Институт за детско здраве в Манитоба и Университетът в Манитоба, Уинипег, Канада.
- Развитието на диета, предизвикано от затлъстяване и непоносимост към глюкоза при мишки C57Bl6 при диета с високо съдържание на мазнини
- Какви са ефектите от диета с ниско съдържание на протеини за възрастни без диабет с хронично бъбречно заболяване
- Швеция препоръчва диета с ниско съдържание на въглехидрати и високо съдържание на мазнини за борба със затлъстяването Естествени продукти INSIDER
- Ефектите на средиземноморската диета върху нуждата от лекарства за диабет и ремисия на ново диагностицирани
- Ефектите от нисковъглехидратната кетогенна диета и диетата с ниско съдържание на мазнини върху настроението, глада и други