Отдел по хематология и онкология, Катедра по вътрешни болести и патология, Университетът в Мичиган, Ан Арбър, Мичиган 48109-0640
Резюме
Разбирането на физиологичната роля на плазмената каликреин-кининова система (KKS) е затруднено, тъй като не се знае как протеините на тази протеолитична система, когато са събрани във вътресъдовото отделение, се активират при физиологични условия. Последните проучвания показват, че ензимът пролилкарбоксипептидаза, инактивиращ ензим ANG II, е активатор на прекаликреин. Способността на пролилкарбоксипептидазата да действа в KKS и ренин-ангиотензиновата система (RAS) показва ново взаимодействие между тези две системи. Това взаимодействие, заедно с ролите на ангиотензин конвертиращия ензим, кръстосани разговори между брадикинин и ангиотензин- (1–7) действие, и противоположните ефекти от активирането на ANG II рецепторите 1 и 2 подкрепят хипотезата, че плазменият KKS уравновесява RAS . Този преглед изследва взаимодействието и кръстосаните разговори между тези две протеинови системи. Този анализ предполага, че има многопластово взаимодействие между тези две системи, които са важни за широк спектър от физиологични функции.
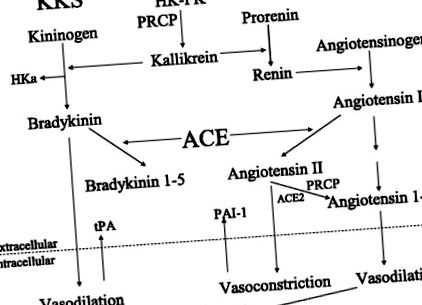
Фиг. 1.Взаимодействие на плазмената каликреин/кининова система (KKS) с ренин-ангиотензиновата система (RAS). HK, кининоген с високо молекулно тегло; ПК, прекаликреин; PRCP, пролилкарбоксипептидаза; HKa, разцепен каликреин в плазмата, кининоген с високо молекулно тегло без брадикинин; ACE, ANG I конвертиращ ензим; ACE2, ангиотензин конвертиращ ензим 2; tPA, активатор на тъканния плазминоген; PAI-1, инхибитор на активатора на плазминоген 1; PGI2, простагландин I2 или простацилин.
маса 1 Ангиогенна активност на протеини и пептиди на каликреин-кининовата и ренин-ангиотензиновата системи
HK, кининоген с високо молекулно тегло; LK, кининоген с ниско молекулно тегло; HKa, разцепен HK; АСЕ, ангиотензин конвертиращ ензим.
Целта на този преглед е да разгледа по-подробно всяко от тези взаимодействия и да установи тяхната относителна важност, определена от проучванията in vitro и in vivo. По-специално ще бъде обсъдена ролята на ACE при активирането на ANG I и инактивирането на BK. Приносът на плазмения каликреин за активирането на проренин ще бъде преразгледан в светлината на физиологичния механизъм за РК активиране. Сумиращите биологични ефекти на BK и ангиотензин- (1–7) ще бъдат изследвани. Ще бъде представена ролята на PRCP в разграждането на ANG II и активирането на ПК в плазмата. Модифициращото влияние на ангиотензиновите рецептори 1 и 2 върху тези системи също ще бъде прегледано. Накрая ще бъде въведен противовесният ефект на всяка от тези системи върху тромбоза, фибринолиза и ангиогенеза.
Фиг. 2.Пътища на разграждане на ANG I и брадикинини (BKs) от ангиотензин конвертиращите ензими. desArg 9 BK, des-Arg 9 -BK; ATII, ANG II; BK 1–7, BK- (1–7); BK 1–5, BK- (1–5); BKB2R, BK B2 рецептор; BKB1R, BK B1 рецептор; AT1R, ANG II рецептор 1; AT2R, ANG II рецептор 2; Ang (1–7) R?, Хипотеза на ангиотензин- (1–7) рецептор. Важно е да се оцени, че ANG II може да стимулира рецепторите за ангиотензин 1 и 2. По същия начин ангиотензин- (1–7) може да стимулира двата ангиотензинови рецептора и може да има свой собствен рецептор, Ang (1–7) R, който все още не е физически идентифициран.
В допълнение към влиянието върху деградацията на BK, ACEI влияе върху активността на BK. ACEI увеличава свързаните с BK ефекти чрез взаимодействие със самия BKB2R, което увеличава присъщата активност на незаети BKB2R молекули (58, 59). Като алтернатива се предлага ACEI да пречи на секвестирането на BKB2R в клетъчните мембрани (7). По-нови доказателства сочат, че повишаването на концентрацията на ACE от ACEI увеличава активирането на BKB2R от BK (85). В допълнение към ефект върху BKB2R, ACEI директно активират човешки BKB1Rs в отсъствието на ACE и агониста на BKB1R, des-Arg 10, Lys 1 -BK (66). Еналаприлат или рамиприлат, но не и лизиноприл, свързва и активира мотива за свързване на цинка, H 195 EXXH 199, върху BKB1R, за да стимулира мобилизирането на калций (66). И накрая, хроничното приложение на ACEI е свързано с функционална съдова и бъбречна BKB1R, но не и BKB2R, индукция (83). Тези последни данни предполагат, че ACEI влияе и върху възпалителните системи, които регулират експресията на BKB1R. Понастоящем пълните последици от това регулиране на BKB1R не са напълно известни.
Тъканните каликреини също са предложени като проренин конвертиращи ензими, въпреки че има малко информация за това как тъканният прокаликреин се активира до тъканния каликреин. Свинският панкреатичен каликреин активира проренин при алкално рН 8,2 (64). Подчелюстната жлезиста тъкан на мишката каликреин активира миши проренин (74). Доказано е също, че каликреините на мишката mK1, mK9, mK13 и mK22 са активатори на проренин (73). Човешкият hK1 активира човешкия проренин (34). Въпреки че е доказано, че плазмата и тъканният каликреин, заедно с катепсин В и РС5, са активатори на проренин, все още не е установено кой от тези ензими или който и да е друг е основната отговорна прохормона конвертаза (6, 94). И накрая, нокаутиращите мишки на каликреин (KLK1 -/-) имат намалена иРНК на бъбречния ренин в сравнение с мишки от див тип, но мишките BKB2R -/- са увеличили иРНК на ренин (133). Понастоящем значението на тези данни е неизвестно. Тъканният каликреин може да насърчи генната експресия на ренин; плазменият каликреин може да бъде активатор на проренин.
Фиг. 3.Подробни пътища за разграждане на ANG I. ЕР24.11, ендопептидаза 24.11, неприлизин; ЕР24.15, ендопептидаза 24.15; тимет олигопептидаза.
Има обаче някои данни при животни и хора, които предполагат, че KKS не уравновесява RAS. Widdop и сътр. (141) установяват, че ангиотензин- (1–7) не успява да засили хипотензивните ефекти на BK при спонтанно хипертонични (SHR) и Wister-Kyoto плъхове. Освен това, инфузията на ангиотензин (1-7) в продължение на 7 дни има променлив ефект на кръвното налягане при SHR (141). Инфузията на ангиотензин (1–7) в предмишницата на пациенти със сърдечна недостатъчност, лекувани с АСЕ инхибитор, не понижава кръвното налягане, нито усилва вазодилатиращите ефекти на BK (28). Последното проучване не трябва да се счита за окончателно, тъй като моделът е в ограничена популация от пациенти, които са били силно лекувани с лекарства. Тези проучвания върху животни и хора обаче поставят под въпрос значението на ангиотензин- (1–7) като клинично значим вазодилататор. Необходими са повече животински и човешки модели, за да се изясни физиологичната роля на ангиотензин- (1–7).
Последните изследвания с нокаутираща мишка C1 инхибитор (C1 INH) предполагат, че плазменият каликреин присъства конститутивно във вътресъдовото отделение, за да генерира BK (54). Мишката C1 INH KO има постоянен оток на лапата, който се блокира от инфузия на C1 INH, инфузия HOE140 или чифтосване на мишката C1 INH KO с мишка BKB2R -/- (54). Тъй като C1 INH е един от основните плазмени протеазни инхибитори на плазмения каликреин, а не тъканния каликреин, образуваният плазмен каликреин трябва да присъства конститутивно, за да протеолизира кининогените и да освобождава BK, за да медиира образуването на ангиоедем. Този модел на животни е в съответствие с проучвания в тъканна култура, показващи, че сглобяването на HK и PK върху ендотелните клетки води до незабавно активиране на PK чрез PRCP (88, 90, 118, 119). Тези данни също така предполагат, че в интраваскуларното отделение конститутивното активиране на плазмената ПК допринася за образуването на BK. Въпреки че няма известна PK нокаут мишка, която да се знае със сигурност, настоящите данни предполагат, че плазменото активиране на каликреин е вътресъдова кининогеназа за конститутивната експресия на BK.
Въпреки че ANG II може да стимулира AT2 рецептора да освобождава NO и индиректно BK, има допълнителни доказателства, че има и взаимодействие между AT1 рецептора и BKB2R на по-фундаментално ниво. AT1 и BKB2Rs образуват стабилни хетеродимери, причиняващи повишено активиране на Gαq- и GαI-протеини (3, 4). Хетеродимеризацията също води до промяна в ендоцитните пътища на двата рецептора. Хетеродимеризацията между AT1 и BKB2R се случва в тромбоцитите и съдовите съдове при жени в прееклампсия (3). Това взаимодействие води до четири до петкратно повишаване на нивата на протеин на BKB2R (3). И накрая, AT2 рецепторът свързва AT1 рецепторите, за да образува допълнителни хетеродимери, за да антагонизира функцията на AT1 рецептор (2). Тези изследвания показват регулаторни взаимодействия между двете системи на нивото на техните рецепторни протеини.
Въпреки че RAS и KKS са признати за важни модулатори на съдовата биология, регулиране на кръвното налягане и съдово възпаление (10), те също са изследвани за тяхното влияние върху тромбозата, фибринолизата и ангиогенезата. Терапевтичните манипулации на RAS и KKS изглежда водят до промяна на риска за артериална тромбоза. Лечението с ACE инхибитори или AT1 рецепторни антагонисти води до ∼15–20% намаляване на риска от миокарден инфаркт и инсулт (27, 130). Освен това, лечението с ACE инхибитор преди тромболитична терапия намалява ранното повишаване на плазмените нива на плазминогенен активатор 1 (PAI-1) при остър миокарден инфаркт (140). Експерименталната основа за тези клинични резултати ще бъде прегледана.
RAS е предложен като протромботична система (18). Беше признато, че ANG II увеличава mRNA, инхибитор на плазминогенов активатор-1 (PAI-1), антиген и нива на активност от култивирани астроцити и ендотелни клетки в културата (97, 101, 138). ANG II също така увеличава тРНК и активността на тъканния фактор, без да засяга tPA или инхибитора на протеаза на тъканния фактор в ендотелните клетки на аортна плъх (97). Предсърдният натриуретичен пептид потиска индуцираната от ANG II експресия на тъканния фактор и PAI-1 иРНК в култивирани ендотелни клетки на аортна плъх (149). Вазодилатиращият пептид адреномедулин блокира ANG II повишаване на регулацията на тъканния фактор и PAI-1 иРНК в култивирани ендотелни клетки на плъхове (128). В култивираните съдови клетки на гладката мускулатура активирането на MEK/ERK и Rho-киназните пътища допринасят за повишено от ангиотензин повишаване на PAI-1 иРНК (129). В култивираните човешки моноцити ANG II увеличава тъканния фактор mRNA и антигена, но не и PAI-1 (92). АСЕ инхибитор (каптоприл) и ANG II рецептор 1 антагонист (кандесартан) намаляват нивата на тъканния фактор в тези клетки. Нивата на PAI-1 протеин също се намаляват от каптоприл, но този ефект се блокира от BKB2R антагонист (92).
Като алтернатива на RAS, KKS е признат да влияе на фибринолизата от първоначалното й характеризиране. Дефицитът на фактор XII преди повече от 40 години се характеризира с дефектна фибринолиза (96). Към днешна дата не е имало добри животински модели, които да убедително да покажат, че плазменият KKS участва в тромбоза. Плазменият каликреин, фактор XIIa и фактор XIa имат способността да активират плазминоген до плазмин, макар и много по-малко ефективно от плазминогенен активатор от тъканния тип и двуверижен урокиназен плазминогенен активатор (22, 53, 82). Доказано е обаче, че плазменият каликреин е кинетично благоприятен активатор на едноверижната урокиназа (65). Активирането на плазмен РК, когато се свързва с HK върху ендотелните клетки, води до кинетично благоприятно едноверижно образуване на урокиназа с последващо образуване на плазмин, което предполага, че този път е предпочитаният път за образуване на плазмин in vivo (90).
В допълнение към стимулирането на фибринолизата чрез участие в едноверижна активация на урокиназа, индуцираното от каликреин освобождаване на BK влияе върху фибринолизата чрез стимулиране на освобождаването на tPA от венозния ендотел (15, 17, 126). Механизмът, чрез който BK освобождава tPA от човешката васкулатура, се медиира чрез BKB2R и е независим от освобождаването на NO и простациклин, също индуцирано от BK (14). BK стимулацията на циклооксигеназа 2 (COX2) с вазодилататорното освобождаване на простациклин също допринася за антикоагулантното състояние (49, 62, 105). Стимулирането на COX2 при мишки също води до повишен бъбречен медуларен кръвен поток, увеличен поток на урината и намалени натискащи ефекти на ANG II, допринасящи за антитромботичното състояние (105).
Влиянието на KKS и RAS върху ангиогенезата наскоро беше оценено (Таблица 1). От известно време е известно, че BK може да има някои проангиогенни ефекти. BK стимулира неоваскуларен отговор в имплантирани гъби при плъхове и образуването на нови съдове се блокира от [Leu 8] des-Arg 9 -BK (63). Съвсем наскоро непокътнатите HK и LK също се оказаха проангиогенни (24). Моноклонално антитяло, насочено към домейна на HK 5, блокира HK-индуцирана ангиогенеза, вероятно чрез намеса в разцепването на каликреин на HK, за да освободи BK (24, 117). Алтернативно, разцепен от плазма каликреин HK (HKa) (кининостатин), рекомбинантен домейн 5 на HK и изолирани пептиди от домейн 5 регион инхибират ангиогенезата и клетъчната пролиферация и растеж (23, 151).
Повишеното регулиране на KKS или намесата в RAS влияе на ангиогенезата. Взаимодействието между BK и ANG II изглежда е от съществено значение за нормалното сърдечно развитие. BKB2R -/- мишките, лекувани от раждането с AT1 рецепторен антагонист, имат намалена маса на лявата камера, обем на камерата, дебелина на стената и фиброза на миокарда, отколкото животни, които не са лекувани (37, 78). Тези данни предполагат, че ANG II е пряко ангажиран в сърдечното развитие.
В допълнение към ANG II и BKB2R, други компоненти на KKS и RAS допринасят за ангиогенезата. BKB1R също участва в ангиогенни репаративни процеси. В клетките в културата стимулирането на BKB1R инициира пролиферация и оцеляване на ендотелните клетки; антагонизмът на този рецептор води до апоптоза (44). В миши модел на исхемия на крайниците, намесата в сигнализирането на BKB1R инхибира естествения ангиогенен отговор на исхемия. Нокаутираните животни BKB1R са податливи на некроза на крайниците след исхемия на крайниците (44). Алтернативно, локалното доставяне на агонист на BKB1R подобрява съпътстващия растеж на съдовете и ускореното възстановяване на перфузията (44). И накрая, ангиотензиногенът и неговите разцепени производни пречат на ангиогенезата (20). Тъй като ангиотензиногенът е серпин, а антитромбинът има силна антиангиогенна активност, разследванията показват, че ангиотензиногенът и неговите производни [реактивна верига, разцепена форма и des (ANG I) ангиотензиноген] имат антиангиогенна активност (20). В обобщение, тези данни предполагат, че продуктите на разграждането на протеиновите компоненти на KKS и RAS са антиангиогенни, докато непокътнатите протеини и определени физиологични биологично активни пептиди са проангиогенни (Таблица 1).
Този преглед показва, че плазмените KKS и RAS се преплитат изцяло в сърдечно-съдовата система. Активирането на една система вероятно води до контраактивиране на някои аспекти на другата протеолитична система за поддържане на физиологична хомеостаза. В прегледаната информация взаимодействието на двата пътя на цялото протеиново ниво и последователните продукти на ензимното разпадане на техните биологично активни пептиди е многопластово и дълбоко. Понастоящем няколко критични точки на пресичане в тези системи са признати за лекарствени цели. Повече лекарствени цели за лечение на сърдечно-съдови заболявания, свързани с тези две системи, могат да бъдат разработени чрез по-добро разбиране на взаимодействията на тези системи.
Благодаря на д-р. А. Хасан, З. Шариат-Мадар, Г. да Мота и г-жа Ф. Махди за принос към еволюцията на тези идеи.
- Противоречията с царевичното масло са полиненаситени мазнини лоши за нас Американски съвет за наука и здраве
- Какви са скобите на американската диета за здравословно хранене SF Gate
- Ефектът от заобикалящата ни среда върху телесното тегло - Scientific American
- Програма за отслабване на Winthrop в класация №1 за третата година Mineola American
- UNI KEY Рецепта за здравни системи Сърдечна мелеща супа за отслабване на корема