Резюме
Заден план
Доказателствата предполагат, че съществува потенциална връзка между триметиламин-N-оксид (TMAO), метаболит, получен от холин, произведен от чревна микробиота, и някои видове рак, но малко се знае за първичен рак на черния дроб (PLC).
Методи
Създадено е проучване за контрол на случая, включващо 671 новодиагностицирани пациенти с PLC и 671 контролни субекта, съпоставени по честота по възраст (± 5 години) и пол, в провинция Гуангдонг, Китай. За измерване на серумен TMAO и холин се използва високоефективна течна хроматография с онлайн електроспрей йонизационна тандемна масспектрометрия (HPLC-MS/MS). Асоциациите между тези биомаркери и PLC риска бяха оценени с помощта на логистични регресионни модели.
Резултати
Концентрациите на TMAO в серума са по-високи в PLC групата, отколкото в контролната група (P = 0,002). Логистичният регресионен анализ показа, че съотношението на шансовете (OR) и (95% доверителен интервал [CI]), коригирано спрямо пола и възрастта, е 3,43 (2,42–4,86) при сравняване на горния и долния квартил (Q4 спрямо Q1). След по-нататъшна корекция за по-избрани смутители, ИЛИ (95% CI) остава значителна, но е отслабена до 2,85 (1,59–5,11) (Q4 срещу Q1). Коригираните с променлива OR (95% CI) в квартилите на холин са 0,35–0,15 (P-тенденция
Заден план
Първичният рак на черния дроб (PLC) е един от най-смъртоносните злокачествени тумори в света [1]. Приблизително 0,8 милиона нови диагнози за рак на черния дроб и смъртни случаи са възникнали по целия свят през 2012 г., като приблизително 50% от общия брой се наблюдава само в Китай [2]. Хроничният вирусен хепатит B (HBV) и C (HCV) и излагането на афлатоксин са преобладаващите рискови фактори за PLC [3]. След прилагането на рутинната имунизация срещу HBV за новородени [4], както и подобрения в хигиената и хигиената [5], честотата на рак на черния дроб, свързан с инфекцията, намалява в исторически високорисковите райони [5]. Въпреки това, свързаните с инфекция рискови фактори за PLC, като злоупотреба с алкохол, тютюнопушене, безалкохолна мастна чернодробна болест (NAFLD), затлъстяване и диабет тип 2, пораждат безпокойство през последните години [5]. Освен това нарастващите данни показват, че диетата играе решаваща роля [6,7,8] в развитието на PLC.
Холинът е основно хранително вещество в метаболизма с един въглерод [8], като се предполага, че ефектът му върху нивото на метилиране на ДНК играе важна роля в развитието на тумора [8,9,10]. Предишни проучвания показват, че дефицитът на диетичен холин може да насърчи развитието на рак на черния дроб както при животни, така и при хора [11, 12]. Освен това е установено, че циркулиращият холин също е свързан с риск от рак на черния дроб в едно вложено проучване на случай-контрол, включващо 297 пациенти с рак на черния дроб от мъжки пол и 631 съвпадащи контроли от мъжки пол [13].
Колективно проведохме проучване на случай-контрол, за да изследваме връзката между серумен TMAO, метаболит, зависим от чревната микробиота на холин, и риск от PLC при голяма китайска популация.
Методи
Проучвайте популация
Проведено е изследване на случай на контрол в напречно сечение. Методите за набиране на пациенти с PLC вече са подробно описани. [6] Ново диагностицирани (в рамките на един месец) възрастни с PLC от Университетския център за ракови заболявания Sun Yat-sen в провинция Гуангдонг бяха последователно записани между септември 2013 г. и април 2017 г. Всички случаи бяха диагностицирани според Националната всеобхватна ракова мрежа (NCCN) Clinical Практически насоки в онкологията: хепатобилиарни ракови заболявания [27]. Пациентите с PLC бяха изключени, ако (1) не са имали кръвни проби, (2) са имали анамнеза за други видове рак или (3) са имали анамнеза за инсулт или хронично бъбречно заболяване. Контроли, отговарящи на едни и същи критерии за включване и изключване, с изключение на рак на черния дроб, бяха включени едновременно от местните общности в провинция Гуангдонг. Общо 671 допустими пациенти с PLC и 671 контроли, съпоставени по честота по възраст (± 5 години) и пол, бяха включени в настоящите анализи. Писмено информирано съгласие беше предоставено от всички участници в проучването, а протоколът за изследването беше одобрен от Комитета по етика на Училището за обществено здраве към университета Сун Ятсен.
Събиране на данни
Информация за социално-демографските характеристики и навиците на начина на живот през последната година беше получена от добре обучени изследователи с помощта на структуриран въпросник. Доходите на домакинствата бяха разделени на три групи: ≤2000, 2001–6000 и> 6000 юана/месец/човек. Професията се определя от интензивността на труда. Семейното положение на участниците беше определено като или женен, или неомъжен. Образованието беше групирано в три нива: начално училище или по-ниско, средно и средно училище и колеж или по-горе. Участниците, които пушат поне една цигара на ден или пият алкохол поне веднъж седмично непрекъснато в продължение на поне шест месеца през целия си живот, са определени като пушачи или алкохолици.
Антропометричните данни, включително обиколката на талията (WC), височината (m) и теглото (kg) бяха получени при използване на стандартни процедури и измервателно оборудване. Изчислява се индекс на телесна маса (BMI; kg/m 2). Кръвното налягане (BP) се измерва с помощта на калибриран сфигмоманометър (Hawksley, WA Baum Co, USA). Серостатът на повърхностния антиген на хепатит В се определя чрез ензимно свързан имуносорбентен анализ. Общият серумен холестерол (TC) и триглицеридите (TG) се анализират с помощта на ензимни колориметрични тестове; методът на елективна инхибиция е използван за измерване на серумен липопротеинов холестерол с висока плътност (HDL-C). Глюкозата в кръвта на гладно (FBG) се определя по метода на хексокиназата. Всички биохимични параметри бяха определени с помощта на налични в търговската мрежа комплекти на автоматичен биохимичен анализатор (Advia1650 Autoanalyzer, Byer Diagnostics, Leverkusen, Германия). Метаболитният синдром (Mets) е диагностициран въз основа на WC, BP, TG, HDL-C и FBG, съгласно критериите на Международната диабетна федерация [28].
Лабораторен анализ на серумен TMAO и холин
Пробите от серум на гладно се изолират и се съхраняват при - 80 ° C до анализ. Серумният TMAO и холинът се оценяват с помощта на високоефективна течна хроматография с онлайн електроспрей йонизационна тандемна масспектрометрия (HPLC-MS/MS) (Agilent 6400 Series Triple Quad LCMS; CA, USA) [29], като се използва многореакционен мониторинг (MRM) функции. 100 μl ацетонитрил, съдържащ 10 μM вътрешни стандарти [d9-TMAO (Toronto Research Chemicals Inc., Торонто, Канада), d9-холин (Sigma-Aldrich, Сейнт Луис, САЩ)] се добавя към 60 μl от серума проба или стандарти. След това пробите се центрофугират при 13 000 х g за 10 минути, за да се утаят протеините. И накрая, останалата супернатанта се инжектира в колона със силициев диоксид с нормална фаза (2,1 mm × 100 mm, 5 μM) и се уравновесява с 30% разтвор А (15 mmol/L амониев формиат във вода, рН 3,0) и 70% разтвор В ( ацетонитрил) при изократично елуиране със скорост на потока 0,2 ml/min. Десет двойки дублирани контролни проби бяха случайно разпръснати, за да се оцени лабораторната точност. Коефициентите на вариация за междинните анализи са съответно 6,0 и 4,9% за ТМАО и холин.
Статистически анализ
Данните бяха анализирани с помощта на SPSS версия 20.0 за Windows (SPSS Inc., Чикаго, IL, САЩ). P-стойностите се основаваха на двустранни тестове и P
Резултати
Основни характеристики
Основни характеристики на 671 пациенти с PLC и контролни двойки (569 двойки мъже и 102 двойки жени) са представени в Таблица 1. Средната (± SD) възраст на пациентите с PLC и контролите, които не са PLC, са били 58,6 ± 7,6 години и 58,6 ± 7,5 години, съответно. В сравнение с контролите, пациентите с PLC са по-склонни да имат по-нисък ИТМ, по-ниско ниво на образование, по-ниска честота на Mets и по-високи доходи на домакинствата. Значително по-голяма част от пациентите с PLC са имали интензивна професия, били са женени, пият алкохол и са заразени с HBV (P Таблица 1 Сравнение на избрани характеристики между случаите на PLC и контролите
В сравнение с контролите, пациентите с PLC имат значително по-високи серумни нива на ТМАО (2,07 (1,32, 3,49) μmol/L срещу 1,61 (0,87, 2,92) μmol/L)) и по-ниски нива на холин (12,88 ± 4,53 μmol/L срещу 17,33 ± 5,15 μmol/L). всичко P-Стойностите са таблица 2 Съотношения на коефициенти (ORs) и 95% доверителни интервали (CI) на PLC според квартилите на серумните нива на TMAO и холин сред контролите
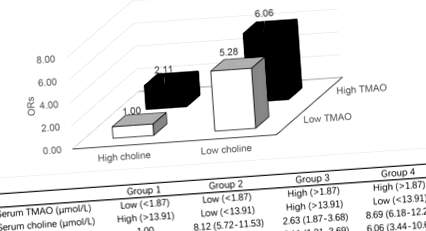
В четирите комбинирани групови анализа средните концентрации на цялата изследвана популация са съответно 1,87 μmol/L и 13,91 μmol/L за TMAO и холин. В сравнение с група 1 (нисък TMAO и висок холин), участниците с неблагоприятни фактори (висок TMAO, нисък холин или и двете) имат повишен риск от PLC, тези с висок TMAO и нисък холин имат най-висок риск от PLC, мултивариантно коригираното ИЛИ (95% CI) за група 4 срещу група 1 е 6,06 (3,44–10,68). Данните са показани на фиг. 1.
OR и 95% CI на PLC в четири групи: нисък TMAO/висок холин, нисък TMAO/нисък холин, висок TMAO/висок холин и висок TMAO/нисък холин. Групите бяха стратифицирани въз основа на средната концентрация на TMAO и холин в цялата популация на изследването. a Съобразено с възрастта и пола; b Допълнително коригирани за ИТМ, доходи на домакинството, професия, семейно положение, статус на тютюнопушене, употреба на алкохол, наличие на метаболитен синдром и статус на HBV инфекция
Стратифицирани анализи
В анализите на риска, стратифицирани от състоянието на HBV инфекция, употребата на алкохол, тютюнопушенето, сексът и наличието на Mets, са установени положителни връзки между TMAO и PLC риск само при пациенти, които не са заразени с HBV (P-тенденция = 0,006), непиещи (P-тенденция = 0,001), непушачи (P-тенденция = 0,001) и участници без Mets (P-тенденция = 0,006), но не и сред заразени с HBV пациенти (P-тенденция = 0.104), алкохолици (P-тенденция = 0,092), пушачи (P-тенденция = 0,418) и участници с Mets (P-тенденция = 0,095). както и да е P-взаимодействието е било значително само между пушачи и непушачи (P-взаимодействие = 0,024).
Обратните връзки на холин и PLC риск не са значително променени, макар и по-силни сред непушачите, отколкото пушачите (P-тенденция Таблица 3 Асоциации между нивата на серумен TMAO и холин с риск от PLC, стратифициран от избрани фактори
Дискусия
Основни констатации
Доколкото ни е известно, настоящото проучване е първото, което докладва за връзките между серумен TMAO и PLC риск при хората. Установихме, че серумният TMAO, метаболит на чревната флора на холина, е положително свързан с развитието на PLC, докато неговият предшественик холин е обратно свързан с риска от PLC.
TMAO и PLC
През последните години много проучвания отчитат връзки между ТМАО и хронични заболявания. Както при животните, така и при хората, вредните ефекти на TMAO са свързани със сърдечно-съдови заболявания (атеросклероза [16, 17], тромбоза [30], хипертония [31]), хронично бъбречно заболяване [20] и NAFLD [26]. Приносът на TMAO в развитието на тези хронични заболявания насочи вниманието към потенциалната му роля в канцерогенезата, тъй като всички тези заболявания са рискови фактори за рак. Съществуващата литература за връзките между циркулиращия TMAO и рака обаче е ограничена и резултатите са неубедителни. Значителни положителни връзки между TMAO и колоректален рак са докладвани за първи път в Наблюдателното проучване на инициативата за здравето на жените [23]. Liu et al. предполага възможна прогностична стойност на предоперативното серумно ниво на TMAO при 108 пациенти с колоректален рак [24]. Освен това Oellgaard et al. съобщава TMAO като обещаваща потенциална терапевтична цел за рак на стомашно-чревния тракт [32]. Интересното е, че се отчитат различни резултати при мъже, участвали в проучването с алфа-токоферол и бета-каротин, при което връзката между TMAO и рак на простатата е положителна [33], но нула между TMAO и колоректален рак [34].
Съществуващите данни за TMAO във връзка с риска от PLC са оскъдни. Доколкото ни е известно, настоящото проучване е първото, което докладва за връзките между серумен TMAO и PLC риск при хората. В съответствие с повечето от предишните констатации, настоящото проучване установи значителна връзка между серумния TMAO и риска от PLC. Предполагаме два възможни механизма. Първо, TMAO може да допринесе за увреждане на черния дроб, като намали общия размер на пула на жлъчните киселини и повлияе нивата на TG в черния дроб [16], което може да доведе до развитието на PLC. Второ, TMAO може да бъде косвен рисков фактор, като участва в етиологията на няколко хронични заболявания, включително атеросклероза [16, 17], тромбоза [30], хипертония [31] и хронично бъбречно заболяване [20], които са всички потенциални рискови фактори за PLC.
От настоящата литература обаче е трудно да се определи дали серумният TMAO е рисков фактор или по-скоро биомаркер за състоянието на PLC. Все повече доказателства предполагат, че бактериалният микробиом играе ключова роля за насърчаване на рака на черния дроб чрез чревната ос микробиота-черен дроб [35]. Като се има предвид, че TMAO е метаболит, зависим от чревната флора, повишените циркулиращи концентрации на TMAO могат просто да бъдат биомаркер на колебанията на чревния микробиота при пациенти с PLC. Ограничено от дизайна на случая-контрол, това проучване не може окончателно да заключи дали повишеният серумен TMAO участва в чернодробната канцерогенеза или дали ракът на черния дроб е причинил повишаването на серумния TMAO. Rong Xu et al. по-рано разкриха връзка между TMAO и колоректалния рак, използвайки анализ на геномни системи, и предложи потенциална генетична връзка с други видове рак [25]. Тези връзки могат да бъдат използвани в бъдещи изследвания на TMAO, за да се разбере по-добре ролята му в PLC.
В стратифицирания анализ забелязахме, че положителната връзка между серумен TMAO и PLC риск става незначителна сред пациентите, заразени с HBV, алкохолиците, пушачите и участниците с Mets, въпреки че P-взаимодействието е било значително само между пушачи и непушачи. Възможно обяснение би било, че HBV, консумацията на алкохол, тютюнопушенето и наличието на Mets предизвикват промени в състава на чревната флора и нормалната функция [36,37,38], което вследствие на това влияе върху генерирането на TMAO. В допълнение, HBV инфекцията, пиенето на алкохол, тютюнопушенето и присъствието на Mets са добре установени PLC рискови фактори [5], техните ефекти върху PLC са много по-големи от TMAO, което може да покрие рисковия ефект на TMAO върху PLC.
Холин и PLC
Настоящото проучване показва силно благоприятна връзка между серумния холин и PLC. Това беше в съответствие с няколко предишни проучвания [39,40,41,42,43] и с нашето предишно проучване на случая-контрол, което съобщава за обратна връзка между приема на диетичен холин и риска от PLC [11]. Към днешна дата само едно проучване на случая-контрол, включващо 297 пациенти с HCC от мъжки пол и 631 контролирани мъже, съобщава за връзката между серумния холин и риска от HCC [13], в което също е установена благоприятната роля на холина. Има поне два потенциални механизма за обяснение на обратните връзки между висок серумен холин и намален риск от PLC. Първо, холинът е важен донор на метил в метаболизма с един въглерод, който може да повлияе нивата на метилиране на ДНК. Недостигът на метил донори може да наруши метилирането на ДНК и допълнително да индуцира чернодробна канцерогенеза [8, 44]. Животински модели, хранени с диета с недостиг на холин, демонстрират повишен риск от рак на черния дроб [44, 45]. Второ, холинът е необходим за нормалния транспорт на липиди и TG от черния дроб, докато дефектната секреция на VLDL и натрупването на мазнини могат да причинят хронични чернодробни заболявания като NAFLD или рак на черния дроб [26].
В това проучване отбелязахме, че серумният TMAO и неговият предшественик холин имат противоположни връзки с PLC риск. Една от най-вероятните причини е, че холинът не е единственият предшественик на TMAO. Например, L-карнитин, хранително вещество, богато на червено месо, също може да се метаболизира до TMAO [16]. В нашето предишно проучване, изследващо връзката между приема на диетичен холин и риска от PLC, установихме, че червеното месо е важен източник на диетичен холин [11], което предполага висок прием на диетичен L-карнитин от участниците.
Силни страни и ограничения
Настоящото проучване имаше няколко силни страни. Първо, това е първото проучване, което докладва за връзките между серумен TMAO и PLC риск при хората. Нещо повече, размерът на пробата (671 пациенти с PLC и 671 съвпадащи контроли) е сравнително голям в сравнение с единственото съществуващо проучване за контрол на случая на серумен холин и HCC (297 пациенти с HCC и 631 съвпадащи контроли) [13]. На второ място, бяха включени само новодиагностицирани пациенти с PLC със съпоставими възрастови и полови съвпадения, за да се сведе до минимум пристрастието при отзоваване. Трето, многобройни объркващи фактори, включително добре установени рискови фактори за PLC (т.е. HBV инфекция, употреба на алкохол, тютюнопушене) бяха включени в анализите, за да се намали остатъчното объркване.
Заключения
В заключение, настоящото проучване разкри противоположни връзки между серумния триметиламин N-оксид (неблагоприятен) и неговия предшественик холин (обратен) с риска от PLC. Предполагаме, че по-високите концентрации на ТМАО са свързани с повишен риск от PLC, докато по-високите нива на серумен холин са свързани с намален риск от PLC. Тези резултати обаче трябва да се тълкуват с повишено внимание и да бъдат потвърдени от големи проспективни проучвания в бъдеще.
- Генът, свързан с мазнините и свързаните със затлъстяването (FTO) гени към уроците за затлъстяване от модели на мишки - Чанг - 2018
- Разкриването на нов рисков фактор, свързан с рака на пикочния мехур в Ливан
- Насочване към ангиогенеза на рак на простатата чрез свързан с метастази протеин 1 (MTA1) - Kai - 2011
- Насочването към ферроптозата облекчава индуцираната от метионин-холин диета (MCD), предизвикана от NASH чрез
- Оста APOA1bp – SREBF – NOTCH е свързана с намален риск от атеросклероза при болестно затлъстяване