Marteinn Thor Snaebjornsson &
Търсете този автор в:
Алмут Шулце
Търсете този автор в:
Ненормалният клетъчен метаболизъм е отличителен белег на раковите клетки, от промени в пътищата, които използват глюкоза, до анормално активиране на липидния метаболизъм. Липидите са изключително сложен клас молекули с много клетъчни функции 1, един от най-важните от които е да осигури градивните елементи за синтеза на клетъчни липидни мембрани. Повечето тъкани в тялото на възрастни разчитат на липиди, получени от диетата или тези, направени в черния дроб, но много ракови клетки вместо това активират липидните синтезни пътища, за да подпомогнат тяхното бързо разпространение 2. Тази разлика между нормалните и раковите клетки предполага възможна уязвимост на туморните клетки, която може да бъде използвана терапевтично. Всъщност предотвратяването на синтеза или модификацията на мастни киселини (градивните елементи за липидите) може да намали растежа на тумора при няколко животински модели на рак 2, въпреки че този подход все още не е бил успешен в клиниката. Писане в Природата, Vriens и др. 3 докладват резултати, които могат да посочат път напред.
Една от причините, поради които противораковите стратегии, насочени към метаболизма на липидите, са били неефективни в клиниката, може да бъде, че алтернативните пътища компенсират пътя, блокиран от дадено лекарство. Vriens и колеги са идентифицирали един такъв компенсаторен път в раковите клетки, който позволява на клетките да произвеждат мононенаситени мастни киселини, ако пътят, който обикновено използват, е блокиран. Известно е, че този алтернативен път действа в маслодайните мастни жлези в човешките космени фоликули и откритието на авторите разкрива, че раковите клетки също могат да използват този път, за да отговорят на своите метаболитни нужди.
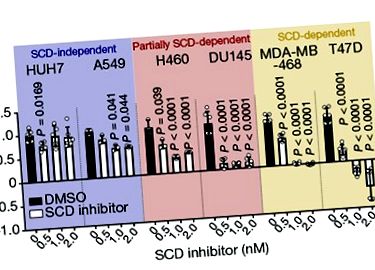
Ензимът стеароил-КоА десатураза (SCD) катализира образуването на специфична двойна връзка в палмитат, наситена мастна киселина (мастна киселина без двойна връзка) и този тип реакция на десатурация е необходима по пътя, който генерира мононенаситените мазнини киселини палмитолеат и олеат. Тези мастни киселини са ключови градивни елементи за фосфолипидите, които са компоненти на клетъчните мембрани. Авторите са изследвали ефекта на SCD инхибитор върху растящите човешки клетки инвитро. Те откриха, че някои от видовете тествани ракови клетки са силно чувствителни към инхибиране на SCD и или спират да се делят, или умират, докато други са нечувствителни и продължават да се делят. Това беше неочаквано, тъй като прогнозираният резултат от инхибирането на SCD би бил натрупването на наситени мастни киселини, които са токсични за клетките при високи концентрации 4 .
Vriens и др. установи, че раковите клетки, които са нечувствителни към инхибиране на SCD, съдържат високи нива на сапиенат, вид мононенаситена мастна киселина, която обикновено се произвежда в мастната жлеза. Сапиенатът се произвежда 5 от палмитат от ензим, наречен FADS2 (фиг. 1). FADS2 също се изисква 6 в тъканите на бозайници за обработката на омега-3 и омега-6 есенциални мастни киселини, които са тези, получени от диетата.
Авторите съобщават, че по отношение на експресията си в нормална тъкан експресията на FADS2 е повишена в проби от човешки чернодробни и белодробни тумори. Те отбелязват, че сапиенатът се открива в тумори от миши модели на рак на черния дроб и че при тези тумори експресията на FADS2 корелира с устойчивостта на раковите клетки към инхибиране на SCD. Интересното е, че по аналогичен начин на това как се образува олеат от удължаването на палмитолеат, мононенаситената мастна киселина цис-8-октадеканоатът се образува от удължаването на сапиената. Авторите установяват, че както сапиенат, така и цис-8-октадеканоатът е включен в мембранните липиди на раковите клетки.
След това Vriens и колеги изследват дали FADS2-зависимият път за синтез на мононенаситени мастни киселини може да компенсира липсата на тези съединения, която обикновено се появява, когато SCD се инхибира. Те наистина откриха, че или проектирането на човешки ракови клетки за експресия на FADS2, или добавянето на сапиенат към клетките дава възможност за оцеляване на отгледаните ракови клетки инвитро това обикновено би умряло, ако SCD беше инхибирано. Въпреки това, човешки ракови клетки растат инвитро които бяха нечувствителни към инхибиране на SCD, бяха убити чрез комбинация от инхибиране на SCD и изчерпване на FADS2. В миши модел на рак на черния дроб, който авторите тестват, инхибирането както на SCD, така и на FADS2 причинява умерено намаляване на туморния растеж в сравнение с туморния растеж при животни, при които нито един от ензимите не е инхибиран.
Експерименти с използване на отгледани човешки клетки инвитро посочи, че дейностите на SCD и FADS2 са взаимно зависими. Производството на сапиенат от FADS2 се увеличава, ако SCD се инхибира. Обратно, когато активността на FADS2 беше блокирана, синтезът на палмитолеат от SCD беше подобрен. Тази гъвкавост в пътищата за производство на липиди е изключително полезна за бързо разделящи се ракови клетки, които изискват постоянно снабдяване с мононенаситени мастни киселини. Авторите обаче забелязват, че изчерпването на FADS2 при липса на инхибиране на SCD увеличава пролиферацията на раковите клетки, което показва, че въпреки че FADS2 може да предложи начин за генериране на мононенаситени мастни киселини, това струва по отношение на пролиферативната способност на клетките.
Натрупването на палмитат може да измести активността на FADS2 към предпочитане на палмитат като негов субстрат и по този начин може да насърчи производството на сапиенат 7. Следователно това може да осигури безопасен механизъм за производство на мононенаситени мастни киселини, когато SCD е блокиран. Наистина, цис-8-октадеканоатът не се открива в проби от фосфолипиди от ракови клетки при липса на инхибиране на SCD, което предполага, че не се генерира повече от ниско ниво на сапиенат в клетки, в които SCD е активен.
Работата на Vriens и колегите повдига редица въпроси. Например кои механизми контролират нивото на експресия на FADS2 в раковите клетки? Като се има предвид, че FADS2-зависимото производство на сапиенат е от значение само при липса на SCD, изглежда малко вероятно производството на сапиенат да е причината за високата експресия на FADS2 при рак на човека. Вместо това е вероятно основната функция на FADS2 в такива клетки да изпълнява обичайната си роля в обработката на омега-3 и омега-6 мастни киселини, за да генерира молекули, сигнализиращи за липиди, участващи в функции като имунно укриване 8. Преминаването към производство на сапиенат, когато SCD е инхибирано, може да попречи на FADS2 да изпълнява обичайната си роля и да блокира производството на тези сигнални молекули.
Не е известно дали мононенаситените мастни киселини, произведени от FADS2, функционално заместват тези, произведени от SCD. Включване на сапиенат и цис-8-октадеканоатът в мембранните липиди може да доведе до разлики в мембранната течливост, кривина или асоциация на мембранни протеини, в сравнение със съответните характеристики на мембранните липиди, направени с палмитолеат и олеат.
Друг въпрос, възникващ от това проучване, е дали микросредата на тумора влияе върху зависимостта на раковите клетки от SCD и FADS2. Клетките могат също така да получат мононенаситени мастни киселини чрез поглъщане на вид фосфолипид, наречен лизофосфолипид 9. Следователно нивата на такива молекули в туморната микросреда могат да определят дали инхибирането както на SCD, така и на FADS2 ще бъде ефективен начин за убиване на раковите клетки. Vriens и др. установи, че човешките чернодробни ракови клетки, имплантирани в черния дроб на мишки, лекувани с SCD инхибитор, поемат сапиенат от туморната микросреда. Това предполага, че синтеза на сапиенат от FADS2 в тумора е недостатъчен, за да задоволи нуждата му от мононенаситени мастни киселини. Освен това, в съответствие с тази възможност, инхибирането на туморния растеж, наблюдавано след комбинирано изчерпване на SCD и FADS2 при мишки, е само умерено. Може би инхибирането на поглъщането на мастни киселини от микросредата на тумора може да помогне за блокиране на растежа на тумора, когато SCD и FADS2 са инхибирани.
Vriens и др. дават провокиращ размисъл пример за това как раковите клетки се развиват, за да отговорят на своите метаболитни нужди. Справянето със сложността на участващите механизми остава предизвикателство за ефективно насочване на липидния метаболизъм в терапията на рака.
Природата 566, 333-334 (2019)
- Защо запознанството с ченге от храна може да ви накара да наддадете на форма на тегло
- Защо диетите с детоксикация нямат смисъл
- Екотарианската революция Как да направим своя дом; Диета повече зелено NESSE
- Ефектът на безглутенова диета върху компонентите на метаболитния синдром Рандомизирано клинично изпитване
- Защо яденето на аспержи ме смърди