Резюме
в световен мащаб 1,1 милиарда възрастни и 10% от децата сега са класифицирани като наднормено тегло или затлъстяване (28). Излишното телесно тегло е шестият най-важен рисков фактор, допринасящ за общата тежест на заболяването. Наднорменото тегло и затлъстяването са предразполагащи фактори за много метаболитни заболявания, включително диабет тип 2, заболяване на жлъчния мехур, безалкохолен мастен черен дроб, стеатохепатит, хипертония, сърдечно-съдови заболявания и някои форми на рак, свързани с наднорменото тегло (8). Предполага се (36), че лошата диета и физическото бездействие скоро могат да заменят тютюнопушенето като основна причина за смърт, която може да се избегне. Въпреки това, проучвания при хора (10) показват, че самото пушене е свързано с развитието на коремно или централно затлъстяване.
В световен мащаб около една трета от възрастните мъже и всеки пети тийнейджър пушат, а свързаните с тютюнопушенето заболявания застрашават живота на всеки десети възрастни; прогнозира се това да се увеличи до един на всеки шест до 2030 г., ако настоящата тенденция продължи (55). Намаленият апетит и телесното тегло са някои от основните мотиви за пушене на цигари, особено сред младите жени (2, 9, 23). Увеличаването на теглото при спиране на тютюнопушенето е фактор, който пречи на хората да се откажат от пушенето, тъй като повече от 75% от бившите пушачи напълняват след отказване. Увеличаването на теглото след спиране се дължи главно на увеличаване на калорийния прием, особено на консумацията на леки храни с високо съдържание на мазнини и захар, намаляване на енергийните разходи и повишено натрупване на липиди (20, 25).
Рисковете за здравето, свързани с диабета и сърдечно-съдовите заболявания, могат да се увеличат чрез пушене, тъй като пушачите показват намален холестерол на липопротеините с висока плътност, по-високи концентрации на триглицериди и повишени провъзпалителни (напр. TNF-α, IL-6) и прокоагулантни маркери (4, 21, 22, 31). Въпреки това, при настоящите силно пушачи се съобщава за по-ниска смъртност (43) при лица с наднормено тегло, но без затлъстяване, в сравнение с тези, които никога не са пушили. Освен това затлъстяването напоследък е признато за рисков фактор за възпалителни респираторни заболявания (15, 35). TNF-α причинява инсулинова резистентност при затлъстели лица, като възпрепятства сигнализирането на инсулиновите рецептори, което може да се дължи частично на инхибирането на секрецията на адипонектин и намаления глюкозен транспортер GLUT4 (47, 50). Голяма част от циркулиращия IL-6 се получава от мастна тъкан и нивата корелират с нивото на глюкозата на гладно и инсулиновата резистентност (5). Мобилизирането на мастни киселини от запасите на триглицериди в мастната тъкан изисква липолитични ензими. Адипозната триглицеридна липаза (ATGL) е единственият ензим, за който е известно, че хидролизира триглицеридите, експресирани както в бяла, така и в кафява мастна тъкан (58).
Животни.
Поради щамовата зависимост на развитието на респираторно заболяване след излагане на цигарен дим (53), мъжки мишки Balb/C бяха избрани за този експеримент. Мишки (на възраст 5 седмици) са получени от Animal Resource Center (Пърт, Австралия), настанени при 20 ± 2 ° C в стерилни микроизолаторни клетки и поддържани в 12: 12-часов цикъл светлина-тъмнина (светлините са включени в 0600) . Било им позволено 1 седмица да се адаптират към новата си среда, с либитум достъп до стандартна лабораторна чау и вода. Животните се наблюдават ежедневно. Настоящото проучване е одобрено от Комитета по етика на експериментите с животни към Университета в Мелбърн.
Лечение.
След аклиматизацията мишките бяха разделени на случаен принцип в четири групи със сходно средно телесно тегло: изложена на фалшиво хранене чау (шам + чау), изложена на фалшиво хранене HFD (фалшиво + HFD), изложено на дим хранено чау (se + чау) и се захранва с HFD (se + HFD). За излагане на дим животните се поставят в камерата с перспекс (18 литра) и се излагат на дима, произведен от две цигари (Winfield Red, ≤16 mg катран, ≤1,2 mg никотин и ≤15 mg въглероден окис; Philip Morris, Мелбърн, Австралия) два пъти/ден (1030 и 1630), 6 дни/седмица за 7 седмици (53). С измамно изложените животни се е работило идентично, но не са били изложени на цигарен дим. Мишките консумират или лабораторна чау (3,54 kcal/g, 12% мазнини, 22% протеини, 66% въглехидрати; кохорта, хранена с чау) или HFD [4,32 kcal/g, 32% мазнини (17% наситени мазнини), 18% протеин, 50% въглехидрати; Кохорта, хранена с HFD], състояща се от модифицирана лабораторна чау, съдържаща подсладено кондензирано мляко и свинска мас, която е допълнена с изключително вкусна храна в стил кафене, като пайове с месо, сладкиши и бисквити (26, 27, 39). Пресната храна се осигуряваше в 1700 всеки ден. Телесното тегло и 24-часовият прием на калории се измерват два пъти на седмица.
Вземане на проби.
В края на експеримента тъканите бяха събрани от 0900 до 1100. Животните получиха последното си излагане на камерен или цигарен дим в 1630 ден преди дисекцията. На мишките беше дадено предозиране с анестезия (кетамин-ксилазин, 180: 32 mg/kg ip), кръв беше събрана от коремната куха вена и след това мишките бяха обезглавени за събиране на мозъка и тъканите. Преди дисекцията на телесното тегло бяха записани дължината на назоанала (N-A) и дължината на пищяла. Индексът на Ли беше изчислен като телесно тегло (g 0,33)/N-A дължина (mm). Около 10 μl кръв се използва за измерване на кръвната глюкоза (Accu-Chek Advantage глюкометър; Roche Diagnostics, Castle Hill, NSW, Австралия) и карбоксихемоглобин (CoHb) (54). Отделената плазма се съхранява при -80 ° C за последващо определяне на плазмен лептин, инсулин, кортикостерон и NPY.
BAT и RpWAT се замразяват бързо в течен азот и след това се съхраняват при -80 ° C за по-късно измерване на иРНК на UCP1, UCP3, TNF-α, IL-6 и ATGL. Част от черния дроб беше фиксирана в 10% формалин за оцветяване с хемотоксилин и еозин (HE).
HE оцветяване на чернодробни секции.
Секции от левия и средния дял на черния дроб от всяка мишка бяха поставени във формалин. Образците се обработват в продължение на една нощ през сортирани етаноли и се влагат в парафин. След това монтираните тъкани се депарафинизират и рехидратират. Ядрата се оцветяват с харис хемотоксилин, а клетъчната цитоплазма се оцветява с еозин. Мастната промяна в черния дроб се оценява от наблюдател, заслепен за лекуваните групи, като се определя количеството и размерът на белите вакуоли, присъстващи в оцветените участъци (0 = нормални, 1 = липидни вакуоли в хепатоцитите и 2 = увеличени вакуоли в хепатоцитите ). След това беше изчислена средната стойност на оценките във всяка третирана група.
PCR в реално време.
Общата РНК се изолира от WAT и BAT, като се използва комплект RNeasy (Qiagen, Валенсия, Калифорния), съгласно инструкциите на производителя. Пречистената обща РНК се използва като шаблон за генериране на първостепенна синтеза на кДНК, използвайки SuperScript III (Invitrogen, Carlsbad, CA). Приложените Biosystem сонда/праймери, които бяха предварително оптимизирани и валидирани, бяха използвани за количествена PCR в реално време (ABI 7900 HT Sequence Detection System; Applied Biosystems, Foster City, CA) (7). По този начин генната експресия беше количествено определена в единична мултиплексираща реакция, където нашият ген от интерес (UCP1, UCP3, TNF-α, IL-6 и ATGL) беше стандартизиран за контрол (18s rRNA). След това индивидуална проба от НДНТ от контролната фалшива група е произволно назначена като калибратор, спрямо която всички останали проби се изразяват като кратна разлика (7).
Анализи.
Ендогенният NPY от различните области на мозъка се извлича от оцетна киселина. NPY-подобната имунореактивност в мозъка и плазмата беше измерена чрез радиоимуноанализ, като се използва синтетичен NPY като стандарт (10–1 280 pg/епруветка; Auspep, Виктория, Австралия), както е описано по-горе (41). Границата на откриване за радиоимуноанализа беше рутинно 2 pg NPY/епруветка, а коефициентите на вариация в интра- и интра-теста бяха съответно 6 и 13%. NPY се изразява като нанограми NPY на милиграм тъкан във всеки мозъчен регион и нанограми NPY в хипоталамуса. Плазмените концентрации на лептин, инсулин и кортикостерон бяха измерени чрез използване на налични в търговската мрежа комплекти за радиоимуноанализ (лептин и инсулин; Linco, St. Charles, MO и кортикостерон; MP Biomedicals, Irvine, CA). Плазменият триглицерид се измерва, като се използва глицеролов стандарт (еквивалентен на 0–8,46 тМ триглицерид; Sigma, Сейнт Луис, МО) и триглицериден реагент (Roche, Nutley, NJ). Накратко, пробите и стандартите бяха инкубирани с триглицериден реагент при 37 ° C в продължение на 20 минути и отчетени на четец на микроплаки (Bio-Rad 680XR) при 492 nm.
статистически анализи.
Резултатите са изразени като средни стойности ± SE. Телесното тегло и калоричният прием с течение на времето се анализират с помощта на еднопосочен дисперсионен анализ (ANOVA) с повтарящи се мерки, последвани от post hoc тестове за най-малка разлика на Fisher. Разликите в теглото на мазнините и органите, химичните концентрации в кръвта и плазмата, концентрацията и съдържанието на NPY в мозъка и експресията на мастна иРНК бяха анализирани с помощта на двупосочен ANOVA, последван от post hoc тестове на Bonferroni. Разликата в CoHb в кръвта се анализира, като се използва несдвоеният Student т-тест. Разликата в оценката за оцветяване с HE в черния дроб беше анализирана с помощта на теста на Wilcoxon с ранг.
Прием на храна и траектория на телесното тегло.
По време на периода на включване няма разлика в приема на калории между експериментални групи. Малко след започване на диетичната интервенция, животните с HFD (фалшиви + HFD и se + HFD групи) са имали по-голям калориен прием от хранените с чау животни (фалшиви + чау и се + чау). Излагането на дим намалява калорийния прием както в кохорти, хранени с чау, така и с HFD (фиг. 1). Намаляване на приема на калории се наблюдава при мишките на чау-диета през първата седмица от излагането на дим, а приемът на se + chow изглежда по-нисък от групата на фалшиви + чау през експерименталния период (фиг. 1). Това обаче не успя да достигне статистическа значимост, използвайки ANOVA с повтарящи се мерки. При животните, консумиращи HFD, излагането на цигарен дим е довело до значително намаляване на приема на калории от четвъртата седмица и е наблюдавано намаление с 36% при 7 седмици (se + HFD група; Фиг. 1). През 7-седмичния експериментален период HFD увеличи средния калориен прием 2,29 пъти както в бутафорните, така и в изложените на дим кохорти (P 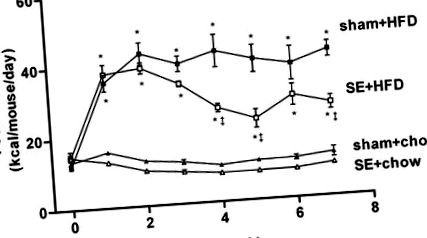
Фиг. 1.Калоричен прием (kcal · мишка -1 - 24 h -1) на изложеното на измама чау-фууд (бутафория + чау; ▴, н = 16), подложени на диета с високо съдържание на мазнини (HFD) (фалшиво + HFD; ▪, н = 16), изложени на дим (se) чау-фуд (se + чау; ▵, н = 16) и се захранва с HFD (se + HFD; □, н = 16) групи през експерименталния период. Резултатите са изразени като средни стойности ± SE. Данните бяха анализирани чрез еднопосочен ANOVA с многократни измервания, последвани от post hoc тестове с най-малка разлика (LSD). *P
маса 1. Телесно тегло, прием на храна, маса на органи и мазнини и дължина при мишки
Резултатите са изразени като средни стойности ± SE; н = 16 за изложени на измама чау-фууд (бутафория + чау), изложени на фалшиво хранене с високо съдържание на мазнини (HFD) (бутафория + HFD), изложени на дим (се), хранени с чау (се + чау) и се Хранени с HFD (se + HFD) мишки. НЕТ, кафява мастна тъкан; RpWAT, ретроперитонеална бяла мастна тъкан; N-A, назо-анален. Данните бяха анализирани чрез двупосочен ANOVA с post hoc тестове на Bonferroni.
* P ‡ P 0,33)/N-A дължина (mm).
Телесното тегло на всички групи беше добре съчетано в началото на експеримента (Фиг. 2). Животните с фалшиви чау наддават 30% телесно тегло по време на експеримента. Телесното тегло е значително увеличено от HFD както при фалшиви + HFD, така и при se + HFD групи. Ефектът от нетното наддаване на тегло от HFD е по-голям при животни, изложени на цигарен дим (фиг. 2). Увеличаването на телесното тегло бе намалено през първата седмица от излагането на цигарен дим както в групите se + chow, така и se + HFD, и това остана значително до края на експеримента (P
Фиг. 2.Телесно тегло на бутафорията + чау (▴, н = 16), бутафория + HFD (▪, н = 16), se + чау (▵, н = 16) и se + HFD (□, н = 16) групи през експерименталния период. Резултатите са изразени като средни стойности ± SE. Данните бяха анализирани чрез еднопосочен ANOVA с повтарящи се мерки, последвани от post hoc LSD тестове. *P
Тегло и телесно тегло при смърт.
На 7 седмици телесното тегло на групата фалшиво + HFD е било с 8% по-голямо от фалшивите + чау животни (P
Таблица 2. Концентрации на глюкоза в кръвта, плазмен лептин, инсулин, кортикостерон и NPY при мишки
Резултатите са изразени като средни стойности ± SE; н = 16. NPY, невропептид Y. Данните са анализирани чрез двупосочна ANOVA с post hoc тестове на Bonferroni.
* P ‡ P
Фиг. 3.експресия на иРНК на мастна триглицеридна липаза (ATGL) в бяла (WAT) и кафява мастна тъкан (BAT) в фалшиво + чау (отворени ленти), фалшиво + HFD (сиви ленти), se + чау (тънки барове) и se + HFD (черни ленти) групи в 7 седмици. Резултатите се изразяват като кратна разлика спрямо контролна проба за НДНТ и като средно ± SE. Данните бяха анализирани чрез двупосочен ANOVA, последван от post hoc тест Bonferroni. *P
Таблица 3. експресия на иРНК на UCP1 и UCP3 в BAT, TNF-α и IL-6 в WAT при 7 седмици
Резултатите се изразяват като кратна разлика спрямо контролната проба и като средно ± SE; н = 4. UCP1 и -3, разединяване на протеини 1 и 3. Данните са анализирани чрез двупосочна ANOVA.
Концентрация и съдържание на NPY в мозъка.
В изложената на фалшива кохорта концентрация на NPY в PVN и AH са значително намалени съответно с 14 и 16% при животни, консумиращи HFD (P
Фиг. 4.Мозъчен невропептид Y-подобна имунореактивност (NPY-LI; изразена като ng/mg тъкан) в бутафория + чау (отворени ленти; н = 16), бутафория + HFD (сиви ленти; н = 16), se + chow (набраздени пръти; н = 16) и se + HFD (черни ленти; н = 16) групи на 7 седмици. Показаните области са паравентрикуларно ядро (PVN), преден хипоталамус (AH), дъговидно ядро (ARC), заден хипоталамус (PH), медула (Med) и амигдала (AMYG). Резултатите са изразени като средни стойности ± SE. Данните бяха анализирани чрез двупосочен ANOVA, последван от post hoc тестове на Bonferroni. *P
По този начин излагането на дим изглежда частично обръща намаляването на хипоталамусния NPY пептид в отговор на HFD (фиг. 5), както е отразено в общото съдържание на хипоталамусен NPY, което е значително намалено при фалшивите + HFD животни в сравнение с групата фалшиво + чау (P
Фиг. 5.Общ хипоталамус NPY-LI в бутафорията + чау (отворени решетки; н = 16), бутафория + HFD (сиви ленти; н = 16), se + chow (набраздени пръти; н = 16) и se + HFD (черни ленти; н = 16) групи на 7 седмици. Резултатите са изразени като средни стойности ± SE. Данните бяха анализирани чрез двупосочен ANOVA, последван от post hoc тест Bonferroni. *P
В развития свят тютюнопушенето и затлъстяването обикновено се признават като най-важните модифицируеми фактори, отговорни за излишната смъртност на населението. Това се случва през цялата продължителност на живота и по-висока честота на сърдечно-съдов риск, свързан с инсулинова резистентност, се наблюдава при млади мъже пушачи в сравнение с непушачите (49). Както затлъстяването, така и пушенето на цигари също са важни рискови фактори при много свързани с възрастта заболявания, ускорявайки процеса на стареене чрез увеличаване на оксидативния стрес и възпалението (51). Предполага се (32, 52), че загубата на тегло, свързана с хронична обструктивна белодробна болест, която често се наблюдава при дългогодишни пушачи, всъщност се дължи на загуба на чиста телесна маса. Това проучване за първи път изследва комбинираните ефекти от тези две вредни поведения, пушенето на цигари и консумацията на енергийна, гъста и богата на мазнини диета.
Излагането на дим намалява линейния растеж, независимо от вида на диетата, докато HFD храненето увеличава дължината на тялото както при фалшиви, така и при изложени на дим животни. Излагането на цигарен дим също намалява затлъстяването при животни, хранени с чау, както се оценява по индекса на Lee, и това е обърнато чрез HFD хранене. Вместо да намали вредното въздействие на индуцираното от HFD затлъстяване, излагането на дим намалява наддаването на тегло, без значително намаляване на мастната маса в оценяваните региони. Нито глюкозата в кръвта беше намалена при тютюнопушене при животни, хранени с HFD. По-ниското телесно тегло на изложени на дим мишки върху чау е придружено от значително по-малки мастни и органни маси и по-ниски концентрации на лептин и инсулин в плазмата, докато хиперфагия, натрупване на мастна тъкан, хиперлептинемия и хипергликемия са налице при мишките, изложени на дим, които ядат HFD роднина за контрол на мишки.
- Ефекти от много нискокалоричната диета върху телесния състав, метаболитното състояние и експресията на гените a
- COVID-19 и метаболитният синдром могат да бъдат диетата като ключова BMJ доказателствена медицина
- Fad Diet плюсове и минуси Положителни ефекти и недостатъци на Fad Diets
- Промени в чревната микробиота при плъхове, хранени с високо съдържание на мазнини в диетата и свързаните със затлъстяването метаболитни вещества
- Промени в чревната микробиота, контролирана от метаболитно възпаление, предизвикано от ендотоксемия при високо съдържание на мазнини
