Резюме
Заден план
Катаболен отговор на стрес
След нараняване или инфекция Кътбъртсън описва кратка фаза „прилив“, свързана с намаляване на сърдечния обем и телесната температура, последвана от удължена фаза „поток“, свързана с увеличаване на енергийните разходи и подчертан катаболизъм [6]. Фазата на потока се състои от ранен период (приблизително 48 часа) и късен период (следващите 5 до 7 дни) [5]. Ако пациентът не успее да се възстанови напълно в късния период, фазата на потока е последвана от фаза на хронично критично заболяване, която може да продължи седмици (PICS), което е свързано с повишен разход на енергия в покой (REE) и тежък катаболизъм.
Хранителните вещества (главно глюкоза), необходими за борба с рани/наранявания/инфекции, в допълнение към необходимите за мозъка, бъбреците и хематопоетичната система, са получени отчасти от протеолиза и липолиза. Преобразуването на аминокиселини и глицерол в глюкоза обикновено се осъществява чрез глюконеогенеза и гликолиза. По време на фазата на хроничното критично заболяване обаче инсулиновата резистентност, свързана с хипергликемия, е често срещана и производството на хранителни вещества разчита главно на протеолиза и липолиза. Ретроспективно кохортно проучване, проведено в нашата институция, показа, че след 2 дни по-ниски енергийни разходи (приблизително 1650 kcal/d), REE достига плато около 2000 kcal/ден [7].
Разграждането на протеина може да достигне 12 до 16 g азот/ден в рамките на дни след приемането и може да увеличи до 30 g азот/ден в определени случаи [8]. Тази загуба на азот е свързана със значителна загуба на мускулна маса. Ендогенното производство на хранителни субстрати чрез протеолиза и липолиза за доставяне на достатъчно глюкоза в организма са минимално повлияни от екзогенното доставяне на субстрати чрез диета. Ето защо, по време на тази фаза на производство на ендогенен субстрат, персоналът на интензивното отделение трябва да бъде предпазлив да не прилага пълноценна хранителна терапия, която може да доведе до прехранване.
Енергийни изисквания и предписание
Прекомерното хранене и по-често недохранването са много чести в интензивното отделение и времето за постигане на целевите енергийни нужди може да се удължи [9]. Одитът за интензивно отделение на NutritionDay установи, че отнема 1 седмица, за да се постигне прием на 1500 kcal в повечето интензивни отделения в света [9]. Недохранването може да бъде свързано с продължителен престой и механична вентилация, инфекция и смъртност [10, 11]. Прекомерното хранене може да бъде свързано и с продължителна механична вентилация и инфекция, както и с повишени тестове за глюкоза, урея и чернодробна функция, които от своя страна са свързани с повишена заболеваемост [12].
Предложени са няколко прогнозни модела за прогнозиране на разхода на енергия в покой (REE). Ретроспективно валидиране на тези модели с действително измерени енергийни разходи [13] не показва връзка между прогнозираните и измерените енергийни разходи, с максимално съгласие от 0,5 за някои от моделите [14, 15]. Освен това проучванията демонстрират, че използването на тези модели може да доведе до хранителни препоръки, които или надценяват или подценяват хранителните нужди с 500 kcal или повече, което води съответно до свръх или недохранване.
Непряката калориметрия е предпочитаният метод за по-точно насочване на калорийните изисквания за REE и се препоръчва както от ASPEN [16], така и от ESPEN насоките [5]. Тъй като обаче наличността на метаболитни монитори за индиректна калориметрия е ограничена, разходът на енергия в покой може да бъде по-лесно извлечен от VCO2 (производство на въглероден диоксид), получен от вентилатора (REE = 8,2 × VCO2). Макар и по-малко точен от непрякото измерване на калориметрията, този метод за измерване на REE е по-прецизен от използването на прогнозни модели [17]. При липса на алтернативни методи могат да се използват прогнозни модели с осъзнаване на техните прогностични ограничения.
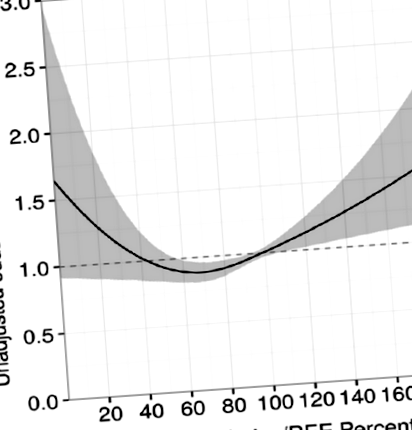
По отношение на препоръките за оптимален прием на калории, Zusman et al. [7] отбелязва, че осигуряването на между 70 и 100% от измерените енергийни разходи е свързано с подобрено оцеляване. Забележително е да се отбележи, че пациентите, които са получили над 100% от измерените енергийни нужди, са показали увеличение на смъртността (фиг. 1), подчертавайки важността на измерването на REE и по този начин избягвайки прекомерното хранене. Въпреки че проучването е било ретроспективно и наблюдателно, то е най-голямото досега изследване, сравняващо приема на калории с измерения енергиен разход и резултат. За потвърждаване на тези открития обаче са необходими проспективни рандомизирани проучвания.
Оцеляване според съотношението на доставените калории/разход на енергия и според прилаганите протеини. От [7] с разрешение
Настоящите насоки препоръчват започването на ентерално хранене в началото на престоя на интензивното отделение, тъй като това е свързано с намаляване на инфекциите. Калоричните енергийни цели трябва да бъдат постигнати в рамките на 3 дни, при условие че се внимава да се избегне прекомерно хранене и произтичащото увеличаване на риска от усложнения [18]. Ако целите за калориите не могат да бъдат постигнати чрез ентерално хранене, парентерално хранене може да се прилага между 3 и 7 ден от престоя на интензивното отделение, за да се допълни липсата на достатъчно калории [5]. Препоръчва се балансирано приложение на макронутриенти, включително липиди заедно с въглехидрати [5].
Специално внимание трябва да се обърне на електролитния статус. Всяко значително намаляване на калия, фосфора или магнезия може да застраши пациента и трябва да бъде коригирано незабавно, заедно с намаляване на приема на енергия с 50% за следващите няколко дни [19, 20]. Внимателното наблюдение на електролитния статус трябва да продължи по време на престоя на интензивното отделение, тъй като могат да възникнат клинично значими смущения не само при прием при тежки пациенти с недохранване, но и по време на престоя на интензивното отделение при добре хранени пациенти.
Препоръките за прием на протеин са 1,3 g/kg/ден, комбинирани с програма за упражнения [5]. Наблюдателни проучвания показват, че увеличеният прием на протеини е свързан с подобрена преживяемост [21,22,23]. Тази полза от смъртността обаче не е потвърдена в проспективни рандомизирани контролирани проучвания [24], които демонстрират само подобрения в бъбречната функция [25] или в мускулната маса [26]. Подобрението на бъбречната функция е свързано с увеличаване на бъбречния гломерулен резерв и варира в зависимост от натоварването с протеини и възрастта на пациента [5]. Други проучвания не са показали никакви клинични находки [27], благоприятстващи повишеното приложение на протеин.
Препоръките за прием на протеини зависят от клиничния статус на пациента. Пациентите със саркопения със значителен спад в мускулната маса имат повишен риск от смъртност и високо протеиновата диета може да подобри тяхното оцеляване [28]. Въпреки това, при септично болни приемът на протеини изглежда не влияе на резултата [29], както е видно от проучването EAT-ICU [24], което не показва подобрение при септично болни, получаващи високо (1,4 g/kg/d) протеин поемане. Post hoc анализ обаче показа значително подобрена преживяемост при пациенти с нормална бъбречна функция и висок прием на протеини [30].
Доказано е, че упражненията, като например с циклоергометър, подобряват краткосрочното възстановяване, което се доказва от подобрено с 6 минути разстояние, сила (?) И качество на живот [31]. Когато мобилизацията е активно планирана и осъществена, се наблюдава намаляване на продължителността на механичната вентилация и продължителността на престоя [32]. Въпреки това резултатите вероятно зависят от продължителността и честотата, както и от формата на упражнения. Освен това, осъществимостта или целесъобразността на аеробните упражнения в леглото при пациенти с интензивно отделение могат да ограничат приложението му.
Интересното е, че наскоро беше показано, че ранните физически упражнения през първата седмица на хоспитализация за пациенти със септичен шок запазват площта на напречното сечение на мускулните влакна [33]. Площта на напречното сечение на мускулните влакна (μm2) е запазена чрез упражнения (- 25,8% ± 21,6% в контрола срещу 12,4% ± 22,5% в интервенционната група; стр = 0,005), но не и без. Маркерите на катаболния убиквитин-протеазомен път бяха намалени на 7-ми ден само в интервенционната група. Прекомерното активиране на автофагия, наблюдавано след септичен шок, беше потиснато без модификация на маркерите на анаболизъм и възпаление, свързани със септичен шок. Тези резултати предполагат връзка между упражненията и запазването на мускулите при септично болни и ще изискват потвърждение в по-големи проучвания.
Хранене при възстановяване след критично заболяване
По време на фазата на възстановяване след освобождаване от механична вентилация може да настъпи пост-екстубационна дисфагия [34] от 3% до 60% от пациентите. Поради продължителната вентилация, много от тези пациенти страдат от тежка дисфагия, което води до намален прием на енергия, микроелементи и протеини, както и увеличени нива на пневмония, реинтубация и смъртност [35, 36]. Пероралният прием може да бъде допълнително нарушен чрез поддържаща вентилация след екстубация с назална канула с голям поток или други форми на неинвазивна вентилация [37]. Парадоксално е, че пациентът може да постигне по-голям прием на калории чрез ентерално хранене по време на механична вентилация, отколкото per os след екстубация. При тези обстоятелства насоките на ESPEN препоръчват хранителните нужди да се допълват чрез назогастрална сонда или парентерално хранене, за да се осигури адекватно снабдяване с енергия и протеини [5]. Тази стратегия трябва да се комбинира с активна рехабилитация на деглуция.
След изписване от отделението за интензивно лечение, пациентът трябва да бъде проследен по време на болничния престой от екип по хранене, тъй като продължителността на престоя може да бъде удължена и пациентите могат да страдат от допълнителна загуба на мускули и енергия при липса на добри хранителни насоки и физическа активност . Трябва да се приложи всеобхватен мултидисциплинарен подход към критично болния пациент от постъпване в интензивно отделение през болничния престой до изписване до рехабилитация, тъй като нарастващата немощ при хоспитализация може значително да наруши способността за успешна рехабилитация при изписване.
Заключения
Критично болните пациенти в реанимацията са изложени на значителен риск от недохранване. Протоколите за хранене, които не се ръководят от оценка на енергийните разходи в покой, могат да доведат до недохранване или прекомерно хранене. Индиректната калориметрия е предпочитаният метод за оценка на целта на РЗЕ за насочване на калорийния прием. Приемът на протеин трябва да бъде планиран да достигне 1,3 g/kg/ден. Трябва да се наблегне на ранното ентерално хранене, а когато това не е постижимо, трябва да се прилага парентерално хранене с внимателни параметри за мониторинг, за да се избегне прекомерното хранене. Упражненията могат да бъдат важна адювантна терапия за добавяне на калории и протеини. Тъй като пациентът напредва към възстановяване, усилията за поддържане на адекватен хранителен прием трябва да продължат, за да се предотврати недохранване, вследствие на дисфагия и лош прием през устата. Хранителната подкрепа и добавки, съобразени с етиологията и етапа на възстановяване на пациентите в интензивно отделение, могат да подобрят метаболитното състояние, да намалят заболеваемостта и да оптимизират дългосрочния успех на рехабилитацията.
Съкращения
Американско общество за парентерално и ентерално хранене
Европейско общество за клинично хранене и метаболизъм
- Хранене и физическа активност при пациенти с мозъчно-съдова болест - изглед в пълен текст
- Хранителни терапии за психични разстройства Nutrition Journal Пълен текст
- Хранителна намеса при загуба на СПИН - изглед в пълен текст
- Хранене и възпаление при пациенти с ампутация на долните крайници - изглед в пълен текст
- Значение на елиминационната и провокационна диета при пациенти с хронична уртикария - пълен текст