Michael Ashamalla 1, Irini Youssef 2, Mena Yacoub 3, Apoorva Jayarangaiah 4, Nikita Gupta 2, Justina Ray 2, Sadat Iqbal 2, Regina Miller 2 Joie Singh 2 и Samy I McFarlane 2 *
Информация за автора и статията
Цитирайте това като
Ashamalla M, Youssef I, Yacoub M, Jayarangaiah A, Gupta N, et al. (2018) Затлъстяване, диабет и стомашно-чревно злокачествено заболяване: Ролята на метформин и друга антидиабетна терапия. Glob J Obes Diabetes Metab Syndr 5 (2): 008-014. DOI: 10.17352/2455-8583.000032
Резюме
Връзката между диабет и рак е известна от десетилетия, като затлъстяването и инсулиновата резистентност се постулират като основните рискови фактори и за двете заболявания. С нарастването на епидемията от затлъстяване в САЩ и по света се наблюдава нарастване на диабета, който в момента достига епидемични размери. Известно е, че диабетът е свързан с повишен риск от няколко вида злокачествени заболявания, включително рак на гърдата, шийката на матката, панкреаса и дебелото черво. В този преглед ние обсъждаме епидемията от затлъстяване и произтичащата от това епидемия от диабет, подчертавайки патофизиологичните механизми на увеличения рак в диабетичната популация. След това ще обсъдим ролята на инсулиновата терапия, както и на други антидиабетни лекарства, особено метформин, който е свързан с по-нисък риск, както и по-добра преживяемост при GI злокачествени заболявания въз основа на няколко проучвания, включително проучване, публикувано наскоро от нашата група.
Основен текст на статията
Преглед на статията
Затлъстяването и диабетът стават все по-разпространени в световен мащаб. Честотата на рака също се прогнозира да се увеличи с над 20% до 2020 г. [1].
В световен мащаб ракът е втората причина за смърт, а диабетът е 12-тата [2]. Връзката между диабета и рака е добре установена от десетилетия. Всъщност множество епидемиологични проучвания показват, че захарният диабет тип 2 е независим рисков фактор за рак. Затлъстяването и вторичната инсулинова резистентност са свързани с основните рискови фактори както за диабет, така и за развитие на рак [3]. Едновременно с нарастването на епидемията от затлъстяване в световен мащаб се наблюдава и нарастване на диабета. Механистичната роля на диабета в канцерогенезата е стабилна и ясна за няколко злокачествени заболявания. В този преглед ние обсъждаме епидемията от затлъстяване, последващото му нарастване при диабет, подчертавайки патофизиологичните механизми на повишения рак при популацията на диабетиците. Накрая ще обсъдим ролята на инсулиновата терапия и терапията с метформин в риска и смъртността от рак.
Епидемиология на затлъстяването в САЩ и в световен мащаб
Затлъстяването е бързо нарастващо хронично заболяване както в САЩ, така и в световен мащаб. Оценките за разпространението на затлъстяването в Съединените щати са се увеличили почти неотслабващо през последните 50 години, увеличавайки се от 22,9% на 30,5% на 39,6% (NHANES). Очаква се тези стойности да нараснат до 51% от населението, което е увеличение от 130% до 2030 г. От 2015 до 2016 г. разпространението на затлъстяването при мъжете е 37,9%, 41,1% при жените (NHANES, [4,5]) и 18% при деца [6]. Разпространението е по-високо в Средния Запад и Юга и по-ниско в Североизточния и Западния бряг на САЩ (NHANES, [4,5]). Средният ИТМ също се увеличава в световен мащаб, като процентът на затлъстяването се утроява почти през 1975 г. През 2016 г. над 1,9 милиарда възрастни над 18 години са с наднормено тегло (СЗО). Въпреки че САЩ се гордее с най-голямата абсолютна стойност на възрастните с наднормено тегло и затлъстяване, други държави надвишават тази стойност както по разпространение, така и по темпове на растеж. За да назовем само няколко, разпространението на възрастните с наднормено тегло и затлъстяване в Мексико се оценява на 71,3%, което е увеличение с 15% от 2000 г. насам, поставяйки Мексико като най-бързият ускорител на затлъстяването, докато в Китай затлъстяването се е увеличило почти четири пъти при мъжете и се е удвоило жени и деца [6].
Връзка между затлъстяването и рака
Връзка между затлъстяването и диабета
Диабет и стомашно-чревни злокачествени заболявания: Епидемиология и механистично прозрение
Пациентите с диабет изпитват приблизително 20-25% по-висока честота на рак в сравнение с лица без диабет [17]. Нещо повече, пациентите с диабет, които допълнително развиват рак, са увеличили ранната и късната смъртност в сравнение с пациентите с рак без диабет [17]. Следва кратък преглед на връзката между диабета и различните видове рак.
Рак на черния дроб: Мета-анализ от Wang et al. демонстрира, че както мъжете, така и жените с тип 2 СД имат двукратно повишен риск от развитие на хепатоцелуларни карциноми (HCC), в сравнение с недиабетици [18]. В мета-анализ от Dyal et al. беше показано, че тип 2 DM е свързан с повишен риск от HCC, независимо от фактори, включително възраст, пол и затлъстяване. Още повече, затлъстяването и чернодробната стеатоза са независими предиктори на HCC [19]. Това предполага, че метаболитните нарушения, като затлъстяване, в допълнение към диабета, действат синергично за увеличаване на риска от HCC. Механизмите включват излагане на черния дроб на високи нива на ендогенно произведен инсулин през порталната вена. Тези повишени нива на инсулин впоследствие увеличават производството на нива на IGF-1, които след това увеличават клетъчната пролиферация и инхибират апоптозата в черния дроб [20]. Изследване на Jee et al. показа връзка между дозата между серумна глюкоза на гладно и смъртност от рак, в допълнение към нивата на рак на черния дроб [21]. Освен това, индуцираното от инсулинова резистентност освобождаване на възпалителни цитокини насърчава чернодробната стеатоза и възпаление. Като такива чернодробната стеатоза, хепатит и цироза са по-чести сред пациентите с диабет и са добре известни рискови фактори за HCC [22].
Колоректален рак: Връзката между диабета тип 2 и честотата на колоректалния рак е показана в няколко епидемиологични проучвания. Изследване за метаанализ от Jiang et al. показа, че пациентите с диабет са с 27% повишен риск от колоректален рак в сравнение с недиабетици [23]. Освен това, Peeters et al. демонстрира 1,3-кратно увеличение на риска от колоректален рак сред популациите с диабет, заедно с тенденция на повишен риск за по-голяма продължителност на затлъстяването [24]. Потенциалните механизми включват по-бавна перисталтика и запек при пациенти с диабет, причиняващи повишена експозиция на токсини в червата, включително фекални жлъчни киселини и потенциални канцерогени [25,26]. Хиперинсулинемията и повишените нива на IGF-1 също допринасят за аденокарциномите чрез повишена клетъчна пролиферация [22].
Рак на стомаха: Въздействието на диабета върху честотата на рак на стомаха показва различни резултати в проучванията. Мета-анализ от Ge et al. при проучвания между 1966 и 2011 г. установи сходен риск от рак на стомаха между диабетици и недиабетици. Анализ на подгрупата обаче показва, че жените с диабет имат 18% повишен риск, макар и не при мъжете с диабет [32]. Друг мета-анализ на Yoon et al, включително проучвания от всяка дата, установява значително повишен относителен риск (1,19; 95% CI [1,08-1,31] след коригиране за добре известни рискови фактори, включително тютюнопушене и H-pylori инфекция. авторите по същия начин установяват, че женските подгрупи са изложени на по-висок риск [33]. Shimoyama et al. също демонстрират повишен относителен риск от рак на стомаха сред пациентите с диабет (RR от 1,41, [95% CI: 1,10-1,81]). Това проучване установи че и двата пола имат значителна връзка, макар и по-голяма при жените. Някои проучвания показват, че диабетиците имат по-висок процент на инфекция с H. Pylori, добре известен рисков фактор за рак на стомаха, поради нарушена имунна функция [34]. съпътстващият диабет и инфекцията с H. Pylori са свързани с драстично повишен риск от рак на стомаха [35].
Диабет и рак: Механизъм
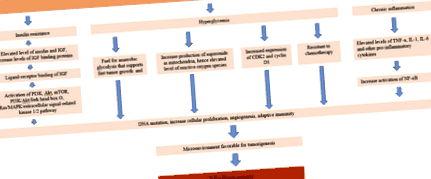
Описани са няколко механизма, свързващи диабета с повишената канцерогенеза. Известно е, че инсулиновата резистентност увеличава циркулиращите нива на инсулин и IGF. Свързването на лигандите на тези повишени циркулиращи фактори с инсулиновите рецептори, експресирани върху раковите клетки, упражнява про-растежен митогенен ефект, стимулирайки растежа на туморните клетки. Това наблюдение се потвърждава допълнително от намален туморен растеж при ксенотрансплантати с намалена експресия на инсулинови рецептори. Сигнализирането надолу по веригата след взаимодействие между лиганд и рецептор активира фосфоинозитид 3-киназата (PI3K), протеин киназата B (Akt), мишената на рапамицин (mTOR), PI3K/Akt/виличната кутия O и Ras/MAPK/свързаната с извънклетъчната сигнална киназа 1/2 път, който играе важна роля в растежа на раковите клетки и канцерогенезата [22].
Освен това хроничното възпаление е свързано с повишена канцерогенеза. Дерегулираният метаболизъм, свързан с лошо контролиран диабет, повишава както оксидативния стрес, така и регулирането на провъзпалителните цитокини, включително IL-6, TNF-a и С-реактивен протеин. Повишеният оксидативен стрес причинява увреждане на ДНК, мастни киселини и аминокиселини, всички участващи в трансформацията на клетките в злокачествено заболяване. TNF-a също причинява повишено активиране на ядрен фактор-капа B (NF-KB), който индуцира сигнализиране за пролиферация на клетките, ангиогенеза, оцеляване, подриване на адаптивния имунитет и отговор на хормонални и химиотерапевтични агенти [22]. Тези механизми са обобщени на фигура 1.
Инсулиновата терапия и нейната роля в канцерогенезата
Три големи рандомизирани проучвания сравняват инсулиновата терапия с други лечения за оценка на риска от рак. Проспективното проучване на диабета в Обединеното кралство (UKPDS) съобщава за кумулативна честота на свързана с рак смърт от 4,9% за инсулинова терапия срещу 5% за други лечения, в продължение на 11 години [40]. Проучването за намаляване на резултатите с първоначална интервенция с Glargine (ORIGIN) рандомизира 12, 537 пациенти с диабет или на гларгин инсулин, или на перорална терапия [41]. Проучването установи сходна обща честота на рака между двете групи (HR 1.00, CI [.88-1.13]) и свързаната с рака смъртност (HR 0.94 [0.77–1.15]) [41]. Обратно, разширеното проследяване на инсулино-глюкозната инфузия при захарен диабет при остър миокарден инфаркт (DIGAMI-1) съобщава за значително по-висока кумулативна смъртност, свързана с рака (4,4% спрямо 2,0%) в групата за лечение на хроничен инсулин [42] . Струва си да се отбележи, че нито едно от тези проучвания не е специално създадено за оценка на риска от рак, свързан с инсулиновата терапия. Освен това, в гореспоменатите проучвания, инсулинът беше спасителна терапия за пациенти в контролната група, потенциално намаляваща разликите в резултатите между двете групи.
Понастоящем има неубедителни доказателства, че екзогенният инсулин е свързан с повишен риск от рак. Гореспоменатите рандомизирани контролни проучвания не успяха да покажат повишена честота на рака, не бяха предназначени да го направят и имат присъщи пристрастия и ограничения. Освен това, in vitro проучванията, макар и да са полезни, имат недостатъци, когато превеждат резултатите си на хора. Ясно е, че са необходими по-рандомизирани контролни проучвания, преди да се знае истинското въздействие на екзогенната инсулинова терапия върху честотата на рака и риска.
Метформин и намаляване на риска от рак
Няколко епидемиологични проучвания потвърдиха връзката между употребата на метформин и намаляването на риска от рак. В мета-анализ от Soranna et al, употребата на метформин е свързана със значително намален относителен риск от всички видове рак (RR 0,61, 95% доверителен интервал [CI] 0,54-0,70) [48]. По същия начин, друг мета-анализ на 12 RCT и 41 наблюдателни проучвания установява намаляване на смъртността от рак с 35% и риска от рак, с 27%, с използването на метформин. По-специално авторите установяват, че метформин е свързан само с намаляване на злокачествените заболявания на стомашно-чревния тракт [49]. Множество други наблюдателни проучвания отбелязват същото въздействие [50]. Ретроспективно проучване на Tseng et al. също съобщава за значително по-нисък риск от рак на стомаха при потребители на метформин, особено след продължителност на 2-годишна употреба (HR .448, 95% CI [0.359-0.558]) [51]. В друго голямо проспективно проучване на 480 984 пациенти от Лий и колеги, употребата на метформин при диабетици е свързана с намаляване на общия, колоректален, панкреатичен и чернодробен карцином [52]. Интересното е, че е показано, че употребата на метформин подобрява нивата на химиотерапевтичен отговор и намалява локорегионалния рецидив след лъчева терапия при пациенти с рак на хранопровода [53].
Механистичен поглед върху метформин и намален риск от рак
Оцеляване с терапия с метформин
Диета, упражнения и тяхната роля при рака
Заключение и бъдеща посока
Тъй като епидемията от затлъстяване продължава да нараства, нейните последици продължават да се усещат от населението в световен мащаб. Доказателствата за въздействието на затлъстяването върху диабета и неговата роля в канцерогенезата и смъртността от рак стават все по-силни. Затлъстяването не се изисква само за развитието на СД тип 2, но както затлъстяването, така и диабетът са независими рискови фактори за развитие и прогресия на тумора и са свързани с по-лоши резултати от оцеляването и намален отговор на терапията при пациенти с рак. Въпреки че изглеждат непреклонни в своето въздействие, затлъстяването и диабетът са както предотвратими, така и контролируеми заболявания, а няколко проучвания показват влиянието на правилната диета и физическата активност върху смъртността от рак. Бъдещите насоки за смекчаване на тежестта на затлъстяването и диабета върху канцерогенезата и смъртността изискват рандомизирани контролни проучвания. Понастоящем има текущи проучвания, изучаващи въздействието на диабет, загуба на тегло и терапия, включително, но не само въздействието на загубата на тегло върху рецидивите на рака на гърдата (NCT02750826), пренасочване на метформин като противораково лекарство (NCT03137186) и осъществимостта на диета и упражнения при неинвазивен рак на пикочния мехур (NCT03137186).
Благодарихме на Лу Шуншун за проверката на данните в университета в Нингбо.
Финансиране
Тази работа беше подкрепена от Националната фондация за естествени науки на Китай (номера на гранта № 31500751, 2015) и Министерството на науката и технологиите, подкрепящи Националния научен и технологичен основен проект на Китай (номера на гранта № 2013ZX10004–904, 2013).
- Роля на наднорменото тегло и затлъстяването при стомашно-чревни заболявания
- Метформин за затлъстяване при деца и юноши Систематичен преглед Диабетна грижа
- Роля на метформин при хора с наднормено тегло и затлъстяване без диабет систематичен преглед и мрежа
- Затлъстяване, захарен диабет и фиброза на черния дроб American Journal of Physiology-Gastrointestinal and
- Затлъстяване, диабет и COVID-19 Какво трябва да знаят PCP