Свързани термини:
- Лигнин
- Въглехидрати
- Ензим
- Протеин
- Глюкоза
- Кофеинова киселина
- Триацилглицерол липаза
- Алфа амилаза слюнка изоензим
- Алфа глюкозидаза
- Амилаза
Изтеглете като PDF
За тази страница
Малабсорбция на въглехидрати и лактоза
Ричард Дж. Гранд,. Ханс А. Бюлер, в Енциклопедия по гастроентерология, 2004
Интралуминални фазови дефекти
Дефицитът на панкреатична амилаза се наблюдава при наследствени заболявания на екзокринния панкреас (особено муковисцидоза и синдром на Швахман-Даймънд), панкреатична недостатъчност поради алкохол или хроничен панкреатит и бактериален свръхрастеж. По-голямата част от пациентите с муковисцидоза отсъстват или имат ниски нива на амилазна активност; техните симптоми обаче обикновено се дължат повече на мазнините, отколкото на лошото храносмилане. Синдромът на Швахман – Даймънд, състоящ се от екзокринна панкреатична недостатъчност и хематологични и скелетни аномалии, е втората по честота причина за наследствена панкреатична недостатъчност при деца. Активността на амилазата е ниска или липсва при такива пациенти и те имат диария и малабсорбция. Ниските нива на амилаза при възрастни с панкреатична недостатъчност са добре описани и бактериалният свръхрастеж може да доведе до интралуминална ферментация. Дефицитът на амилаза обикновено се лекува успешно чрез прилагане на панкреатични добавки, като се постига практически пълно усвояване на въглехидратите. Елиминирането на сложни въглехидрати от диетата не е приемливо. Синдромът на свръхрастеж на бактерии се лекува с подходящи антибиотици.
Инхибиране на а-амилазата на свинския панкреас от хлорогенни киселини от зелени зърна кафе и производни на канелна киселина
Юсаку Нарита, Кунийо Инуе, в „Кафе в здравеопазването и профилактиката на заболяванията“, 2015 г.
84.2 PPA инхибиращи ефекти на 5-CQA, CA и QA
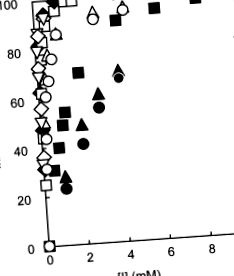
Известно е, че PPA хидролизира p-нитрофенил-α- d-малтозид (G2-pNP) в една позиция, за да произведе p-нитрофенол и малтоза. 30 Относителните активности на PPA-I и PPA-II по отношение на G2-pNP като субстрат в присъствието и отсъствието на 5-CQA, CA и QA намаляват с увеличаване на концентрациите на инхибитора (Фигура 84.1). 26 Техните инхибиторни ефекти срещу катализираната от изозим хидролиза на G2-pNP са в порядъка на 5-CQA> CA> QA (Таблица 84.1), 26 което се съгласува с реда на инхибиторните ефекти на тези инхибитори върху суров PPA с нишесте. 23 PPA-I и PPA-II бяха инхибирани напълно от 5-CQA при концентрации от 1,5 и 2,0 mmol/l при рН 6,9 и 30 ° C, съответно. 26 Инхибирането на 5-CQA и CA срещу PPA-I намалява с повишаване на температурите (Фигура 84.2). 26 Инхибирането на QA обаче не зависи от температурата и показва, че инхибиторната активност е приблизително постоянна (Фигура 84.2). 26
ФИГУРА 84.1. Инхибирането на девет вида CGAs срещу активността на PPA-I (субстрат: G2-pNP). 26,29
Символите: 3-CQA (отворени кръгове), 4-CQA (отворени триъгълници), 5-CQA (отворени квадрати), 3-FQA (плътни кръгове), 4-FQA (плътни триъгълници), 5-FQA (плътни квадратчета), 3,4-diCQA (отворени диаманти), 3,5-diCQA (твърди диаманти) и 4,5-diCQA (обърнати триъгълници).
ТАБЛИЦА 84.1. Резюме на кинетичните параметри за инхибитори на активността на PPA-I (субстрат: G2-pNP)
| 3-CQA | 0,23 | 0,61 | 0,13 | 2.37 | 29 | ||||
| 4-CQA | 0,12 | 0,24 | 0.10 | 3.77 | 29 | ||||
| 5-CQA | 0,08 | (0,07) a | 0,23 | (0,21) | 0,05 | (0,05) | 3.04 | (3.12) | 26 |
| 3-FQA | 2.55 | 6.14 | 1.74 | 2.34 | 29 | ||||
| 4-FQA | 2.02 | 4.34 | 1.40 | 2.97 | 29 | ||||
| 5-FQA | 1.09 | 1.95 | 0,99 | 4.51 | 29 | ||||
| 3,4-diCQA | 0,02 | 0,01 | 0,02 | 7.70 | 29 | ||||
| 3,5-diCQA | 0,03 | 0.10 | 0,01 | 1.18 | 29 | ||||
| 4,5-diCQA | 0,02 | 0,01 | 0,03 | 9.02 | 29 | ||||
| CA | 0,40 | (0,07) | 1.12 | (1,64) | 0,27 | (0,25) | 3.04 | (3.32) | 26 |
| DHCA | 1.94 | 10.21 | 1.61 | 3.11 | 29 | ||||
| FA | 5.45 | 11.17 | 4.87 | 3.15 | 29 | ||||
| АКО | 4.27 | 7.16 | 4.11 | 3.42 | 29 | ||||
| m-CoA | 4.51 | 8.12 | 3.31 | 3.52 | 29 | ||||
| p-CoA | 4.86 | 7,82 | 3.88 | 3.89 | 29 | ||||
| m-MCiA | > 4.5 | ° С | 39.46 | 4.96 | 3.30 | 29 | |||
| p-MCiA | > 4.5 | ° С | 45,83 | 3.63 | 2.81 | 29 | |||
| CiA | > 6,0 | ° С | 45,99 | 8,69 | 3.64 | 29 | |||
| QA | 26.5 | (25.3) | Н. А. б | Н. А. | Н. А. | 26 | |||
Стойностите на км за PPA-I- и PPA-II-катализирана хидролиза на G2-pNP са съответно 5,09 и 4,97 mmol/l. 26,29
a Стойностите в скоби показват тези, получени за PPA-II. b N. A., не е анализиран. c IC50 стойностите на m-MCiA, p-MCiA и CiA не могат да бъдат определени поради тяхната ниска разтворимост и слаби инхибиторни ефекти.
ФИГУРА 84.2. Температурна зависимост на инхибирането на 5-CQA, CA, QA, 5-FQA и 4,5-diCQA срещу PPA-I (субстрат: G2-pNP). 26,29
Символите: 5-CQA (отворени кръгове), CA (отворени триъгълници), QA (отворени квадрати), 5-FQA (плътни кръгове), 4,5-diCQA (плътни триъгълници). Анализите на инхибиране се провеждат в 0,1 mol/l фосфатен буфер, съдържащ 25 mmol/l NaCl при рН 6,9 в температурния диапазон 20–40 ° C. Първоначалните концентрации на 5-CQA, CA, QA, 5-FQA и 4,5-diCQA са съответно 0,1, 0,3, 25, 0,8 и 0,04 mmol/l.
Стандартните промени в енергията на Гибс (ΔG °), стандартните промени в енталпията (ΔH °) и стандартните промени в ентропията (ΔS °) по време на свързването на 5-CQA или CA с PPA-I или PPA-II са обобщени в таблица 84.2 . 26 Тези резултати предполагат, че взаимодействията на PPA-I или PPA-II с 5-CQA или CA са екзотермични с голямо увеличение на ΔH °, което показва, че взаимодействието е обусловено от енталпия. 26 Енталпия – компенсация на ентропията се наблюдава при всички взаимодействия между PPA-I или PPA-II и 5-CQA или CA. 26 Тази компенсация изглежда широко разпространено явление и се използва широко като обяснителен принцип в термодинамичния анализ на протеини, нуклеинови киселини и др. 38,39 Предполага се, че тази компенсация може да е присъщо свойство на комплекс, флуктуиране или воден разтвор системи. 38,39 Когато PPA и инхибиторите взаимодействат, за да образуват EI комплекси, състоянията на солватиране на ензима и инхибиторите могат да бъдат придружени от големи промени в техните енталпии и ентропии с много незначителни ефекти върху енергията на Гибс на солватация. 26
ТАБЛИЦА 84.2. Термодинамични параметри на свързване за взаимодействието на инхибиторите с PPA-I (Единица на параметъра: kJ/mol)
- Клетки за разплод - общ преглед на ScienceDirect теми
- Елдово брашно - общ преглед на ScienceDirect теми
- Рефлукс на жлъчката - общ преглед на ScienceDirect теми
- Добив на труп - общ преглед на ScienceDirect теми
- Anorexigenic Agent - общ преглед на ScienceDirect теми