Свързани термини:
- Неврогенеза
- Калоричен прием
- Ограничение на диетата
- Ограничение на калориите
- На гладно
- Прекъсващо гладуване
Изтеглете като PDF
За тази страница
Ограничение на калориите при хората
Ерик Равусин,. Leanne M. Redman, в „Молекулярни основи на храненето и стареенето“, 2016
Прекъсващо гладуване
Постоянният пост или периодите на въздържане от храна и напитки са често срещана религиозна практика от древни времена. Периодичното гладуване като средство за ограничаване на калориите набира популярност. В изследванията периодичното гладуване обхваща различни режими, включително алтернативно дневно гладуване (AFD), модифицирано AFD и диета 5: 2 [6]. AFD, който е постигнал много научен фокус, се състои от ден на либитум, често наричан „фуражен ден“, последван от ден без консумация на калории, наречен „бърз ден“. Този редуващ се модел на прием на храна продължава по време на диетичната интервенция. Модификациите на този строг режим на хранене и гладуване бяха разработени с мисленето, за да се улесни по-високото ниво на индивидуално придържане за по-дълги периоди. Модифицираният AFD, обикновено наричан в литературата като алтернативен ден, модифициран бързо или ADMF, позволява известен прием на калории в бързия ден, макар и сериозно ограничен (
Хранене
Синаптична пластичност и неврогенеза
Доказано е, че енергийните ограничения увеличават средната и максималната продължителност на живота на плъхове и мишки с до 50% и забавят свързаните с възрастта дефицити в двигателната функция и обучението и паметта ( маса 1 ). Например, ограничението на калориите през целия живот (CR; 30-40% намаление под нивата ad libitum) и периодичното гладуване (IF; всеки ден гладуване), започвайки след пубертета, подобрява ефективността на мишките при тестове за двигателна координация и сложно обучение . И обратно, дългосрочното прехранване, особено с диети с високо съдържание на мазнини и въглехидрати, може да наруши ученето и паметта и двигателната функция при гризачите. Електрофизиологичните записи на синаптично предаване в хипокампи от възрастни плъхове, които са били поддържани на контролни и CR диети, показват, че дългосрочното потенциране (LTP), за което се смята, че е клетъчен корелат на обучението и паметта, се засилва от диети с ниска енергия Фигура 1 ). В допълнение, данните от проучвания на затлъстели и нелекувани хора с диабет предполагат вредно въздействие на високоенергийните диети върху когнитивната функция, което може да е резултат от хронично повишаване на циркулиращата глюкоза и липиди.
Маса 1 . Обобщение на ефектите от приема на енергия (нискоенергиен: CR и IF; високоенергиен: диета с високо съдържание на мазнини/глюкоза) върху пластичността на мозъка и невроналната уязвимост
| Калорично ограничение (CR) | Подобрете | Намаляване |
| Периодично гладуване (IF) | Подобрете | Намаляване |
| Високо съдържание на мазнини/високо съдържание на глюкоза | Намаляване | Подобрете |
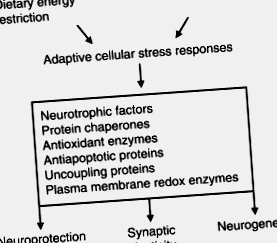
Фигура 1 . Модел на хормезис на механизма, чрез който ограничаването на диетичната енергия повишава невронната пластичност и устойчивостта на болести. Ограничаването на енергията налага лек стрес върху нервните клетки, което води до активиране на сигналните пътища, които усилват регулирането на експресията на протеини, които насърчават невроналното оцеляване, синаптичната пластичност и неврогенезата. Тези протеини включват невротрофни фактори като BDNF, протеинови шаперони, антиоксиданти, митохондриални разединяващи протеини и редукционни ензими на плазмената мембрана. Сигналните пътища за инсулин и IGF-1 реагират на ограничаване на енергията и могат да допринесат за адаптивните стресови реакции на нервните клетки.
Мозъкът на възрастен съдържа популации от невронни стволови клетки, които се делят и са способни да се диференцират в нови неврони; тези клетки се намират предимно в зъбната извивка на хипокампуса и субвентрикуларната зона на мозъчната кора. Въпреки това, много новогенерирани неврони претърпяват форма на програмирана клетъчна смърт, наречена апоптоза и следователно никога не стават функционални. Хипокампалната неврогенеза се увеличава при плъхове и мишки, поддържани на режим на рестрикция на IF енергия, очевидно в резултат на увеличената преживяемост на новогенерираните неврони ( Фигура 1 ). От друга страна, контролираната CR води до повишена преживяемост на новогенерираните глиални клетки, без да се засяга неврогенезата. Интересното е, че увеличените енергийни разходи (редовно упражнение) и исхемията също подобряват хипокампалната неврогенеза, демонстрирайки високо ниво на чувствителност на нервните стволови клетки към промени в енергийния метаболизъм. Прекомерният прием на енергия и диабетът потискат неврогенезата при модели на гризачи. Тъй като последните открития показват, че неврогенезата играе важна роля в адаптивните реакции на мозъка към променящата се среда, енергийният прием вероятно ще повлияе на тези реакции.
Диетичен и хранителен регламент
Интермитентно гладуване: Ефекти от разширяването на времето между храненията
Междинното или периодичното гладуване (IF) се отнася до алтернативни периоди на прием на AL с пълно или частично ограничаване на калориите. Подобно на CR, IF не означава тежко лишаване от хранителни вещества/глад и всички режими на IF са на фона на адекватен прием на витамини и минерали (Longo & Mattson, 2014). Най-широко използваната парадигма на IF при проучвания върху животни е гладуването с алтернативно ежедневие, което е адаптирано за хората под формата на все по-популярната диета „5, 2“, която включва 2 дни пълен или частичен CR през седмичен период (Mattson и др., 2014). Забележително е, че IF не намалява непременно общата консумация на калории или по-ниското телесно тегло, тъй като субектите могат да компенсират намаления прием по време на ограничителния период чрез преяждане на AL фазата, въпреки че в много проучвания прилагането на IF води до 20-30% намаляване на калориите консумация във времето (Longo & Mattson, 2014).
Неотдавнашно проучване предложи допълнителната концепция за ограничено във времето хранене, при което субектите могат да консумират само по време на обикновен дневен прозорец от 8–9 часа, където ползите са пропорционални на продължителността на гладуването (Chaix, Zarrinpar, Miu и Panda, 2014) . Освен това, това проучване също така показва, че ползите се запазват, когато ограниченото във времето хранене е прекъснато от периоди на AL, като например през уикендите, констатация от особено значение за хората. Това проучване също така съобщава, че периодите на ограничено във времето хранене „предпазват“ срещу, или по-скоро намаляват, негативните въздействия на обезогенната диета (Chaix et al., 2014).
Доказано е, че режимите на IF предизвикват множество положителни въздействия върху метаболитните профили и свързаните с възрастта заболявания при проучвания върху животни; те включват затихване или профилактика на подобни на диабет фенотипи и сърдечно-съдови заболявания, както и увеличаване на максималната продължителност на живота (Longo & Mattson, 2014). На молекулярно ниво се смята, че IF включва ангажирани адаптивни клетъчни пътища за реакция на стрес и изглежда ангажира много от пътищата, описани по-горе за CR (Mattson et al., 2014).
Много проучвания са възприели парадигма за алтернативно хранене, за да се постигне намален прием на калории; като такъв, той остава тема на открита дискусия дали CR или периодът на самото гладуване е този, който движи благотворните ефекти. Например 30% CR, постигнато чрез алтернативно дневно гладуване, увеличава оцеляването на новородените клетки в DG, което води до засилена неврогенеза и глиогенеза (Lee, Seroogy, & Mattson, 2002). Съобщава се също така, че дългосрочният IF увеличава невроналната възбудимост и хипокампалната експресия на NMDA рецепторната единица NR2B, което води до засилени процеси на обучение и консолидация (Fontan-Lozano et al., 2007). Подобно на CR, IF включва множество процеси, за да предизвика положителните му ефекти върху пластичността на мозъка.
Неотдавнашно проучване оценява въздействието на IF върху AHN след преходна оклузия на мозъчната артерия и установява, че IF подобрява базалната и потиска индуцираното от инсулт увеличение на пролиферацията в SGZ и SVZ. IF намалява клетъчната смърт, но няма ефект върху диференциацията на невроните или глията. IF също намалява сензомоторното увреждане и размера на инфаркта след исхемия и реперфузия, което предполага, че IF предпазва от неврологични увреждания в мозъка с исхемичен инсулт, вероятно чрез намаляване на нивата на циркулиращ лептин (Manzanero et al., 2014).
Доколкото ни е известно, нито едно проучване върху животни, изследващо IF като лечение на разстройства на настроението/тревожност, не е оценило AHN като кандидат за клетъчен медиатор. Независимо от това, скорошно проучване показа, че само 9-часово гладуване при мишки, но не 3 или 18 часа, води до значителни антидепресантни ефекти и увеличава фосфорилирането на CREB (Li et al., 2014). 9-часовото гладуване, прилагано едновременно с антидепресанта имипрамин, доведе до адитивни антидепресантни ефекти и допълнително увеличи фосфорилирането на CREB в хипокампуса и фронталната кора (Li et al., 2014).
Подобно на проучвания за настроение/тревожност, нито едно проучване, изследващо IF в контекста на стареенето, не е оценило нивата на AHN при животните. Някои проучвания показват, че IF запазва синаптичната пластичност с увеличаване на възрастта (Djordjevic, Djordjevic, Adzic и Radojcic, 2012). Например, краткосрочното излагане на режим на ПЧ за подобряване на въздействието подобрява свързаните с възрастта спадове в когнитивните и двигателните функции, промените, свързани с повишена експресия на маркери за синаптична пластичност, както и намаляването на митохондриалните засилени оксидативни увреждания сложна IV активност както в мозъка, така и в периферните органи (Singh et al., 2012). Тези констатации се подкрепят от сходните ефекти на CR при смекчаване на свързаните с възрастта спадове на маркерите на синаптичната пластичност (Adams et al., 2008).
В проучване, използващо модел на тройна трансгенна мишка AD, дългосрочното поддържане на тези мишки (14 месеца) на 40% CR или IF диета, преди началото на фенотипа на заболяването, е спасило когнитивните дефицити (Halagappa et al., 2007). Благоприятните ефекти на CR върху познанието са свързани със значително намалени нива на β-амилоиден протеин и фосфо-тау. Интригуващо е, че IF изглежда предпазва невроните от нараняване, въпреки факта, че няма намаления нито в Aβ, нито в tau, което предполага, че този диетичен подход може да защити невроните след агрегацията на Aβ и tau. По-специално, обширното отлагане на β-амилоиди е добре документирано при възрастни хора при липса на когнитивни дефицити (Driscoll & Troncoso, 2011). Заедно тези данни предполагат, че стимулирането на адаптивните стресови реакции след IF е възможен механизъм, чрез който познанието се запазва въпреки изразени признаци на патология на заболяването (Stranahan & Mattson, 2012).
Стареене и рак
Пост и рак
Възрастни гризачи за биогеронтологични изследвания
Ограничение на калориите
Вълнуваща област в биогеронтологичните изследвания е акцентът върху намирането на интервенции, които забавят появата на фенотипите на стареенето или забавят процеса на стареене. Докато много съединения имат някои благоприятни ефекти при по-ниските организми или клетъчната култура, единствената намеса, за която е доказано, че удължава продължителността на живота и здравето на бозайниците, е ограничаването на калориите (CR). Когато гризачите се хранят с пълноценна хранителна диета, ограничена до 60–70% от приема на храна ad libitum, те обикновено живеят по-дълго, имат намалено бреме на заболяването и показват забавено начало на много от често срещаните фенотипове на стареенето (прегледано в Masoro, 2000 ). Разбирането на механизмите, чрез които CR удължава продължителността на живота и здравето, вероятно ще доведе до нови терапевтични интервенции за забавяне на негативните аспекти на стареенето. Ясно е, че инсулиновият сигнален път е един от възможните пътища, тъй като CR намалява свързаната с възрастта инсулинова резистентност. Действието на CR изглежда независимо от намаляването на телесното тегло, тъй като мишките, подложени на гладно през ден, не намаляват общия си прием на храна или телесното тегло, но въпреки това изпитват благоприятния ефект върху нивата на глюкоза и инсулин, както се вижда в стандартния CR протоколи (Anson et al., 2003).
ТАБЛИЦА 33.5. Ефект на ограничението на калориите върху продължителността на живота на избрани щамове на мишката a
| C57BL/6 | +24% | +24% |
| DBA/2 | −7% | -9% |
| B6D2F1 | +26% | +31% |
Повечето CR протоколи се поддържат от млада зряла възраст до края на живота и има противоречиви доклади за ползите от CR, когато той се инициира по-късно в живота. Weindruch и Walford (1982) съобщават, че CR, иницииран при мишки в средна възраст, дава полезни резултати, докато Forster et al. (2003) установяват, че когато CR е бил иницииран в напреднала възраст (22-25-месечна възраст), смъртността през първите 3 месеца е действително увеличена в сравнение с тази, наблюдавана в контролите на AL при 3 изследвани щама на мишки (C57BL/6, DBA/2, B6D2F1). Изследване на плъхове F344BNF1 не открива значителен ефект върху продължителността на живота и обременяването на тумора, когато CR е започнал в средата на живота (17 месеца) или в напреднала възраст (24 месеца) (Lipman et al., 1998). Въпреки това, проучване при хибридни мишки B6C3F1, при което CR е започнато на 19 месеца, води до 4-месечно увеличение на средната продължителност на живота над контролите на AL (Dhahbi et al., 2004). Докато CR и AL групите имат еднаква честота на новообразувания, има забавяне в началото на CR групата. Тези открития предполагат, че CR или терапевтичното насочване на пътищата, променени от CR, може да има потенциал за подобряване на здравето в напреднала възраст, дори когато интервенцията е започнала в средата на живота.
Ефектът на дългосрочната CR върху здравето варира в зависимост от щама, а също и от патологията. Докато общата тенденция е, че CR намалява честотата или забавя появата на повечето свързани с възрастта патологии, има изключения от правилото. Например, панкреатичната атрофия е често срещана при възрастни плъхове F344 и Браун Норвегия (BN) при хранене с AL. При CR честотата на атрофия на панкреаса намалява при плъхове F344, но се увеличава при плъхове BN (Lipman et al., 1999). CR забавя появата на катаракта при плъхове BN, но до напреднала възраст честотата на катаракта е еднаква при CR и AL контролите (Wolf et al., 2000). При плъхове F344 възрастта на поява е една и съща при CR и AL, но с възрастта плъховете честотата на катаракта се увеличава повече при плъховете AL, отколкото при плъховете CR, така че плъховете CR F344 показват намаляване на честотата на катаракта в напреднала възраст. И CR не изглежда да умерява възрастовата загуба на слуха при повечето щамове мишки (Willott et al., 1995). Тези открития служат за илюстриране на сложността на биологичното стареене, а също и значението на генетичния фон върху скоростта на стареене и модулацията на скоростта на стареене чрез интервенции като ограничаване на калориите.
- Аменорея - общ преглед на ScienceDirect теми
- Цвекло - общ преглед на ScienceDirect теми
- Калциев оксалатен камък - общ преглед на ScienceDirect теми
- Антихелминт - общ преглед на ScienceDirect теми
- Anorexia Nervosa - общ преглед на ScienceDirect теми