Хуанджи Янг
1 Програмата за превенция, Институт за рака на Барбара Ан Карманос и Катедра по патология, Медицински факултет, Държавен университет Уейн, Детройт, Мичиган, САЩ
Dong Kui Sun
2 Ключова лаборатория за морски лекарства, Министерство на образованието, Училище по медицина и фармация, Китайски университет в Оушън, Кингдао, Китай
Ди Чен
1 Програмата за превенция, Институт за рака на Барбара Ан Карманос и Катедра по патология, Медицински факултет, Държавен университет Уейн, Детройт, Мичиган, САЩ
Qiuzhi Cindy Cui
1 Програмата за превенция, Институт за рака на Барбара Ан Карманос и Катедра по патология, Медицински факултет, Държавен университет Уейн, Детройт, Мичиган, САЩ
Ян Ян Гу
2 Ключова лаборатория за морски лекарства, Министерство на образованието, Медицинско и фармацевтично училище, Китайски океански университет, Кингдао, Китай
Тао Дзян
2 Ключова лаборатория за морски лекарства, Министерство на образованието, Медицинско и фармацевтично училище, Китайски океански университет, Кингдао, Китай
Уей Чен
3 Biostatistics Core, Karmanos Cancer Institute и Department of Internal Medicine, Wayne State University, Детройт, Мичиган, САЩ
Шен Бяо Уан
2 Ключова лаборатория за морски лекарства, Министерство на образованието, Медицинско и фармацевтично училище, Китайски океански университет, Кингдао, Китай
Въпрос: Ping Dou
1 Програмата за превенция, Институт за рака на Барбара Ан Карманос и Катедра по патология, Медицински факултет, Държавен университет Уейн, Детройт, Мичиган, САЩ
Резюме
Епидемиологичните проучвания подкрепят раково-превантивните ефекти на зеления чай и неговата основна съставка (-) - епигалокатехин галат [(-) - EGCG], но (-) - EGCG е нестабилен при физиологични условия. Тук докладваме, че два нови флуорозаместени (-) - EGCG аналога инхибират растежа на тумора с подобна сила на тази на Pro-EGCG (1), която подобрява ефикасността спрямо родителското съединение (-) - EGCG при рак на гърдата при човека MDA-MB- 231 ксенографти. MDA-MB-231 тумори, лекувани с всеки флуоро-заместен (-) - EGCG аналог, показват протеазомно инхибиране и апоптотична клетъчна смърт, което предполага, че протеазомата може да е една от клетъчните мишени на флуоро - (-) - EGCG и че протеазомното инхибиране е частично отговорен за наблюдаваната противотуморна активност.
1. Въведение
Зелен чай се консумира широко в целия свят и е богат на полифеноли, включително (-) - епигалокатехин галат (EGCG), (-) - епикатехин галат (ЕКГ), (-) - епигалат катехин (EGC) и (-) -епикатехин (EC) [1]. Молекулярните механизми, отговорни за превенцията на рака и противораковите дейности на (-) - EGCG, основният полифенол на чая с най-биоактивно свойство, са широко проучени и са идентифицирани включените множество молекулярни пътища, включително инхибиране на митоген активирани протеинкинази ( MAPKs), инхибиране на сигнализирането на растежен фактор, потискане на пътя на ядрения фактор-кВ (NF-кВ) и инхибиране на протеазомата [2,3].
Клиничните проучвания с пациенти с рак на простатата показват, че консумацията на зелен чай дава обещаващи ефекти срещу развитието на рак, без да предизвиква големи токсичности [4,5]. Данните, получени от химиотерапевтичното приложение на екстракти от зелен чай в клиниката при лечение на установени солидни тумори, не са впечатляващи, с ограничена ефикасност [6–8], което предполага, че (-) - EGCG не може да достигне висока концентрация и сила в туморните места . При физиологични условия (-) - EGCG може бързо да се метаболизира след абсорбция от човешкото тяло [9]. Освен това, хидроксилните групи на (-) - EGCG могат да бъдат модифицирани чрез реакции на биотрансформация, включително метилиране, глюкурониране и образуване на сулфат, което води до намалена биологична активност на (-) - EGCG [10,11].
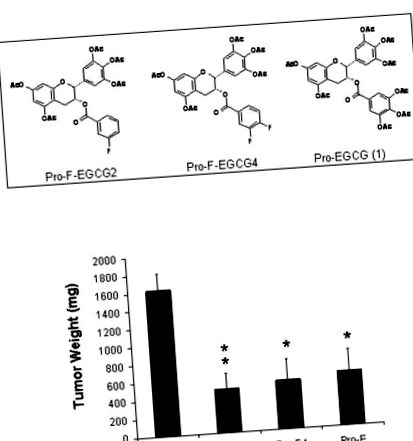
С цел подобряване на стабилността и ефикасността на (-) - EGCG, ние синтезирахме пролекарството на (-) - EGCG, Pro-EGCG (1), с всички реактивни хидроксилни групи, защитени от перацетатни групи. Ние показахме, че Pro-EGCG (1) е подобрил потентността да индуцира апоптоза при рак на гърдата, простатата и левкемия при човека в сравнение с (-) - EGCG [12,13]. За да открием нови мощни аналози на полифенол на чай като протеазомни инхибитори, ние разработихме и синтезирахме няколко нови флуоро-заместени (-) - EGCG аналози с елиминиране на -OH групи от D-пръстена и заменени с един или два флуор (и), наречени F-EGCG [14]. Нашият ин витро скрининг показва, че пролекарството на флуорозаместени (-) - EGCG в мета-позиция на фениловия пръстен (Pro-F-EGCG2, фиг. 1А) или дифлуоро-заместени (-) - EGCG както в мета-, така и в пара -позициите върху фениловия пръстен (Pro-F-EGCG4, фиг. 1А) имат подобна или дори по-голяма сила като Pro-EGCG (1) (фиг. 1А) за индуциране на апоптоза в култивирани човешки клетки на рак на гърдата [14]. В настоящото проучване ние изследвахме in vivo ефектите на тези флуорозаместени (-) - EGCG аналози по отношение на техните антитуморни и протеазомни инхибиторни дейности, използвайки ксенографтен модел на рак на гърдата.
А, Химични структури на две нови пролекарства на флуорозаместени EGCG. Показани са химичните структури на Pro-F-EGCG2, Pro-F-EGCG4 и защитения с перацетат EGCG [(Pro-EGCG (1)]. B, Инхибиране на растежа на тумора на MDA-MB-231. Голи мишки са били инокулирани с човешки рак на гърдата MDA-MB-231 клетки (5 × 106) .Когато туморите бяха откриваеми, голи мишки се подлагаха на ежедневно лечение с лекарствен носител (n = 9) или 50 mg/kg Pro-F-EGCG2 (Pro -F2) (n = 9), Pro-F-EGCG4 (Pro-F4) (n = 9) или контролен EGCG (Pro-E), защитен с перацетат (n = 6), както е описано в Материали и методи. В края на 31-дневното лечение мишките бяха евтаназирани и туморите бяха претеглени. Точки, средно тегло на тумора; барове, SE. **, р 6), суспендирани в 0,1 ml безсерумен RPMI 1640, бяха инокулирани s.c. в десния фланг на всяка мишка. Когато туморите достигнаха размер
120 mm 3, мишките бяха групирани на случаен принцип и третирани чрез ежедневно s.c. инжекция с 50 mg/kg Pro-F-EGCG2 или Pro-F-EGCG4 (девет мишки всяка група). Като контрол бяха използвани превозни средства [20% DMSO и 80% кремофор/етанол (3: 1)] (девет мишки) и същата доза Pro-EGCG (1) (шест мишки) [13]. Размерът на тумора се измерва през ден с помощта на дебеломери и техните обеми се изчисляват по стандартна формула: ширина 2 × дължина/2. Мишките се умъртвяват след 31 дни лечение, когато контролните тумори достигнат
1 500 mm 3. Туморите бяха претеглени и туморните тъкани бяха събрани за различни анализи.
2.4. Терминално нуклеотидил трансфераза-медиирано никелно маркиране (TUNEL), имунооцветяване на p27 и анализи на хематоксилин и еозин (H & E), използващи туморни тъкани
Анализ на терминална нуклеотидил трансфераза, медиирана с никел (TUNEL), използвайки in situ комплект за откриване на апоптоза и имунооцветяване на p27, са направени, както е описано по-горе [15]. H & E оцветяването в туморните тъкани се извършва в съответствие с протоколите на производителя.
2.5. Анализ на протеазомната активност
Екстракти от цяла тъкан (10 μg) от тумори MDA-MB-231 бяха инкубирани с флуорогенен субстрат Suc-Leu-Leu-Val-Tyr-AMC (20 μmol/L) при 37 ° C в 100 μL пробен буфер (50 mmol/L Tris-HCl, рН 8.0) за 2 часа. След инкубация се измерва производството на хидролизирани 7-амино-4-метилкумаринови (AMC) групи, като се използва многоезичен брояч на Victor 3 с възбуждащ филтър от 380 nm и емисионен филтър от 460 nm (Perkin-Elmer).
2.6. Western blot анализ
Екстракти от туморни тъкани (40 μg) се разделят чрез SDS-PAGE и се прехвърлят в нитроцелулозна мембрана, последвано от визуализация с помощта на подобрения комплект за хемилуминесценция (Amersham Biosciences), както е описано по-рано [16].
2. 7. Статистически анализ
120 mm 3), мишките са били s.c. ежедневно третирани с контрола на превозното средство или с 50 mg/kg Pro-F-EGCG2, Pro-F-EGCG4 или Pro-EGCG (1) като сравнение. В края на 31 дни контролните тумори нарастват до среден размер от 1620,6 ± 562,6 mg (фиг. 1В). Третираните с Pro-EGCG (1) тумори нарастват до 597,9 ± 603,1 mg, показвайки 63% инхибиране на растежа на тумора (p = 0,015), което е подобно на нашия предишен доклад (54% инхибиране на растежа на тумора) [13]. По същия начин, лекуваните с Pro-F-EGCG4 тумори нарастват до 537,4 ± 706,7 mg (фиг. 1В), показвайки
67% инхибиране на растежа на тумора, което е статистически различно от контролното лечение (p = 0,03). Лечението с Pro-F-EGCG2 нараства до 480,5 ± 517,6 mg, показвайки
70% инхибиране на растежа на тумора, което се различава значително от лечението с носител (p 0.3). Тези резултати показват, че пролекарството на флуоро-заместен (-) - аналог на EGCG, Pro-F-EGCG2 и Pro-F-EGCG4 са подобни на Pro-EGCG (1) за инхибиране на туморния растеж в туморния модел на гърдата MDA-MB-231 . Мишките показаха трайно до 50 mg/kg/ден лечение с Pro-F-EGCG през 31-дневния период. Не се наблюдава загуба на тегло и намалена активност както при третирани с Pro-F-EGCG2, така и при Pro-F-EGCG4 животни.
3.2. Флуорозаместените аналози на EGCG индуцират апоптоза при ксенографт на тумор на гърдата
Тези две нови пролекарства на флуоро-заместен EGCG индуцират апоптоза in vitro [14]. За да се определи дали те могат да достигнат туморните клетки и да предизвикат апоптоза in vivo, бяха проведени множество анализи с помощта на проби от туморни тъкани. PARP разцепване, индикатор за апоптоза [17] е открит в по-голяма степен в екстрактите от тумори, лекувани с Pro-F-EGCG2 или Pro-F-EGCG4, в сравнение с този, третиран с носител (Фиг. 2А). Освен това, апоптотични клетки, както е посочено от позитивността на TUNEL, са наблюдавани при тумори от животни, лекувани с Pro-F-EGCG2 или Pro-F-EGCG4 (фиг. 2В). Апоптотични ядра, както е показано чрез ядрена кондензация с използване на H&E оцветяване, са наблюдавани при тумори от животни, третирани с Pro-F-EGCG2 или Pro-F-EGCG4 (фиг. 2В). За сравнение, контролните тумори са наблюдавани в добро състояние на клетъчна пролиферация, както е показано от множество ядра, митотични хромозоми (фиг. 2В). Подобни резултати се наблюдават при множество туморни проби от всяка група.
Туморните тъкани се третират с носител (V) или Pro-F-EGCG2 (Pro-F2) или Pro-F-EGCG4 (Pro-F4). Протеините бяха извлечени от туморни тъкани, последвано от Western blot анализ, използващ антитяло срещу PARP (A). Пълната дължина на PARP е 116 kDa, докато разцепената форма на PARP е 65 kDa. В, туморните тъкани бяха разделени, последвано от TUNEL анализ и H&E оцветяване. Третираните с Pro-F-EGCG тумори показват TUNEL положителни клетки с кафяв цвят и кондензирани ядра в H&E оцветяване. Увеличения, × 400.
3.3 Флуорозаместените аналози на EGCG инхибират протеазомата в туморните тъкани
Туморите бяха третирани с носител (V) или Pro-F-EGCG2 (Pro-F2) или Pro-F-EGCG4 (Pro-F4), както е описано на Фигура 1 и бяха използвани тъкани. A, Анализ на активност, подобна на протеазомна химотрипсин. Протеините се екстрахират от туморни тъкани и се подлагат на анализ на протеазомната активност, като се използва Suc-LLVY субстрат за химотрипсиноподобна активност, както е описано в Материали и методи. Нивото на протеин на убиквитиниран протеин и протеазомни цели p27 и Bax бяха анализирани чрез Western blotting (B). Повсеместна форма на p27 (70 kDa) е обозначена със стрелка. Bax, бяха показани както p21, така и p18 форми. Актинът беше използван като контрол на натоварването. С, Имунохимия с р27 антитяло. Туморните тъкани бяха разделени за имунохимия, използвайки р27 антитяло. Увеличения, × 400.
В обобщение, нашите резултати показват, че пролекарствата на флуоро-заместени аналози на EGCG индуцират протеазомно инхибиране и индукция на апоптоза in vivo, както се наблюдава in vitro [14], и подобни на Pro-EGCG (1), пролекарствата на флуорозаместени (- ) -EGCG аналозите притежават мощна туморна активност срещу гърдата in vivo.
4. Дискусия
Инхибиторът на протеазома Bortezomib се използва като лечение на хематологични злокачествени заболявания в клинични изпитвания [21], подкрепяйки, че насочването към протеазомата е ефективна стратегия. Въпреки това са наблюдавани чести токсични странични ефекти, свързани с лечението с бортезомиб [21]. Освен това Bortezomib показа ограничени ефекти срещу солидни тумори [21], което насърчава изследователите да разработят нови протеазомни инхибитори за лечение на солидни тумори, включително рак на гърдата.
(-) - EGCG, основният компонент на зеления чай е мощен протеазомен инхибитор [22]. Той инхибира пречистената 20S протеазома със стойност на IC50 0,2-0,6 μmol/L. Въпреки това винаги се нуждае от висока концентрация, за да инхибира клетъчната протеазома, което предполага, че клетъчната сила на (-) - EGCG е намалена. Всъщност, (-) - EGCG е обект на бързо разграждане и няколко биологични модификации, което води до намалена активност на (-) - EGCG [23]. В сравнение с (-) - EGCG, неговото пролекарство, Pro-EGCG (1) с пероцетатна защита при всички реактивни хидроксилни групи на фенолни пръстени, показва повишена антитуморна активност, свързана с повишена активност върху инхибирането на протеазомата и индуцирането на апоптоза [13].
В това проучване тествахме антитуморната активност на две нови синтезирани пролекарства на флуорозаместени (-) - EGCG. Забелязваме, че въпреки че Pro-F-EGCG2 и Pro-F-EGCG4 показват мощна противотуморна активност при повечето лекувани мишки, една мишка от групата, лекувана или с Pro-F-EGCG2, или с Pro-F-EGCG4, отглежда тумор, сравним с контрола, което предполага, че е имало индивидуални вариации в отговор на лечение с флуорозаместени (-) - EGCGs. Въпреки това, статистическият анализ предполага, че флуорозаместените (-) - EGCG аналози значително инхибират растежа на тумора на гърдата, подобно на Pro-EGCG (1) (Фиг. 1).
При тестваната доза (50 mg/kg/d), както моно-, така и дифлуоро-заместените аналози на EGCG достигат ефективна концентрация, при която индуцират апоптоза в тумори, доказана чрез разцепване на PARP, позитивност на TUNEL и кондензирани ядра (фиг. 2) и инхибират клетъчна протеазома, както е показано чрез намалено ниво на протеазомна химотриптична активност и повишени нива на протеазомни субстрати като p27, Bax, както и убиквитинирани протеини (фиг. 3).
Индуцирани пролекарства на флуорозаместени (-) - EGCG
67–70% инхибиране на растежа на тумора (фиг. 1). Те обаче причиняват 33–42% инхибиране на протеазомната химотриптична активност (фиг. 3), което предполага, че протеазомата може да е само една от клетъчните мишени на флуорозаместени (-) - EGCG продукти и че протеазомното инхибиране може да бъде частично отговорно за инхибиране на растежа на тумора. Други молекули, участващи в наблюдаваното инхибиране на растежа на тумора, трябва да бъдат открити в бъдеще.
В нашия модел на голи мишки не се наблюдава загуба на тегло и намалена активност при мишки, третирани с флуоро (-) - EGCG през 31-дневния период на лечение, което предполага, че флуоро-заместен (-) - EGCG се толерира при модел на мишки.
Взети заедно, нашето наблюдение in vivo при голи мишки е в съответствие с нашите in vitro резултати, показващи, че пролекарствата на флуоро-заместен EGCG са мощни за инхибиране на растежа на рака на гърдата в дозата, поносима за мишки, което е частично свързано с протеазомно инхибиране в тумора тъкан. Дали флуорозаместените (-) - EGCG и техните пролекарства могат да бъдат биотрансформирани ще бъде определено в бъдеще.
Благодарности
Това изследване е частично подкрепено от Института за рак на Karmanos от Държавния университет на Уейн (към QP Dou), Националния институт по рака/NIH (1R01CA120009; 3R01CA120009-04S1 до QP Dou) и Националния институт по рака/NIH Център за подкрепа на рака (към Karmanos Cancer Институт). Благодарим на основния център по патология на Института за рак на Karmanos за съдействието при TUNEL и имунохистохимични анализи.
Бележки под линия
Конфликт на интереси
Потвърдихме, че няма потенциален конфликт на интереси по отношение на подаването и публикуването на нашия ръкопис, озаглавен „Антитуморната активност на новите флуорозаместени (-) - епигалокатехин-3-галатни аналози“. Всички автори са прочели и одобрили за изпращане в Cancer Letters.
Конфликт на интереси
Всички автори потвърждават, че няма потенциален конфликт на интереси по отношение на тази публикация.
Отказ от отговорност на издателя: Това е PDF файл на нередактиран ръкопис, който е приет за публикуване. Като услуга за нашите клиенти ние предоставяме тази ранна версия на ръкописа. Ръкописът ще бъде подложен на редактиране, набиране и преглед на полученото доказателство, преди да бъде публикуван в окончателния си вид. Моля, обърнете внимание, че по време на производствения процес могат да бъдат открити грешки, които биха могли да повлияят на съдържанието, и всички правни откази от отговорност, които се отнасят до списанието, се отнасят до.
- Новото производно на Indoline подобрява хроничната бъбречна болест, предизвикана от затлъстяване, чрез намаляване
- Нова мутация на MFSD8 при руски пациент с невронална цероидна липофусциноза тип 7 случай
- Завръщане към отслабването - нов подход - здравословно
- Оценка на вашето тегло Здравословно тегло, хранене и физическа активност CDC
- Аспартамът може да предотврати, а не да насърчи загуба на тегло, като блокира изследването на активността на чревния ензим