Мария де Лурд Морено
1 Departamento de Microbiología y Parasitología, Facultad de Farmacia, Universidad de Sevilla, c/Profesor García González 2, 41012 Севиля, Испания; se.su@oneroml (M.d.L.M); se.su@ramuosc (CS)
Алфонсо Родригес-Ерера
2 Unidad de Gastroenterología y Nutrición, Instituto Hispalense de Pediatría, 41013 Севиля, Испания; moc.airtaidepphi@zeugirdorosnofla
Каролина Соуза
1 Departamento de Microbiología y Parasitología, Facultad de Farmacia, Universidad de Sevilla, c/Profesor García González 2, 41012 Севиля, Испания; se.su@oneroml (M.d.L.M); se.su@ramuosc (CS)
Изабел Комино
1 Departamento de Microbiología y Parasitología, Facultad de Farmacia, Universidad de Sevilla, c/Profesor García González 2, 41012 Севиля, Испания; se.su@oneroml (M.d.L.M); se.su@ramuosc (CS)
Резюме
1. Въведение
Глутенът е сложна смес от неразтворими във вода протеини от пшеница, ечемик, ръж и овес, които увреждат пациентите с целиакия. Терминът глутен включва проламините (глиадини в пшеницата) и глутелините (глутенините в пшеницата). Проламините, сложна група от алкохолно разтворими протеини, представляват основните семенни протеини в зърнените култури и съдържат около 50% от протеините в зрелите зърнени култури. Други глутенови протеини, показващи, че аналогични имуногенни свойства присъстват и в ечемика (хордеини), ръжта (секалини), овеса (авенините) и други близки зърнени култури [1,2,3]. Тези протеини са богати на остатъци от пролин и глутамин, което ги прави устойчиви на стомашно-чревно храносмилане и насърчават дезаминирането от тъканната трансглутаминаза (tTG).
Целиакия (CD) е имунно-медиирано системно разстройство, предизвикано от поглъщане на глутен при генетично чувствителни индивиди. Той засяга около 1% от популацията и се основава на променлива комбинация от чревни и екстраинтестинални признаци и симптоми, специфични за целиакия антитела, HLA-DQ2/DQ8 хаплотипове и ентеропатия.
Към днешна дата основата на CD е строга безглутенова диета за цял живот (GFD). Съществува общ консенсус, че стриктното спазване на GFD при пациенти с CD води до пълна хистологична и клинична ремисия и подобряване на качеството на живот и намаляване на дългосрочните усложнения [4,5,6]. По този начин стриктното спазване на GFD води до значително подобряване на костната плътност [7,8,9,10] и нормализиране на витамините (напр. Витамин В12 между другото) и минералите, въпреки че понякога може да са необходими добавки за постигане на оптимални нива [ 11].
Съдържанието на глутен в храната се регулира от Codex Alimentarius [12]. Този регламент (CODEX STAN 118—1979, преработен през 2008 г.) гласи, че безглутеновите храни са тези, при които общите нива на глутен са ≤20 ppm [3]. Безглутеновите зърнени храни, като ориз, елда, царевица и просо, могат да заместят зърнените храни, съдържащи глутен. Някои бобови растения, като амарант, киноа и соя, са особено удобни поради високото си съдържание на протеини и качество. Освен това необработените храни като риба, месо, птици, яйца, зеленчуци и плодове се препоръчват за насърчаване на спазването на GFD и осигуряване на хранителната стойност на диетата [13].
Макар и концептуално прости, диетичните промени са съществени и имат дълбоко въздействие върху живота на пациента. Всъщност съществуват бариери, свързани с GFD, като наличност, цена и безопасност на храни без глутен или кръстосано замърсяване с глутен [14,15]. Очакваните проценти на съответствие се различават значително (17% –80%), в зависимост от фактори като възрастта на пациента или възрастта при диагностициране на CD, наред с други [16,17,18,19]. Лошото спазване на хранителния режим се оказа отрицателно за насърчаване на други автоимунни заболявания [20,21], проблеми с плодовитостта [22,23,24] и повишен риск от фрактура на костите [25] или лимфом [26,27]. Освен това, след приемане на GFD, 4% -30% от пациентите с CD съобщават за персистиращи симптоми и се счита, че са засегнати от нереагиращ CD (NRCD) [6]. Само 10% от тези пациенти с NRCD имат огнеупорен CD (RCD), тъй като неволното или умишлено излагане на глутен е най-честата причина за NRCD [28].
За да се оцени най-новата литература, свързана с CD и мониторинга на GFD, беше проведено търсене на научна литература за последните публикации за спазването на GFD и CD. Въз основа на тези актуализации целта на настоящата статия е да покаже и обсъди настоящите концепции за наличните инструменти за проследяване на пациенти с GFD.
Търсенето е проведено в бази данни PubMed MEDLINE и SCOPUS. Използвани са следните термини за търсене: „целиакия и диета без глутен“, „последваща целиакия“, „мониторинг на безглутенова диета“ и „управление на целиакия“. Ключовите думи „симптоми и цьолиакия“, „биопсия и цьолиакия“, „серологичен тест и цьолиакия“, „въпросник и цьолиакия“, „диетично интервю и цьолиакия“, „изпражнения и цьолиакия“ и „урина и целиакия “.
2. Мониторинг на спазването на диета без глутен
2.1. Оценка на симптомите
Проследяването на първоначалните симптоми или проявите на новоразработени служи за проверка на подобрението и развитието на CD. Съобщава се, че чревните симптоми на червата са чести при пациенти с CD, които не се придържат към GFD (коефициенти на шансове 2,69; 95% доверителни интервали 0,75–9,56), съгласно мета-анализ на седем проучвания, включващи повече от 3000 пациенти [33]. Въпреки че на пръв поглед интуитивен, клиничният отговор не може да бъде единичен метод за проследяване на придържането към GFD, тъй като голям брой пациенти с целиакия са безсимптомни или минимално симптоматични при представяне и в тези случаи не би било възможно да се използва клиничен отговор като показател за лигавицата изцеление и спазване на GFD [34]. Контролирано проучване, изследващо ефектите на глутеновото предизвикателство, установява, че симптомите липсват при 22% от пациентите с целиакия, въпреки наличието на значителна вилозна атрофия в биопсията на тънките черва [35].
2.2. Валидирани проучвания и диетични интервюта
Диетологът или специалистът е отговорен за диетичния преглед. В допълнение към редица въпросници, оценяващи честотата на хранене и самоотчетеното придържане към GFD, има визуална аналогова скала за оценка, която се състои от немаркиран ред с изреченията на котвата "Никога не се придържам към диетата си" и "Винаги се придържам към диетата 'във всеки край [36,37,38,39,40,41]. Независимо от това няма наличен контрол или стандарт за качество за диетичен преглед поради местните диети и навици, насочени към конкретно структурирано интервю, свързано с качеството на диетата. Към днешна дата липсват проучвания за резултатите от прегледа на GFD в различни страни и няма доказателства, че подходящият преглед може да замени други инструменти (например биопсия) за прогнозиране на увреждане на лигавицата. Освен това хората са склонни да докладват неточно нивото си на придържане, независимо дали умишлено или не, така че диетичният преглед може да бъде субективен и да не идентифицира неволни нарушения [42,43].
2.3. Биопсии
Класификации, основани на обективни количествени морфологични параметри, като измервания на съотношението височина-крипта-дълбочина и възпалителни променливи, като плътността на IEL с подходящ протокол, са добре дошли. Taavela et al. [53] оцени тези количествени морфологични и възпалителни променливи при оценката на различни степени на увреждане, за да осигури гранични стойности, които да се използват в рутинната клинична практика в CD. Подтипирането на IELs чрез хистологични и имунологични изследвания и използването на поточна цитометрия и/или имунохистохимия за изследване на IELs е посочено, че е от първостепенно значение при диагностицирането и проследяването на CD [54,55,56] . Съотношението на горната нормална граница на IEL в проксималното тънко черво, използвано като критерий от класификацията на Марш-Оберхубер за чувствителност към глутен, е установено при 40 IEL на 100 епителни клетки (ЕК) [57]. Неотдавнашни проучвания обаче наблюдават, че горната нормална граница в проксималното тънко черво е толкова ниска, колкото 20 IEL/100 EC на върховете на пет власинки на оцветени с хематоксилин-еозин участъци и 25 IEL/100 EC с имунохистохимия, като се използват по-тънко нарязани участъци от 3 µm и 4 µm и CD3 имунохистохимия [58].
Въпреки че използването на ендоскопии за събиране на биопсии и оценка на заздравяването на лигавицата е златният стандарт, това е инвазивна, скъпа и непрактична процедура за често наблюдение на активността или тежестта на заболяването [59]. Има част от случаите, които е трудно да се наблюдават и оценяват с биопсия, тъй като те имат леки хистологични промени или липсва съгласуваност между серологията и хистологията. Следователно идеята за преоценка на акцента върху биопсията като златен стандарт при проследяването на CD, в светлината на наличните по-малко инвазивни тестове, е приветлива. Съобщава се, че пълното възстановяване на лигавицата на дванадесетопръстника се простира в продължение на една година, като IELs често се появяват дори 2–5 години след целиакия [60]. Някои експерти не извършват рутинно проследяваща биопсия при асимптоматични пациенти с отрицателна серология и добро придържане [61]. Въпреки това, възпаление на чревната лигавица може да възникне много преди развитието на клинични признаци или повишаване на титрите на антителата след предизвикателство на глутен. От друга страна, при пациенти с NRCD с липса на клиничен отговор на строга GFD трябва да се наложи повторна биопсия и допълнителни изследвания [62]. Следователно няма консенсус относно ролята на последващите биопсии [18,44].
2.4. Серологични тестове
2.5. Други маркери
Други проучвания предлагат като подходящи маркери за проследяване на диетата теста за пропускливост, фекален калпротектин, REG Iα или наскоро плазмени общи алкилрезорциноли [71,72,73,74]. Няколко проучвания обаче съобщават, че тези тестове са не само специфични за CD, но и с ограничена ефикасност при диагностицирането на неусложнен CD [75,76,77]. Други два маркера са чревно-мастно-киселинен свързващ протеин (I-FABP), маркер, отразяващ увреждането на ентероцитите, и цитрулин, маркер за функционална ентероцитна маса [64], но те не са специфични за CD, така че не правят разлика между рецидив на целиакия или други стомашно-чревни нарушения при пациента.
Автоантитела срещу секреторно-грануларен панкреасен мембранен гликопротеин 2 (GP2), особено на IgA изотип, са демонстрирани при пациенти с болест на Crohn, а наскоро и с CD. При пациенти с CD с положителна анти-GP2 антитела този маркер може да се използва като индикатор за чревно възпаление и за проследяване. CD обаче трябва да се диференцира от болестта на Crohn чрез паралелно тестване на CD-специфична EMA или anti-tTG [78,79].
Наскоро Ryan et al. [80] направи преглед на метаболомиката, свързана с диагнозата и прогнозата в CD като важен потенциален инструмент. Идентифицирането на три основни компонента (малабсорбция, енергиен метаболизъм и промени в чревната микробиота) в матрици, като серуми, урина и изпражнения, е от особен интерес за метаболома на CD. Различни съединения, свързани с малабсорбцията (намалени нива на аминокиселини, липиди, пируват и холин в серумите на пациенти с целиакия), други компоненти са свързани с енергийния метаболизъм (по-високи нива на глюкоза и 3-хидроксимаслена киселина в серумите) и, трето, тези, свързани с промени в чревната микробиота и/или чревна пропускливост като по-високи нива на индоксил сулфат, мета- [хидроксифенил] пропионова киселина и фенилацетилглицин в урини [81,82].
2.6. Откриване на глутенови имуногенни пептиди (GIP)
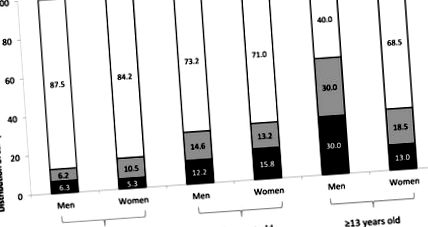
Процентно разпределение на пациентите с целиакия по съдържание на GIP във фекалиите по възраст и пол. GIP, глутенови имуногенни пептиди. GIP положителен (> 0.30 µg GIP/g изпражнения, черна лента), слабо положителен (0.16–0.30 µg GIP/g изпражнения, сив стълб) и отрицателен (25 mg, съответстващ на долната граница за нанасяне на щети на повечето пациенти с целиакия. GIP са открити в проби от урина 6–48 часа след прием на глутен.Методологията демонстрира високо ниво на несъответствие при пациенти с CD, които предполагаемо са консумирали дългосрочно GFD чрез наличие на GIP (съответно 48% и 45% при възрастни и деца Тези резултати бяха в съответствие с докладите, показващи това
30% –50% продължават с атрофия на лигавицата при пациенти с CD, въпреки спазването на GFD [5,104,105,106]. По-интересното е, че е доказана пряка връзка между липсата на GIP в урината и зарастването на чревния чревен епител (Фигура 2). Освен това, 100% от възрастните пациенти с по-голямо увреждане на епитела (Marsh II/III), според хистологичния анализ, са имали GIP в урината. В съответствие с други гореспоменати проучвания [34,67,85], това проучване потвърждава лошата корелация на серологичните тестове със заздравяването на лигавицата, както и недостатъците на въпросниците с диетична история за оценка на спазването на GFD.
Наличие на GIP в урината при възрастни пациенти с CD и корелация с тяхната хистология на тънките черва. Тежест на лезията на лигавицата (Марш I – III) и хистологичен вид, определени от скалата на Марш. GIP отрицателен (бяла лента), липса на GIP в урината; GIP слабо положителен (сива лента), визуално присъствие на GIP, което не може да се измери количествено в урината (> LDT QL). p = 0,0007 (точен тест на Фишър). Стойностите се изразяват като процент на пациентите. CD, целиакия; GIP, глутенови имуногенни пептиди; LDT, граница на откриване на техника; QL, граница за количествено определяне. Модифицирано съгласно Moreno et al. [103].
Разработването на устройства за точкова грижа за точен, прост и ефективен GFD мониторинг мотивира създаването на високочувствителния повърхностен плазмонен резонансен биосензор за откриване на GIP в урината [107]. Лесните за боравене проби, като урина и лесни за употреба биосензори, биха могли да бъдат подходящи за преносимите и прости устройства за съответствие с GFD на пациентите с целиакия. Soler и сътр. [107] демонстрира, че сензорната методология позволява бързо и без етикети количествено определяне на GIP в урината чрез използване на G12 moAb, достигайки граница на откриване от 0,33 ng/ml. Това проучване също така ясно различава потребителите на глутен от не-потребителите, като измерва няколко проби от урина както от здрави (нормална диета), така и от целиакия (GFD). Следователно биосензорите предлагат значителни предимства пред конвенционалните техники, позволяващи биохимичен анализ с отлична възпроизводимост и висока чувствителност за броени минути.
3. Заключения и бъдещи указания
Благодарности
IC беше подкрепен от Contrato de Acceso al Sistema Español de Ciencia, Tecnología e Innovación para el Desarrollo del Programa Propio de I + D + i от Universidad de Sevilla. MLM беше подкрепен от Contrato Postdoktors, свързан с Proyecto de Investigación de Excelencia от Junta de Andalucía. Тази работа беше подкрепена от безвъзмездни средства от Ministerio de Ciencia, Economía y Competitividad (AGL2013-48946-C3-2-R) и фондове FEDER, Corporación Tecnológica de Andalucía (Junta de Andalucía), Agencia IDEA и Asociación de Celíacos y Sensibles al gluten de Мадрид (Испания).
Принос на автора
Всички автори допринесоха за подготовката на тази рецензионна статия.
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Аутизъм и диета без глутен; Подкаст на канадски целиакия
- 7-дневна експресна диета без глутен от Гейл Джонсън
- Диета за премахване на алергия от мляко и соя Факти за здравето и храненето за пациентите ви; Семейства
- 11 безглутенови стимула да използвате този хранителен план Готварска лека диета
- Здравословна диета и упражнения за обратен диабет при над 60% от пациентите