Xinguo Jiang
1 VA Palo Alto Health Care System, Пало Алто, Калифорния, САЩ
2 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния, САЩ
Уен Тиан
1 VA Palo Alto Health Care System, Пало Алто, Калифорния, САЩ
2 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния, САЩ
Марк Р. Николс
1 VA Palo Alto Health Care System, Пало Алто, Калифорния, САЩ
2 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния, САЩ
Стенли Г. Роксън
2 Катедра по медицина, Медицински факултет на Станфордския университет, Станфорд, Калифорния, САЩ
Резюме
Затлъстяването, инсулиновата резистентност, дислипидемията и хипертонията са основните клинични прояви на метаболитния синдром. Проучванията през последните няколко десетилетия включват хронично възпаление и ремоделиране на микросъдовете в развитието на затлъстяване и инсулинова резистентност. Новите наблюдения обаче предполагат, че нарушаването на регулацията на лимфната система е в основата на развитието на метаболитния синдром. Този преглед обобщава последните постижения в тази област, обсъждайки как лимфната аномалия насърчава затлъстяването и инсулиновата резистентност и, обратно, как метаболитният синдром уврежда лимфната функция. Ние също обсъждаме лимфната биология при метаболитно нерегулирани заболявания, включително диабет тип 2, атеросклероза и миокарден инфаркт.
Въведение
Затлъстяването, характеризиращо се с повишено съхранение на мастни киселини в разширените мастни тъкани, се превръща в основен здравословен проблем в съвременното общество, тъй като хората все повече възприемат относително заседнал начин на живот. Хроничният статус на затлъстяване предразполага индивидите към развитието на метаболитния синдром и увеличава честотата на диабет тип 2 (T2D) и сърдечно-съдови заболявания (Kahn and Flier, 2000; O'Neill и O'Driscoll, 2015; Catrysse и van Loo, 2017 ). Дисрегулираният липиден метаболизъм и нискостепенното хронично възпаление са сред забележителните патологии в затлъстялата мастна тъкан (Ruotolo and Howard, 2002; Konner and Bruning, 2011). Съвсем наскоро има все повече доказателства, че дисфункцията на лимфната васкулатура участва в патогенезата на затлъстяването и свързаната със затлъстяването дислипидемия и нискостепенно хронично възпаление (Harvey et al., 2005; Aspelund et al., 2016), вероятно защото лимфната система е важна за имунната хомеостаза и липидния транспорт (Jiang et al., 2018). Този преглед предоставя преглед на взаимодействието между функцията на лимфната система и наличието на затлъстяване и инсулинова резистентност. Също така обсъждаме как лимфната система може да бъде използвана за лечение на T2D и сърдечно-съдови заболявания, свързани със затлъстяването и инсулиновата резистентност.
Лимфната система
Лимфна структура
Ранно лимфно развитие и лимфангиогенеза
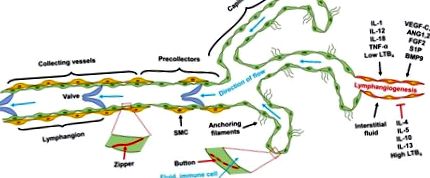
След първоначалното поникване, лимфните капиляри узряват чрез активиране на сигналния път на Notch (Zheng et al., 2011), наподобяващ добре известната парадигма на клетъчните връхчета в ангиогенезата (Potente et al., 2011). Зреенето на събирането на лимфните съдове изисква съгласувано набиране и моделиране на гладкомускулни клетки, както и развитие на клапата. Въпреки че ангиопоетинът (ANG) 2 антагонизира активирането на TIE2 рецепторите по време на кръвната ангиогенеза, изглежда стимулира сигнализирането на TIE2 в LECs и насърчава постнаталното лимфно ремоделиране (Gale et al., 2007); ANG2-дефицитни мишки не развиват нормална йерархична лимфна съдова система (Dellinger et al., 2008). Протеинът на виличната кутия FOXC2 модулира развитието на лимфните капиляри, като контролира набирането на SMC и образуването на базална мембрана (Petrova et al., 2004). В координация с Prox-1, FOXC2 усеща лимфния поток и индуцира експресията на белтъчно свързващ протеин коннексин 37 (Cx37) и активира сигнализирането на калциневрин/ядрен фактор на активирани Т-клетки (NFAT), който регулира образуването на лимфни клапи (Sabine et al., 2012). Докато FOXC2 контролира експресията на ANG2 в ангиогенезата (Xue et al., 2008), той индуцира TIE2 в LECs (Thomson et al., 2014), което предполага, че FOXC2 може да стимулира лимфното съзряване чрез регулиране на сигнализирането на ANG2/TIE2.
Други сигнални пътища, включително фибробластен растежен фактор (FGF) 2/FGF рецептор (FGFR) 1, сфингозин-1-фосфат (S1P)/S1P рецептор (S1PR) 1 и костен морфогенетичен протеин (BMP) 9/актинов рецептор-подобна киназа 1 (ALK1), също регулират лимфангиогенезата (Zheng et al., 2014). Освен това провъзпалителните цитокини влияят върху лимфангиогенезата и влияят върху имунната активация и разделителна способност. По принцип цитокините тип 1, включително IL-1, IL12, IL-18 и TNF-α, насърчават, а тип 2 и противовъзпалителните цитокини като IL-4, IL-5, IL13 и IL-10 потискат лимфангиогенезата ( Sainz-Jaspeado и Claesson-Welsh, 2018). Провъзпалителната липидна молекула левкотриен В4 (LTB4) насърчава лимфната регенерация при ниска концентрация, но потиска лимфангиогенезата при високи патологични концентрации (Tian et al., 2017). В обобщение, лимфангиогенезата се регулира от растежни фактори и цитокини, както и от потока на интерстициалната течност (Фигура 1).
Взаимодействието между лимфната васкулатура и затлъстяването
Лимфната васкулатура регулира както диетичната абсорбция на липиди, така и периферното отстраняване на холестерола. Чревните лактали са лимфни съдове, съставени както от капилярни, така и от събиращи лимфни елементи. Лактатите абсорбират хранителни липиди, опаковани като хиломикрони (Iqbal и Hussain, 2009; Randolph and Miller, 2014). Интравиталното изобразяване показва, че лакталите притежават спонтанна контрактилна черта; те активно абсорбират и транспортират обработени от ентероцити липиди до системната циркулация в съгласие с контрактилни сили, произведени от съседни гладкомускулни клетки, контролирани от автономната нервна система (Choe et al., 2015). Наскоро беше разкрито, че лактеалната функция контролира диетичната абсорбция на липиди и следователно телесното тегло, подкрепяйки концепцията, че лакталите са вратари на приема на липиди от околната среда (McDonald, 2018; Zhang et al., 2018; Cifarelli and Eichmann, 2019 ).
В периферните тъкани лимфната васкулатура обикновено се счита за единствения път за връщане на липопротеина в кръвообращението (Cooke et al., 2004); отстраняването на интерстициалния холестерол по лимфен път е известно като обратен транспорт на холестерол (RCT) (Huang et al., 2015). Въпреки че както лакталите, така и периферните лимфати могат да поемат селективно товари въз основа на техния размер (Randolph and Miller, 2014), те могат за предпочитане да абсорбират липопротеини в зависимост от специфичната рецепторна експресия. Като пример, LEC експресията на рецептора на чистач тип B тип I (SR-B1) е необходима за RCT в кожни лимфни капиляри, но не и за абсорбция на холестерол в червата (Bura et al., 2013; Lim et al., 2013). Нарушено RCT е наблюдавано при ob/ob мишки с индуцирано затлъстяване (Duong et al., 2018), което предполага, че дефектният RCT може да бъде предпоставка за развитието на затлъстяване.
Лимфна ендотелна клетъчна инсулинова резистентност
Обобщение на функцията на инсулиновата сигнализация в метаболитните органи и LECs. Инсулиновата сигнализация в черния дроб стимулира синтеза на гликоген, липиди и протеини, докато намалява производството на глюкоза. В скелетните мускули инсулинът медиира усвояването на глюкозата и синтеза на гликоген. В бялата мастна тъкан инсулинът потиска липолизата и насърчава усвояването на глюкозата. Инсулиновото активиране на неговия рецептор в LECs насърчава активността на eNOS, която поддържа нормална лимфна структура и насърчава лимфангиогенезата. WAT, бяла мастна тъкан; LEC, лимфна ендотелна клетка; eNOS, ендотелна синтаза на азотен оксид.
Лимфна съдова патофизиология при T2D
Едно често усложнение на диабета е диабетната ретинопатия, която се характеризира с патология, която включва съдови, глиални и невронални компоненти и причинява значителна загуба на зрението (Duh et al., 2017). Неотдавнашно проучване, изследващо лимфната система при диабетна ретинопатия, откри експресията на LEC маркери, като VEGFR3 и Prox-1, в изрязани човешки образци (Loukovaara et al., 2015), предоставяйки първите клинични доказателства, че анормален лимфен растеж, в допълнение към патологично микроваскуларно ремоделиране, възниква при диабетна ретинопатия. Последващо проучване показа, че разтворимите про-растежни фактори в течността на стъкловидното тяло насърчават лимфното покълване на тъкани, получени от пациента, с диабетна ретинопатия (Gucciardo et al., 2018a), като допълнително подкрепя схващането, че микросредата на очите на диабетната ретинопатия съдържа достатъчно знак за необичайно разширяване на лимфата. Следователно патологичната лимфангиогенеза, наблюдавана в очите на диабетната ретинопатия, може да се разглежда като характеристика за терапевтично насочване (Yang et al., 2016; Gucciardo et al., 2018b). Текущите клинични изпитвания, насочени към VEGFR или RTK-медиирано сигнализиране, могат да предоставят възможности за потискане на патологичния лимфен свръхрастеж, но идентифицирането на нови лимфни специфични цели е вероятно необходимо за по-добри терапевтични резултати (Williams et al., 2010).
Лимфатика при атеросклероза и миокарден инфаркт
Лимфните съдове присъстват в адвентициалните и периадвентициалните региони на артериалните стени (Sacchi et al., 1990; Martel et al., 2013; Milasan et al., 2015). Ранните наблюдения, които свързват намаления лимфен дренаж с атеросклерозата, са съобщени преди близо три десетилетия (Miller et al., 1992; Solti et al., 1994). Използвайки модел за трансплантация на аорта на мишка, лимфната васкулатура се оказа критична за RCT в артериалната стена на големия съд (Martel et al., 2013). Друго проучване демонстрира, че мишките, хранени с HFD, са склонни към образуване на атерома, когато лимфната васкулатура е дефектна (Vuorio et al., 2014), подкрепяйки схващането, че лимфната дисфункция намалява отстраняването на холестерола и насърчава атеросклерозата. При предразположен към атеросклероза Ldlr -/-; АпоВ100 +/+ мишки, лимфната дисфункция, главно на събиращите лимфни съдове, се появява преди началото и по време на прогресията на атеросклерозата (Milasan et al., 2016), което предполага, че лимфните съдови аномалии вероятно насърчават атеросклерозата. В съгласие с тези хипотези, спасяването на лимфната васкулатура по време на ранната фаза на атерогенезата забавя прогресирането на заболяването, чрез намаляване на възпалението на тъканите и, вероятно също чрез увеличен транспорт на лимфен холестерол (Milasan et al., 2019). Тези проучвания в съвкупност свързват лимфната съдова функционалност с патогенезата на атеросклерозата.
Заключителни бележки
Диабет тип 2 и сърдечно-съдови заболявания, свързани със затлъстяването, са водещата причина за смърт в развития свят (Benjamin et al., 2019). Има неудовлетворена необходимост от подобряване на медицинските грижи за тези пациенти. Нашето разбиране за механизмите, лежащи в основата на тези заболявания, значително нарасна, но остава непълно. Насърчаването на лимфната функция има очевидния капацитет да намали патологията при модели на предклинично затлъстяване и сърдечно-съдови заболявания. Поради това е спешно необходимо по-задълбочено проучване на лимфната биология. Откритията, произтичащи от тези изследвания, вероятно ще осигурят нови терапевтични цели и ще подобрят оцеляването на заболяването.
Принос на автора
XJ допринесе за писането и редактирането на ръкописа и създаването на фигури. WT и MN допринесоха за концепциите и редактирането на ръкописа. SR допринесе за концепциите, редактирането и окончателното форматиране на ръкописа.
Конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Лимфната система при затлъстяване, инсулинова резистентност и сърдечно-съдови заболявания - лимфедем
- Развитието на затлъстяването, управлявано от чревните бактерии - Резюме - Храносмилателни заболявания 2016, бр
- Разкриване на временния модел на индуцирана от диетата инсулинова резистентност в отделни органи и сърдечни
- Лимфната система Вашата имунна система и Detox Hero; Уелнес на Ан Лимонс
- Лимфната васкулатура неговата роля в мастния метаболизъм и затлъстяването - ScienceDirect