От Изследователската група по хиперлипидемия и атеросклероза, Институт за клинични изследвания в Монреал, Монреал, Квебек, Канада.
Резюме
Плейотропните ефекти на лекарството са действия, различни от тези, за които агентът е специално разработен. Тези ефекти могат да бъдат свързани или несвързани с основния механизъм на действие на лекарството и обикновено не се очакват. Плейотропните ефекти могат да бъдат нежелани (като странични ефекти или токсичност), неутрални или, особено в случая с инхибиторите на HMG-CoA редуктазата (статини), да са от полза. Плейотропните ефекти на статините включват подобряване на ендотелната дисфункция, повишена бионаличност на азотен оксид, антиоксидантни свойства, инхибиране на възпалителните реакции и стабилизиране на атеросклеротичните плаки. Тези и няколко други нововъзникващи свойства могат да действат в съгласие с мощните липопротеинови понижаващи холестерола ефекти на статините, които да упражняват както ранни, така и трайни сърдечно-съдови защитни ефекти. Разбирането на плейотропните ефекти на статините е важно за оптимизиране на тяхното използване при лечение и профилактика на сърдечно-съдови заболявания.
Тъй като инхибиторите на HMG-CoA редуктазата (статините) стават все по-широко използвани при по-голям брой пациенти, техните ефекти след понижаване на липидите започват да се проявяват. Такива плейотропни ефекти включват подобряване на ендотелната дисфункция, повишена бионаличност на азотен оксид, антиоксидантни ефекти, противовъзпалителни свойства и стабилизация на атеросклеротичните плаки. Допълнителните ефекти от нарастващ интерес включват способността за набиране на ендотелни прогениторни клетки (EPC), предполагаема имуносупресивна активност и инхибиране на сърдечната хипертрофия. Изследванията показват, че някои от плейотропните ефекти на статините може да не са свързани с понижаващите холестерола свойства на лекарствата. Други дори могат да бъдат напълно отделени от инхибирането на HMG-CoA редуктазата и много от тях се извършват при много ниски концентрации на лекарството. Този преглед се фокусира върху ефектите, които имат особено значение за сърдечно-съдовата система. Разбирането на пълния спектър от ползи, свързани със статиновата терапия, може да позволи по-добро терапевтично приложение и да насърчи ранното използване на статини при остри коронарни синдроми.
Подобряване на ендотелната дисфункция
Ендотелното увреждане допринася за започване на атерогенния процес. Ендотелната дисфункция, ранна проява на такова увреждане, е свързана с парадоксална вазоконстрикция към ацетилхолин поради нарушен синтез, освобождаване и активност на произведен от ендотел азотен оксид (NO). Анормални ендотелни-зависими вазомоторни отговори предсказват дългосрочната прогресия на атеросклерозата и свързаните с нея коронарни събития, както и събития скоро след съдова операция. 1,2 Следователно не е изненадващо, че добре установената способност на статините да подобряват ендотелната дисфункция, клас ефект, получи голямо внимание през последните години.
Нормализирана вазомоция
Доказано е, че краткосрочното лечение със статини подобрява ендотелната дисфункция и увеличава миокардната перфузия. При пациенти с хиперхолестеролемия с перфузионни аномалии, например, лечението с флувастатин (40 до 80 mg/d) в продължение на 6 до 12 седмици значително повишава миокардната перфузия в исхемични сегменти (30%; P 3 При пациенти с умерено повишени нива на холестерол (6,2 до 7,5 mmol/L), лечение със симвастатин 20 mg/d, в сравнение с плацебо, значително (P 4 След допълнителни 3 месеца лечение, подобрението в групата на симвастатин е значително (P 5 в сравнение с аторвастатин 10 mg/ден плюс диетична терапия само с диетична терапия при жени в постменопауза с хиперхолестеролемия. Значително подобрение на вазореактивността на брахиалната артерия се наблюдава още 2 седмици след началото на лечението с аторвастатин в сравнение с диетичната терапия (P 5 Наблюдава се само слаба корелация между нивото на намаляване на холестерола с аторвастатин и подобрението на вазореактивността. 5 Всъщност, малко проучване при здрави млади мъже с нормална холестеролемия показва подобрена ендотелна функция в рамките на 24 часа от лечението с аторвастатин 80 mg и бързо увреждане при отнемане на статини след 30 дни. 6 Ефектът е настъпил преди нивата на серумен холестерол и високочувствителният С-реактивен протеин (hsCRP) да бъдат намалени след 2 дни лечение. Тези открития подкрепят виждането, че статините могат да упражняват благоприятни ефекти върху ендотелната дисфункция, които са независими от степента на понижаване на холестерола в плазмата.
Дългосрочната терапия със статини също подобрява ендотелната функция при пациенти с атеросклероза. Само диета, режим на понижаване на липопротеините с ниска плътност (LDL) (ловастатин и холестирамин) и режим на понижаване на LDL плюс антиоксидант (ловастатин и пробукол) са тествани в продължение на 1 година върху индуцирана от ацетилхолин вазоконстрикция в епикардни коронарни артерии. 7 Най-голямото подобрение във вазоконстрикторния отговор е наблюдавано в LDL-понижаващата антиоксидантна група (P= 0,01).
Изследва се дали терапията със статини има подобен благоприятен ефект върху ендотел-зависимата вазодилатация при захарен диабет. Последните проучвания със симвастатин и аторвастатин не показват влияние на терапията със статини върху ендотелиум-зависимата вазодилатация при диабет тип 2. 8,9 Обаче, друго проучване с аторвастатин при диабет тип 2 демонстрира значително подобрение в ендотел-зависимата вазодилатация. 10 Подобна находка е съобщена при аторвастатин при млади пациенти с диабет тип 1 и нормални нива на холестерол. 11 Противоречивите резултати, получени в тези проучвания, може да се дължат на разлики в дозировката на статините, дизайна на проучването, подбора на пациента, съпътстващите лекарства и технологията, използвана за измерване на ендотелната функция.
Повишена бионаличност на азотен оксид
Статините подобряват ендотелната дисфункция отчасти чрез понижаване на LDL-холестерола; по-конкретно, доказано е, че те предотвратяват понижаването на регулацията на ендотелната азотно-оксидна синтаза (eNOS), ензимът, който катализира образуването на NO от 1 -аргинин, чрез естествен LDL. 12 Намаляването на регулацията на eNOS може да бъде медиирано от способността на LDL да повишава нивата на кавеолин-1, основен инхибитор на активността на eNOS. 13
Статините също подобряват директно конститутивната активност на eNOS, като по този начин увеличават бионаличността на NO. 14 Могат да бъдат включени няколко механизма, включително намаляване на изобилието на кавеолин-1 и увеличаване на Hsp90, който действа като молекулярен шаперон за улесняване на дългосрочното активиране на eNOS. 13 Други механизми включват стабилизация на eNOS пратеник РНК 15 и намалено производство на реактивни кислородни видове, които инактивират NO. 16 Статините също така пречат на пренилирането на Rho GTPase от геранилгеранил пирофосфат (GGPP), предотвратявайки транслокацията му в клетъчната мембрана, където той отрицателно регулира активността на eNOS. 17
Пътеката PI3-киназа/Akt също участва в регулацията на NO. Установено е, че статините активират серин/треонин киназа Akt (протеин киназа В) в ендотелните клетки, като по този начин засилват фосфорилирането на ендогенния Akt субстрат eNOS и предизвикват увеличаване на NO. 18.
Антиоксидантни ефекти
Неуспехът на антиоксидантите да предотвратят коронарна артериална болест в последните проучвания 19 не обезсилва теорията за окисляване на атеросклерозата. Липсата на полза може да се дължи на неадекватно дозиране, продължителност на лечението или тип антиоксидант. 20 Освен това може да се наложи да се измести акцентът към остри събития и ранни ефекти или да се обърне повече внимание на взаимодействието на оксидативен стрес и възпаление в атерогенезата. С оглед на централната роля, която окисленият LDL играе в атерогенезата, установеният антиоксидантен ефект на терапията със статини е от голям интерес.
В допълнение към обръщането на инхибиторния ефект на окисления LDL върху eNOS, статините имат и директни антиоксидантни ефекти върху LDL in vitro и ex vivo. 21,22 Хидрокси метаболити на аторвастатин, но не и основното съединение, инхибират окисляването както на LDL, така и на липопротеини с много ниска плътност, както и на липопротеини с висока плътност. 23 В допълнение, хидрокси метаболитите, представляващи 70% от активния аторвастатин в плазмата, демонстрират способността да изчистват свободните радикали, които могат да допринесат за инхибиране на окисляването на липопротеините. Статините могат също така косвено да повлияят на нормалните окислителни механизми, като ограничат способността на макрофагите да окисляват липопротеините. Доказано е също така, че статините намаляват активността на макрофага CD36, признат рецептор за окислен LDL. 25 Механизмът на този ефект се разследва.
Противовъзпалителни ефекти
През последното десетилетие стана ясно значението на възпалението за развитието на атеросклероза. Повишените нива на маркери за възпаление като CRP, интерлевкин-6, междуклетъчна адхезионна молекула-1 (ICAM-1) и серумен амилоид А (SAA) са свързани с повишен риск от първи и повтарящи се сърдечно-съдови събития. 27,28 нива на CRP, особено, изглежда са сред най-мощните предсказатели за бъдещи събития.
Намаляване на серумния CRP
Понастоящем има убедителни доказателства, че терапията със статини може да отслаби ефекта на възпалението върху риска от сърдечно-съдови събития. Сред 708 пациенти след инфаркт в проучването за холестерол и повтарящи се събития (CARE), 27 пациенти с повишени нива на CRP и SAA (> 90-ти персентил) са имали по-висок риск и са се възползвали повече от терапията с правастатин 40 mg/ден от тези без повишени нива на тези възпалителни маркери. 27 Относителният риск от повтарящи се коронарни събития е намален съответно с 54% и 25% при 2-те групи в сравнение с плацебо. 27 На изходно ниво и двете подгрупи имат почти идентични плазмени липидни и липопротеинови профили.
Дългосрочната терапия с правастатин в проучването CARE също намалява нивата на CRP при пациенти след инфаркт. 29 Въпреки че средните нива на CRP за активно лечение и плацебо са сходни, средното ниво след 5 години е с 21,6% по-ниско в групата на правастатин, отколкото в групата на плацебо (P= 0,007). Промяната в нивата на CRP, свързана с лечението с правастатин, не е свързана с намаляването на нивата на LDL-холестерол. Последната констатация е потвърдена в скорошното 24-седмично проспективно проучване за възпаление на Pravastatin/CRP Evaluation (PRINCE). 30
6-седмично тройно кръстосано проучване сравнява ефекта на терапията с правастатин, симвастатин и аторвастатин върху нивата на hs-CRP при пациенти с комбинирана хиперлипидемия. 31 И трите лекарства при дози, за които се съобщава, че имат еквивалентни ефекти върху LDL-холестерола, значително намаляват средните нива на hs-CRP (правастатин с 20%, симвастатин с 23% и аторвастатин с 28%; фигура) и тези намаления не корелират с намаляване на LDL-холестерола. Това проучване е в контраст с отрицателния резултат от подобно сравнение, използвайки паралелен дизайн и 3-месечна експозиция с по-малък брой участници във всяка подгрупа. 32 В проучването Atorvastatin срещу Simvastatin при прогресия на атеросклероза (ASAP), агресивната терапия със статини (аторвастатин 80 mg) намалява нивата на CRP в по-голяма степен от конвенционалната терапия (симвастатин 40 mg). 33 Освен това е установена значителна корелация при еднофакторния анализ между намаляването на CRP и намаляването на дебелината на интимата (IMT) на сегментите на каротидната артерия. 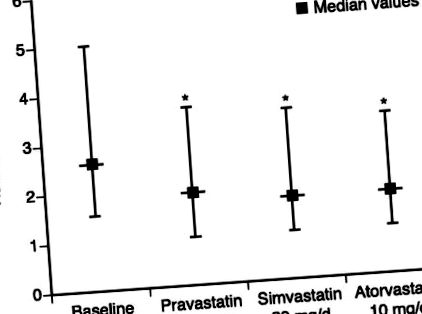
Ефект от терапията със статини върху нивата на високочувствителен С-реактивен протеин (hs-CRP). Данните са представени като 25-и персентил, медиана и 75-и персентил. *P
Неотдавнашно проучване показа, че симвастатин понижава CRP в рамките на 14 дни, 34 независимо от намаляването на LDL-холестерола. Бързото намаляване на нивата на CRP със статини може да обясни отчасти ранните полезни ефекти на тези лекарства при остри коронарни синдроми. 35
Намаляване на адхезионните молекули
Молекулите на адхезията и хемоаттрактантите играят важна роля в възпалителния процес. 36 Те медиират адхезията и трансмиграцията на левкоцитите към субендотела като част от атерогенния процес. Човек може да измери разтворими форми на адхезионни молекули в плазмата или да изследва тяхното взаимодействие in vitro с възпалителни клетъчни интегрини.
Статините изглежда намаляват адхезията и хемотаксичните молекули и инхибират интегриновата активност. Проучванията обаче дадоха противоречиви резултати. Агресивна понижаваща липидите терапия със симвастатин и аторвастатин е свързана с намаляване на разтворимия Е-селектин, но не разтворима молекула на адхезия на съдови клетки (VCAM) или разтворим ICAM в ранно неконтролирано проучване. 37 Наскоро беше установено, че аторвастатин и симвастатин понижават значително разтворимия Е-селектин, Р-селектин и ICAM-1, но симвастатинът повишава разтворимия VCAM-1. 38 Друго скорошно сравнение на аторвастатин и симвастатин във високи дози обаче показва само малки и противоречиви ефекти на двете лекарства върху нивата на ICAM-1. 39 Терапия с флувастатин при пациенти с хиперхолестеролемия намалява циркулиращите нива на Р-селектин и ICAM-1; този ефект изглежда е независим от понижаващия липидите ефект. 14 Важно скорошно проучване демонстрира, че модифициран статин без инхибиторен ефект върху HMG-CoA редуктазата може да има мощен и селективен директен противовъзпалителен ефект. 40 Това откритие доказва, че статин-плейотропният ефект може да бъде напълно отделен от инхибирането на синтеза на холестерол.
Стабилизиране на плаката
Няколко механизма биха могли да обяснят стабилизиращия плаката ефект на статините, който беше елегантно демонстриран при животински модели. 41 Намаляването на LDL-холестерола може да допринесе за намаляване на липидната сърцевина. 42 Статините инхибират поглъщането на окислени LDL от CD36, 43 потискащ рецептор А, 44 и лектиноподобни окислени LDL (LOX-1) рецептори 45 и инхибират окислителните свойства на макрофагите. 24 Тези ефекти на статините теоретично биха могли да допринесат за намалено образуване на пяна.
Доказано е, че повишените плазмени нива на няколко маркера на възпалителната каскада предсказват бъдещ риск от разкъсване на плаката. Тези маркери включват Р-селектин, интерлевкин-6, фактор на туморна некроза-α, разтворим ICAM-1 и CRP. 36 Полезният ефект на статините върху възпалителния процес е обсъден по-горе. Отслабването на влакнестата капачка при нестабилни плаки е свързано с повишено производство на матрични металопротеинази (ММР) от макрофаги. В култивирания макрофаг флувастатинът намалява активността на MMP-9 с 20% до 40%. 46 В проучване при хора, лечението с правастатин 47 променя състава на плаките на каротидната артерия по начин, който благоприятства стабилизирането. Пациентите със стеноза на каротидната артерия са получавали правастатин 40 mg/ден или никаква терапия в продължение на 3 месеца преди каротидна ендартеректомия. Плаките, отстранени от третираната със статини група, се състоят от значително по-малко липиди и окислени LDL, по-малко макрофаги и по-малко Т клетки. Те са имали по-високо съдържание на колаген и са демонстрирали по-малко MMP-2 имунореактивност от контролните плаки. В допълнение, апоптозата беше значително намалена и имунореактивността към тъканния инхибитор на металопротеиназа-1 (мощен инхибитор на ММР-1 и ММР-9) беше значително повишена в групата на правастатин в сравнение с контролите. 47
Допълнителни ефекти
Стимулиране на набирането на ендотелни прогениторни клетки
Ендотелните прогениторни клетки играят важна роля в възстановяването на исхемично увреждане. 48 Данни от in vitro и in vivo проучвания показват, че статините са поне толкова ефективни, колкото съдовия ендотелен растежен фактор, ключов цитокин в регулацията на неоваскуларизацията, за увеличаване на EPC диференциацията. 48 Доказателствата сочат, че статините повишават нивото на циркулиращите ЕРС и насърчават тяхното мобилизиране в исхемични области. 49 При пациенти с документирана стабилна коронарна артериална болест, лечението с аторвастатин 40 mg/d в продължение на 4 седмици е свързано с 1,5-кратно увеличение на броя на циркулиращите ЕРС през седмица 1, което се е увеличило до 3 пъти за периода от 4 седмици . 49 Лечението с аторвастатин стимулира диференцирането на подмножество от ендотелни клетки-предшественици в EPCs, вместо да увеличава общия брой циркулиращи хемопоетични стволови клетки. 49 В допълнение, аторвастатин значително подобрява миграцията на EPC в отговор на съдов ендотелен растежен фактор.
Понастоящем практическото значение на тези наблюдения може да изглежда отдалечено, но изглежда обещаващо, когато се вземе в контекста на скорошно проучване 50 в миши модел на миокарден инфаркт. Изследователите установиха, че ЕРС, мобилизирани от фактор на стволови клетки и от фактор, стимулиращ колонията на гранулоцитите, насочени към и частично поправили инфарктното сърце, намалявайки смъртността с 68% и подобрявайки миокардната функция.
Имуномодулация
Инхибиране на миокардната хипертрофия
Хипертрофия на лявата камера е рисков фактор за коронарна артериална болест и застойна сърдечна недостатъчност. Хипертрофия на кардиомиоцитни плъхове, предизвикана in vitro от ангиотензин II, е премахната от симвастатин. Сърдечната хипертрофия in vivo, индуцирана при плъхове или чрез инфузия на ангиотензин II (наличие на хипертония), или чрез трансаортална констрикция (липса на хипертония), също се инхибира от симвастатин (2 mg/kg/дневно за 4 седмици). 55 Тези открития допълват доказателствата, че статините упражняват защитен ефект върху органите, включително бъбреците 56 и панкреаса, 57,58 в допълнение към съдовата стена и сърцето.
Заключения
Въпреки че възможността статините да имат плейотропни ефекти първоначално беше посрещната със здравословен скептицизъм, огромното количество знания, натрупани през последните няколко години, премести тези ефекти в светлината на прожекторите. Много от статиновите плейотропни ефекти действат независимо от намаляването на LDL-холестерола, корелират слабо или изобщо с промените в LDL-холестерола, протичат бързо и са бързо обратими при прекратяване на лечението. Преки ефекти при липса на LDL или модификация на общия холестерол са показани както in vitro, така и in vivo. Плейотропните ефекти на статините и други лекарства са под непрекъснато разследване, за да се установи напълно тяхната роля в превенцията на сърдечно-съдови събития. Резултатите от няколко текущи клинични проучвания, насочени по-конкретно към плейотропни ефекти, трябва да ни просветлят относно тяхната относителна клинична значимост и значение.
- Благоприятни ефекти на ябълковия оцет върху управлението на теглото, индекса на висцералната адипозност и липидите
- Полезни ефекти от диетична интервенция за отслабване върху разнообразието на микробиомите на човешките черва и
- Асоциация между развода и рисковете за остър миокарден инфаркт, сърдечно-съдова циркулация
- Благоприятни ефекти на алтернативния хранителен режим върху чернодробно възпаление, атеросклероза и бъбреци
- Бананите са толкова полезни, колкото спортните напитки, предполага проучване - ScienceDaily
