Александър Е Березин 1,2 *
1 Частен медицински център „Вита-Център“, Запорожие, Украйна
2 Катедра по вътрешни болести, Държавен медицински университет, Запорожие, Украйна
* Автор-кореспондент: Александър Е Березин
Консултант на терапевтично звено
Отделение по вътрешни болести
Държавен медицински университет на ул. Седова 26
3, пр. Маяковски, Запорожие, Украйна
Тел: 380612894585
Имейл: [имейл защитен]
Дата на получаване: 02 февруари 2017 г .; Дата на приемане: 26 април 2017 г .; Дата на публикуване: 02 май 2017 г.
Цитат: Berezin AE (2017) Брой на циркулиращите апоптични ендотелни клетъчни микрочастици като предиктор за метаболитно нездравословно затлъстяване. J Mol Immunol 2: 109.
Посетете за още свързани статии на адрес Списание за молекулярна имунология
Резюме
Затлъстяването се счита за основен фактор, допринасящ за развитието на захарен диабет и за предиктор на СС заболяване и събития. Въз основа на критериите за панел за лечение на възрастни-III субектите с установено затлъстяване и съпътстващи други метаболитни аномалии, включително дислипидемия, инсулинова резистентност (IR), повишена глюкоза на гладно и нарушен глюкозен толеранс, се отнасят към метаболитно нездравословно затлъстяване (Met-UHO), докато затлъстяването лица без тези аномалии могат да бъдат определени като здравословно метаболитно затлъстяване (Met-HO). Механизмите, залегнали в основата на промяната във фенотипа от метаболитно здраво до метаболитно нездравословно затлъстяване, все още не са ясни. Предполага се, че получените от апоптотични микрочастици (EMPs) от ендотелни клетки могат да бъдат причинител на дисфункция на ендотелните клетки и също така медиатор за възстановяване на съдовете. Освен това дисбалансът в циркулиращия брой различни видове EMP може да повлияе на риска от трансформация на Met-HO в Met-UHO. Кратката комуникация е изобразена ролята на апоптотичните ЕМП в модификацията на фенотипа на затлъстяването.
Ключови думи
Метаболитно здравословно затлъстяване; Метаболитно нездравословно затлъстяване; Микрочастици, получени от ендотелни клетки; Инсулинова резистентност
Съкращения
EMP: микрочастици, получени от ендотелни клетки; ДДС: Висцерална мастна дисфункция; CV: Сърдечно-съдови; IR: инсулинова резистентност.
Въведение
Микрочастиците (MPs) са дефинирана хетерогенна подгрупа от извънклетъчни везикули със среден диаметър от 100 до 1000 nm, произхождащи от плазмените мембрани на клетките на майката [9]. Като производно на клетъчната мембрана MPs са обсъдени мощни паракринни регулатори на целевата клетъчна структура и функции. MP, освободен от апоптотични ендотелни клетки, притежават широк спектър от биологични ефекти върху междуклетъчната комуникация чрез прехвърляне на различни активни молекули (протеини, пептиди, хормони, растежни фактори, микроРНК), проявяващи коагулационна активност, медиираща клетъчния растеж и диференциация на тъканите [10]. В допълнение, апоптотичните ендотелни клетъчни MP (EMP) могат директно да влошат ендотелната цялост и съдовата функция, играейки ключова роля в развитието на микросъдово възпаление и IR [11].
Последните клинични проучвания показват, че циркулиращите нива на апоптотични EMP са значително увеличени при пациенти с T2DM в сравнение със здрави доброволци [12] и те медиират CV риск при пациенти с установен метаболитен синдром (MetS) и T2DM [13-15]. Вероятно апоптотичните EMPs могат да включват трансформацията на Met-HO в Met-UHO, определяща риска от T2DM и CV болест. Всъщност увеличеният брой на CD31 +/анексин V + и CD144 +/анексин V + EMPs е много по-точен, прогнозиран Met-UHO и тясно свързан с IR [16]. По този начин най-важният фактор, който влияе върху метаболитната дисрегулация при затлъстяване, е IR, който вероятно изглежда преобладаващо ранен стадий на Met-HO.
Има доказателства, че натрупването на висцерална тъкан на затлъстяване (ДДС) може да се свърже с свръхпроизводство на противовъзпалителни цитокини, включително hs-CRP, лептин и вистафин и да индуцира IR [17].
Следователно, инфилтрацията на суб-интимата от LDL холестерол може да предизвика производство на свободни радикали, окисление на цитоскелета и мембранна везикулация на ендотелните клетки. И накрая, мембранната везикулация на ендотелните клетки се засилва от възпалителни цитокини при предаване на натрупването на ДДС.
Интересното е, че броят на циркулиращите апоптотични EMP е добре свързан с конвенционалните биомаркери за затлъстяване (адипонектин, лептин, вистафин) при пациенти с Met-UHO, но не и при индивиди с Met-HO. В действителност, при пациенти с Met-HO не открихме тежки метаболитни аномалии освен повишаването на лептина в сравнение с Met-UHO, но IR беше определена като обща находка както за Met-UHO, така и за Met-HO индивиди без разлика в ИТМ.
Увеличеният размер на ДДС заедно с хронично възпаление и IR предразполага към развитие на ендотелна дисфункция чрез атенюиращ синтез и секреция на апоптотични EMP. Всъщност провъзпалителните цитокини, т.е. интерлевкин-6, туморният фактор некроза-алфа, лептин и вистафин, могат директно да повлияят на структурата на ендотелните клетки и да предизвикат секреция на апоптотични EMP [18-20]. Основната биологична функция на този процес е затихване на възстановяването на ендотелните клетки и възстановяване на съдовата функция [21]. За съжаление, съжителстващият IR засяга ендотелните прогениторни клетки и те не са в състояние да се диференцират във функционално зрели ендотелни клетки дори след стимулация от апоптотични EMP [22]. В резултат на това, апоптотичната ЕМ-индуцирана ендотелна дисфункция и IR могат да се превърнат в ранен предсказател за оформянето на Met-UHO.
Наскоро се съобщава, че апоптотичните EMP могат независимо да предсказват асимптоматична атеросклероза и CV болест при пациенти с T2DM [23], докато тяхната роля при индивиди с различни фенотипи на затлъстяването остава противоречива. Първо, не е ясно дали увеличеният брой на апоптотичните ЕМП е адаптивен механизъм за възстановяване на съдовете или фактор за увреждане на ендотелната тъкан. Всъщност циркулиращите EPM, които се засилват при голям брой метаболитни нарушения, включително коремно затлъстяване, свързани с IR и това е свързано с вредни ефекти върху ендотелните клетки [24,25]. В същото време апоптотичните ЕРМ са мощен фактор, допринасящ за мобинг и диференциация на ендотелни прогениторни клетки. Вторично, не е напълно разбрано вродените молекулярни механизми, които съответстват на тригерите за секреция на тези апоптотични депутати.
Апоптотичните MP като товарни микровезикули се състоят от различни биомолекули, включително регулирани протеини, ДНК, иРНК и некодираща РНК [23]. Делът на тези компоненти, както и на цял секретом, е под строг контрол на автокринни/паракринни механизми и възпалителни фактори (т.е. туморна некроза факторалфа, интерлевкин-2, -6), което предизвиква образуване на ЕМР по времезависим начин [9,10, 5]. Следователно, окончателният отговор на клетките реципиенти, като ендотелни прогениторни клетки, зависи от епигенетичната регулация на секрецията на секретома и първичния спусък, който засяга везикулацията [10].
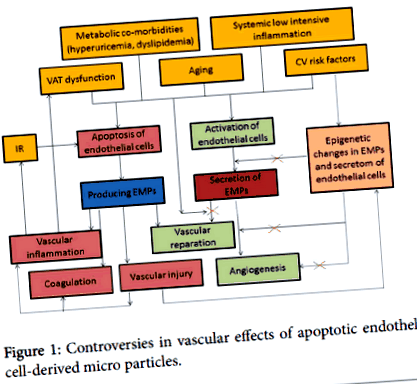
По този начин, микрочастиците, получени от апоптотични ендотелни клетки (EMPs), могат да бъдат тригер за дисфункция на ендотелните клетки и също така медиатор за възстановяване на съдовете (Фигура 1).
Фигура 1: Противоречия в съдовите ефекти на микрочастици, получени от апоптотични ендотелни клетки.
Очевидно е, че способността на апоптотичните ЕМП да модулират имунни и възпалителни процеси, коагулацията и съдовата функция, ангиогенезата и съдовите увреждания могат да взаимодействат с други регулаторни механизми, като ролята на вещицата в патогенезата на коремното затлъстяване все още се определя. Не е изключено освобождаването на апоптотични EMPs да действа като директен ендогенен сигнал за оцеляване за целевите клетки.
В заключение, измерването на циркулиращия апоптотичен EMP номер би бил полезен инструмент за стратификация сред лица със затлъстяване с по-висок риск от T2DM и CV, особено когато конвенционалните биомаркери на затлъстяването не са открити на подходящо диагностично ниво. Необходими са големи проучвания, за да се разбере ролята на апоптотичните ЕМП в патогенезата на различни фенотипи на коремно затлъстяване, тъй като те могат да бъдат цел на терапията, както и прогнозни биомаркери.
- Модел на апоптични ензителни клетъчни микровезикули при пациенти с различни фенотипове
- Спане след ядене Нощна закуска 411 Блог за сън
- Броят на смъртните случаи от COVID-19 се основава на действителни доклади; Смъртността от грип е приблизителна оценка на Уисконсин
- Номер 1 твърдо сварено яйце диета за лечение на загуба на тегло Левкемия Бързо отслабване объркване И
- Хранителни грижи за пациенти с ебола вирусна болест - том 26, номер 1 - януари 2020 г. -