Кореспонденция на: д-р Ясемин Н Балабан, професор, отделение по гастроентерология, частна болница Etimed, Elvan Mah, 1934 Sok, No. 4, 06790 Анкара, Турция. rt.ude.epettecah@nabalaby
Телефон: + 90-533-2344232 Факс: + 90-312-2930605
Резюме
Освен метаболитните функции, наскоро черният дроб е определен като орган на имунната система (ИС), който има централна регулаторна роля за вродения и адаптивния имунитет. Черният дроб поддържа деликатен баланс между чернодробния скрининг на патогенни антигени и имунната толерантност към собствените антигени. Билковите лечения с имунологични ефекти имат потенциал да променят този чернодробен имунен баланс или към терапевтична страна, или към страна на заболявания, като предизвикват чернодробно увреждане чрез хепатотоксичност или започване на автоимунни заболявания. Най-често известните билкови лечения, които имат терапевтичен ефект върху черния дроб и ИС, са доказани чрез in vitro, in vivo и/или клинични проучвания са обобщени в този преглед.
Основен съвет: Лечението с билки е майката на съвременната медицина. Древният навик да се лекуват болести с растения все още продължава или като първично, или като допълнение към конвенционалното медицинско лечение. Другата страна на медальона е фактът, че черният дроб е орган номер 1 за билкова токсичност. Освен това наскоро черният дроб е определен като активен орган на имунната система, който има централна регулаторна роля върху вродения и адаптивния имунен отговор. Деликатната хомеостаза между незабавна и ефективна защита срещу заплахи (имунен надзор на антигени), без да предизвиква вреден имунен отговор към самоструктури (периферна имунна толерантност към собствени антигени) се контролира от черния дроб. Билковите формули не са единичен растителен екстракт, а представляват взаимодействаща смес от съставки, която определя крайния клиничен резултат като терапевтичен и хепатотоксичен ефект. Настоящият преглед имаше за цел да насочи вниманието към двата потенциала на билките от гледна точка на имунологията, за да се инициира мотивация за изследване на характеристиките, определящи механизмите на имунологичното взаимодействие между билките и черния дроб.
ВЪВЕДЕНИЕ
Лечението с билки е майката на съвременната медицина. Поради културни, икономически и практически съображения древният навик да се лекуват болести с растения все още продължава да бъде първичен или допълващ конвенционалното медицинско лечение. Другата страна на медальона е фактът, че черният дроб е целеви орган номер 1 на билкови и хранителни добавки (HDS), индуцирана токсичност. Администрацията по храните и лекарствата (FDA) съгласно Закона за здравето и образованието към хранителните добавки (DSHEA) регламентира лечението с билки от 1994 г. [1]. Представянията на нови билкови продукти пред FDA изискват дозата и списъкът на съставките да бъдат написани на бутилката, но не е необходимо да се докладва документация за безопасността и ефикасността. Освен това HDS може да се получи без рецепта, медицински съвети или мониторинг. Въпреки че действителният размер на проблема не е добре дефиниран, индуцираната от HDS хепатотоксичност представлява 20% от случаите на хепатотоксичност в Съединените щати и процентите се различават от 2,5% в Индия до 70% в Сингапур [2].
Черният дроб е склонен към индуцирано от лекарства увреждане на черния дроб (DILI) поради функциите си върху метаболизма на химикалите и регулирането на имунния отговор. DILI може да се развие или чрез свързана с дозата пряка лекарствена токсичност, или - много по-често - като идиосинкратични реакции поради индивидуалната чувствителност към съставките. Сложният състав на HDS облекчава както директната токсичност, така и идиосинкратичните реакции по време на техния метаболизъм в черния дроб. Идиосинкратичният DILI (IDILI) в повечето случаи се характеризира с леко нараняване (ALT Таблица1. 1. Трег клетките експресират CD4 + CD25 + и са от съществено значение за поддържане на имунната хомеостаза и самопоносимост. Трег клетки, естествено произведени от CD4 + тимоцити в тимуса или iTreg клетки се индуцират в периферията от наивни CD4 + Т клетки в отговор на ниската доза стимулация на TCR, TGF-бета и IL-2. Освен всички тези ефекторни Т клетки, има и Т клетки с памет. Id3 е ключовата транскрипция регулатор за контрол на диференциацията на Т-клетките в ефекторни Т-клетки или Т-клетки в паметта чрез неговото действие чрез mTORC сигнализиране [7,9,12].
маса 1
Характеристики на CD4 + клетъчни подмножества
| Th1 | Th2 | Т17 | Трег | Tfh | |
| Произведени цитокини | IFN-гама, TNF-алфа, IL-2 | IL-4, IL-5, IL-9, IL-10, IL-13 | IL-17A, IL-17F, IL-21, IL-22, IL-26 | TGF-бета, IL-10 | CXCR5, IL-21 |
| Имунен отговор, медииран aginst | Вътреклетъчни патогени | Извънклетъчни паразити, алергия, хуморален отговор | Извънклетъчни бактерии и гъбички, автоимунитет | Секреция на IgA, самопоносимост | Диференциация на В клетките |
| Основни фактори за транскрипция за диференциация | T-залог | GATA-3 | RORct | Foxp3 | Bcl6 |
| Ефектирани клетки | Макрофаги, цитотоксични клетки активирани | Еозинофили, мастоцити активирани | Активирани неутрофили | В-клетките активирани Th1, Th2, Th17 потиснати | В клетките се активират |
IFN: Интерферони; IL: Интерлевкин; TGF: трансформиращ растежен фактор; TNF: Тумор некрозис фактор.
NK express CD56 при липса на CD3, но NKT изразява и двамата. NKT медиира антитуморен ефект чрез активиране на цитотоксичността на CD8 + Т клетки или отменяне на толерогенните механизми чрез контрарегулация на Treg клетки. NKT може да идентифицира гликолипидни антигени и да се подтипира на две според TCR профила на експресия. Тип 1 или инвариантни NKT (iNKT) носят инвариантна TCR алфа-верижна двойка с ограничен брой бета-вериги, докато NKT клетки тип 2 експресират разнообразен набор от TCR, които разпознават CD1d, който е MHC клас I-подобна молекула. Вродените Т лимфоцити (ITL) се състоят от iNKT клетки и гама-делта Т клетки. ITL регулират адаптивния имунен отговор чрез ключовите си роли в инициирането и полярирането на APC и други клетки на IS. Тази характеристика на ITL ги накара да бъдат насочени като имуномодулация за лечение на автоимунни заболявания [1,9].
ЧЕРЕН ДЪРВЪР КАТО ОРГАН НА Е
За да се запази хомеостазата за оцеляване, имунният отговор трябва непрекъснато да се възприема според възрастта, пола, хранителните антигени, хормоните (т.е. бременност и кърмене) и външни фактори на стрес като микробиота, флора на околната среда или изложени химикали [13]. Следователно ИС има динамичен характер и има широк „диапазон от нормални“. Освен че е метаболитен орган, прикрепен към червата, наскоро черният дроб е дефиниран като централна ос в ИС, контролираща локални и системни имунни реакции и толерантност. Всички видове чернодробни клетки имат активна имунна функция, включително както паренхимни клетки (хепатоцити, холангиоцити), така и непаренхимни клетки [чернодробни синусоидални ендотелни клетки (LSEC), чернодробни сателитни клетки (HSC) или ито клетки, KC, неутрофили, мононуклеарни клетки, лимфоцити (В клетки, Т клетки, NK клетки, NKT клетки, ITL)]. Паренхимните клетки заемат по-голямата част от обема на черния дроб (78% -80%). Непаренхимните клетки и извънклетъчното пространство представляват съответно останалите 5% -6% и 14% -17% [11,14].
Уникалните анатомични и хистологични характеристики на черния дроб са важни за неговите имунни функции. Черният дроб е разположен на кръстопътя между системната и порталната циркулация. Той се доставя от приблизително 1,5 L кръв всяка минута; 2/3 през порталната вена и 1/3 през чернодробната артерия. Двойното кръвоснабдяване носи масивен антигенен товар от стомашно-чревния тракт и системно кръвообращение към черния дроб. Кръвта, идваща от тези два източника, се смесва в синусоидите и след това тече през чернодробната лобула от перипорталната зона към централната вена. Фенестрираните структури на синусоидите позволяват интимно взаимодействие на антигени и кръвни имунни клетки с хепатоцити, KC и HSC в пространството на Disse. Обилните клетки на вродените и адаптивни IS са разположени в чернодробните синусоиди и имат способност за чувствителност на патогени, фагоцитоза, цитотоксичност, освобождаване на цитокини и представяне на антиген към Т клетки.
Богатата на антиген кръв, преминаваща през синусоидите на черния дроб, се „сканира“ от IS, който е строго регулиран между активиране и толерантност. Черният дроб остава толерантен към безвредни диетични антигени, продукти от коменсалната чревна микробиота и авто-антигени, докато реагира на екзогенни токсини, различни кръвни или чревни вируси, бактерии и паразити, както и към метастатични клетки, които се опитват да дом на черния дроб. Следователно имунните роли на черния дроб могат да бъдат разделени на 2 групи; имунно наблюдение и индукция на периферна имунна толерантност [3,15]. Всъщност, чернодробната ИС играе предимно толерогенна роля. Това може клинично да се наблюдава при пациенти с чернодробна трансплантация, например може да се трансплантира чернодробен алографт от големи MHC или дори ABO несъответстващи донори; ако се прави комбинирана трансплантация с органи от същия донор, по-вероятно е да се приемат не-чернодробни алотрансплантанти; „Оперативна толерантност“, която описва пациент с клинично нормална функция на присадката, без да се нуждае от имуносупресия, развитие при до 50% от чернодробните трансплантации [16].
Имунна надзорна функция на черния дроб
Черният дроб разчита на силния си имунитет за своята незабавна и ефективна защита срещу потенциално токсични агенти, без да предизвиква вреден имунен отговор към самоструктури. Черният дроб, предимно хепатоцитите, синтезира основното количество протеини, участващи в локалните и системните имунни отговори. Тези протеини се наричат остри фазови реагенти като фибриноген, протеиназни инхибитори, протеини на комплемента, PRRs [например, С реактивен протеин, свързващ липополизахарид (LPS) протеин, пептидогликан-разпознаващ протеин, разтворим CD14], опсонизиращи протеини (напр. Свързващи маноза) лектин, серумни амилоиди), цитокини [напр. IL-6, фактор на туморна некроза-алфа (TNF-алфа) и трансформиращ растежен фактор-бета (TGF-бета)] и хепцидин. Реактивите в острата фаза функционират по време на вродения имунен отговор, медиират възпалението, както и възстановяването и регенерацията на тъканите. Експресията им в хепатоцитите се контролира от обогатени с черния дроб транскрипционни фактори (напр. HNF, C/EBP), провъзпалителни цитокини (напр. IL-6, IL-22, IL-1β, TNF-α) и сигнални пътища надолу по веригата (напр. STAT3, NF-капа B) [7,15].
Неутрофилите са краткотрайни, циркулиращи, фагоцитни клетки, които се набират на мястото на инфекцията от цитокини и хемокини, главно IL-1 и IL-8. Те са първите реагиращи на инфекции и действат по три основни механизма; фагоцитоза (изискваща опсонизация), генериране на реактивни кислородни видове и дегранулация (освобождаване на ензими и антимикробни пептиди) и образуване на неутрофилни извънклетъчни капани (NET). NET са друг механизъм за убиване на микроби. Ядрената ДНК, лигирана с различни микробицидни протеини, освободени от активирани неутрофили, образува тези мрежи. При нормални условия черният дроб има малко неутрофили, но те бързо се натрупват след некроза. Неутрофилите могат бързо да променят своите адхезивни механизми, за да рекрудират и да образуват NET в черния дроб като отговор както на ендотоксин, така и на бактерии [14].
Макрофагите са класифицирани като класически активирани макрофаги (M1, секретира TNF-α, IL-1, IL-6, IL-8 и IL-12) или алтернативно активирани макрофаги (M2, секретира IL-10 и TGF-β) въз основа на техните секреторни модели на цитокини и провъзпалителна спрямо имунорегулаторна активност, които обаче са взаимозаменяеми функционални състояния в зависимост от микросредата, с която се сблъскват макрофагите [6,11]. KC са фиксирани макрофаги, специализирани за елиминиране на неразтворими отпадъци чрез фагоцитоза и способни да обработват и представят антигени на Т клетките и да участват в регулирането на адаптивния имунен отговор. KC се намират от вътресъдовата страна на LSEC и улавят бактерии и могат да свързват компонент 3b при условия на срязване, докато текат през синусоиди. Ролята на KC в микробното убиване зависи от естеството на патогена и от набраните имунни клетки до възпалителната страна. Характерната характеристика на експресията на PRR в черния дроб е тяхната конститутивна експресия и непрекъсната стимулация на ниско ниво от ендотоксини от червата. TLR4 е PRRS, експресиран върху всички чернодробни клетки и свързва и изчиства ендотоксини и по този начин инициира секреция на провъзпалителни и противовъзпалителни цитокини [7].
Въпреки че повече от 80% от CD3 + Т клетките са алфа-бетаТ-клетки, черният дроб също е обогатен от NK и неконвенционални лимфоцити (NKT и гама-делта Т клетки). Гама-делтаТ клетките са 5 пъти по-високи в черния дроб (15%) от периферията [4].
Хепатоцитите, които конститутивно експресират междуклетъчна адхезионна молекула-1, могат директно да взаимодействат с Т клетки чрез фенестрациите на LSEC. IFN-гама насочва хепатоцитите към APCs чрез повишаване на експресията на HLA в зависимост от дозата; от умерена експресия на HLA клас I до подобрена експресия на HLA клас II при ниски до високи нива на IFN-гама. Групирани с хепатоцит наивни Т клетки или се превръщат в ефекторни Т клетки, или претърпяват апоптоза при липса на костимулиращи сигнали. От друга страна, холангиоцитите са сравнително щадени под формата на антигенна стимулация от кръвта, но не и от тези, секретирани в жлъчката. Холангиоцитите могат да експресират TLRs, HLA клас I при ниска честота и костимулиращи молекули. Хепатотропните вируси (т.е. CMV) подобряват експресията на HLA клас I, без да индуцират HLA клас II. При патологични състояния като това на PBC, холангиоцитите действат като APC чрез свръхекспресия на HLA клас II, както и CD80 и CD86 костимулиращи молекули. Ограничените експериментални данни потвърждават, че HSC имат капацитет да действат като APC. Представянето на липиди в Т-клетки и NKT клетки от HSC може да предизвика активиране или толерантност в IS в зависимост от костимулацията [4,7].
Чернодробно медиирана периферна имунна толерантност
Местната и системна самотолерантност могат да бъдат преодолени и така автоимунните заболявания могат да бъдат инициирани от няколко патологични имунни механизма, развити в черния дроб. На първо място, патологичното представяне на антигена може да генерира автоактивни Т-клетки и В-клетки поради дефектна клонална делеция (апоптоза на антиген-специфични Т-клетки). По същия начин ILC също включват автоимунитет чрез насърчаване на представянето на антиген с класически APC, чрез освобождаване на цитокини, които поляризират имунния отговор към ефекторни Т клетки. ILC също могат да бъдат важни медиатори на автоимунно увреждане на черния дроб чрез убиване на хепатоцити и/или епителни клетки на жлъчните пътища. Патологичната ендотоксемия, причинена от дисбиотична микробиота, може да превключи имунния отговор от преобладаване на Th2 към Th1. Трег клетките регулират както вродения, така и адаптивния имунитет чрез регулиране на CD4 + клетки, KCs и LSECs. Следователно, дефектната функция на Treg клетките влошава чернодробния имунен толеранс, което води до автоимунен хепатит [4,7].
СПЕКТЪР НА ИМУННАТА ХОМЕОСТАЗА В ЧЕРНИЯ
Чернодробната ИС е винаги активна, независимо от общия резултат от отговора. Характерът на обидата за черния дроб и спектъра на активираните клетки определя клиничната картина. Здравите индивиди имат балансирано имунно наблюдение на патогени заедно с имунна толерантност към собствените антигени. Свръх имунната толерантност в черния дроб води до хронични инфекции с вируси или чернодробни метастази на ракови клетки. За разлика от това свръх активирането на чернодробния имунен отговор причинява фулминантни хепатити, отхвърляне на алографт или автоимунни заболявания.
Чернодробната имунна хемоастаза непрекъснато се балансира по време на клинични курсове на цироза. Пациентите с компенсирана цироза имат хиперактивирана IS в зависимост от основната етиология на чернодробните заболявания. Чернодробната декомпенсация е свързана с повишена чревна пропускливост. Епизодичната транслокация на чревната микробиота и техните ендотоксини в порталната циркулация предизвиква системно и чернодробно възпаление. PAMR, разпознаващи LPS, липопептиди, гликополимери, флагелин и бактериална ДНК/РНК, активират вродения и адаптивен имунитет. Освободените провъзпалителни цитокини и хемокини причиняват чернодробно увреждане и активиране на DAMP. Вискозният цикъл между членовете на PRR, а именно PAMP и DAMP изчерпва IS и по този начин превключва имунния отговор от предимно „провъзпалителен“ в статус на „имунодефицитен“ отделения. Този много късен стадий на цироза се определя клинично като остра хронична чернодробна недостатъчност (ACLF). Състоянието на имунна недостатъчност при пациенти с ACLF се нарича имунна недостатъчност, свързана с цироза [15].
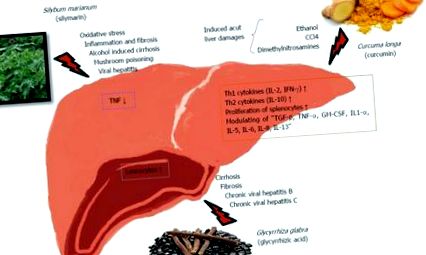
БИЛКОВИ ЛЕЧЕНИЯ С ПОТЕНЦИАЛЕН ТЕРАПЕВТИЧЕН ЕФЕКТ ВЪРХУ ЧЕРНИЯ ЧЕРН
Механизми на имунологичното действие на някои билки върху черния дроб. IFN: Интерферони; TNF: Туморен фактор на некроза; IL: Интерлевкин; TGF: Трансформиращ растежен фактор.
- Чернодробно лечение с добавки
- Чернодробната токсичност предотвратява ли отслабването Ви Dr.
- Гримьорката, която е загубила 200 паунда, казва, че това лечение е било ключово за подмладяване на външния й вид - NewBeauty
- Как можете да се почувствате след лечение на болестта на Кушинг Какво представляват синдромът на Кушинг и Кушинг
- Как лечението с хиропрактика може да ви помогне да отслабнете