Публикувано: 20 март 2017 г. (виж историята)
DOI: 10.7759/cureus.1105
Цитирайте тази статия като: Sun Y, Horowitz B L, Servilla K S, et al. (20 март 2017 г.) Хронична нефропатия от диетична хипероксалурия: Устойчиво подобряване на бъбречната функция след диетична намеса. Cureus 9 (3): e1105. doi: 10.7759/cureus.1105
Резюме
Въведение
Хипероксалурията може да причини уролитиаза, нефрокалциноза, остро бъбречно увреждане (AKI) и хронично бъбречно заболяване (CKD). Екскретираният с урината оксалат се получава както от ендогенна продукция, така и от стомашно-чревна абсорбция. Повишено ендогенно производство на оксалати се среща при първична хипероксалурия или след поглъщане на големи количества съединения, които се метаболизират до оксалати, като аскорбинова киселина и етилен гликол. Повишена стомашно-чревна абсорбция на оксалати се среща при някои чревни заболявания и/или хирургични интервенции, причиняващи стеаторея (чревна хипероксалурия) или след поглъщане на храни с високо съдържание на оксалати (диетична хипероксалурия). Вид лека хипероксалурия, свързана с уролитиаза, се обозначава като идиопатична, тъй като нейната патогенеза не е определена окончателно.
Степента на екскреция на оксалат в урината може да даде улики за етиологията на хипероксалурията. Екскрецията на оксалати обикновено е много висока при първична хипероксалурия, варира в зависимост от приема на диетичен оксалат при ентерична хипероксалурия и според съобщенията е малко по-висока от нормалната граница (90 mg/24-h; B) ентерична хипероксалурия> 90 mg/24-h; В) идиопатична хипероксалурия Фигура 1: Сцинтиграфия на галий
Картината съответства на интерстициалния нефрит. Бъбреците задържат изотопа дори 72 часа след приложението му.
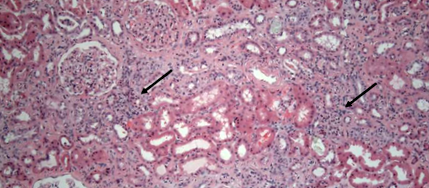
Рабепразол е прекратен и е започнат перорален преднизон. Анализът на урината обаче продължава да показва пиурия, леене на бели кръвни клетки и умерена протеинурия, докато концентрацията на серумен креатинин продължава да се повишава до висока от 4,19 mg/dL (изчислена eGFR, изчислена чрез модифициране на диетата при бъбречно заболяване (MDRD) формула - 15 ml/min на 1,73 m2 телесна повърхност (BSA)). По това време се извършва перкутанна бъбречна биопсия. В хистологията няма гломерулна патология. Тубулите показват фокално изравняване на епитела и вакуолизация на епителните клетки. Приблизително 60% от биопсираната проба показва тубулна атрофия и интерстициална фиброза върху трихромно петно. Отбелязана е и умерена артериална и артериоларна склероза. Фокални плътни инфилтрати от мононуклеарни клетки се наблюдават в интерстициума (стрелки на фигура 2).
Фигура 2: Бъбречна биопсия
Многобройни кристали калциев оксалат, които са двойно пречупващи под поляризирана светлина, и няколко кристала калциев фосфат са били наблюдавани в лумена на много тубули (Фигура 3).
Фигура 3: Бъбречна хистология
Картината показва оксалатни отлагания.
Имунофлуоресценцията показва сегментно отлагане на IgM и С3 в мезангия, разпръснати фибринови отлагания в интерстициума и фокално отлагане на С3 в тръбни базални мембрани. Електронната микроскопия потвърди забележимите дегенеративни промени в епитела. Гломерулите показват само фокално отслабване на процеса на интердигиращо стъпало. Електронно-плътни отлагания не са открити. Патологичната диагноза е хипероксалурично състояние с хроничен интерстициален нефрит, широко отлагане на калциев оксалат в тубулите, изразено тубулно раздуване и признаци на тубулно увреждане.
Таблица 1: Скорост на отделяне на урина при високи и ниски количества оксалати
Концентрацията на серумен креатинин е 3,02 ± 0,13 mg/dL в периода на висок прием на оксалат и 2,34 ± 0,39 mg/dL по време на ранните етапи на нисък прием на оксалат, когато се провеждат 24-часовите събиране на урина. Горен индекс 1: Две колекции урина. Горен индекс 2: Четири колекции урина. Горен индекс 3: Едно събиране на урина.
| Променлива | Нормален обсег | Период на висок прием на оксалат | Нисък период на прием на оксалат |
| Обем, L/24-h | 1,0 - 2,0 | 3,7 ± 1,0 1 | 5,1 ± 1,0 2 |
| Креатинин, mg/24 часа | 800 - 2000 | 1,455 ± 485 1 | 1,576 ± 340 2 |
| Оксалат, mg/24 часа | 1 | 36 ± 4 2 | |
| Оксалат/креатинин, mg/g | 1.6 - 37 | 228 ± 98 1 | 36 ± 5 2 |
| Цитрат, mg/24 часа | > 320 | 84 ± 25 1 | 105 ± 15 1 |
| Калций, mg/24 часа | 3 | 85 ± 35 1 | |
| Фосфор, mg/24 часа | 3 | 1,120 3 | |
| Пикочна киселина, mg/24 часа | 1 | 389 ± 52 1 |
Дискусия
Този случай повдига две основни точки. Първият момент е, че хроничният прием на храни с високо съдържание на оксалат може да доведе до хипероксалурия с екскреция на оксалат в урината, подобна на степента, която обикновено се наблюдава при първична хипероксалурия. Компонентът на отделянето на оксалат с урината, който се получава от стомашно-чревната абсорбция, се определя от съдържанието на оксалат в диетата и скоростта на абсорбция на оксалат в червата. Хранителните продукти с високо съдържание на оксалат включват листни зеленчуци, като спанак, различни ядки, например фъстъци и тропически плодове, включително Averrhoa carambola (звездови плодове) и Averrhoa bilimbi.
Средното дневно съдържание на хранителен прием на оксалат в САЩ е 214 mg при мъжете, 185 mg при по-възрастните жени и 183 mg при по-младите жени; спанакът представлява> 40% от приема на оксалат [2]. Факторите, водещи до високи нива на абсорбция на оксалат от червата, включват наличието на медицински състояния или хирургични интервенции, водещи до стеаторея, ниско диетично съдържание на калций и магнезий, като и двете свързват оксалат в стомашно-чревния тракт и намаляват неговата абсорбция и бъбречна екскреция и отсъствието от чревната флора на някои видове бактерии, по-специално Oxalobacter formigenes, анаеробна бактерия, която метаболизира оксалат. Липсата на тази бактерия от червата е свързана с хипероксалурия. Прилагането на препарати на Oxalobacter formigenes може да бъде полезно при хипероксалурични състояния, включително първична хипероксалурия и ентерична хипероксалурия.
Въпреки че има значителни различия между индивидите, отделянето на оксалат с урината се увеличава паралелно с приема на диетичен оксалат, когато други променливи, потенциално засягащи оксалурията, са под контрол [3]. В допълнение към приема на оксалати, приемът на прекурсори на оксалат може да причини хипероксалурия. Аскорбиновата киселина, пиридоксилатът, който е комбинация от глиоксилова киселина и пиридоксин, и хидроксипролин са потенциални източници на оксалат, които са причинили хипероксалурична бъбречна болест в клинични и експериментални проучвания. И накрая, хипероксалурия и оксалатна нефропатия могат да се развият в резултат на оксалатните соли на парентералните лекарства.
Основните прояви на остра интоксикация от поглъщане на хранителни продукти, лекарства или токсични вещества с високо съдържание на оксалати включват стомашно-чревния тракт (болка, гадене, кърваво повръщане, кървава диария), нервната система (тетания, прояви на мозъчен оток) и бъбреците (протеинурия, олиго-анурия). Оцелелите пациенти с АКИ могат да възстановят нормалната бъбречна функция, дори ако развият тежка бъбречна недостатъчност, изискваща диализа за известно време [4-6].
ХБН може да се развие като последица от диетичната хипероксалурия. Причината за хипероксалурична ХБН е консумация на фъстъци при един пациент [7] и „изцеждане“ (хроничен прием на големи количества сокове, извлечени от различни зеленчуци) при трима други пациенти [8]. Отлагането на оксалатни кристали в бъбречните тубули, обширни дегенеративни промени в тубулите и различна степен на интерстициално възпаление и фиброза са основните хистологични характеристики на нефропатията в тези случаи. Бъбречната функция се подобрява след спиране на високия прием на оксалат [7-8].
ХБН от диетичната хипероксалурия има сходни хистологични характеристики с всички останали видове оксалатна нефропатия. Стерилна пиурия с отливки на бели кръвни клетки се среща при всички видове интерстициален нефрит. Интересното е, че кристалите на калциевия оксалат, които биха могли да насочат клиницистите към диагностицирането на оксалатна нефропатия, не са наблюдавани в урината на нашия пациент или в няколко публикувани доклада за оксалатна нефропатия.
Галиевата сцинтиграфия се използва за разграничаване между остър интерстициален нефрит и други видове AKI. Не открихме съобщения за сцинтиграфия на галий при пациенти с хипероксалурия. При нашия пациент сцинтиграфията на галий е положителна, подкрепяйки първоначалната клинична диагноза на интерстициален нефрит. Клиничната картина, изследването на урината и образите обикновено не са достатъчни за разграничаване между оксалатната нефропатия и други видове интерстициален нефрит. Необходима е бъбречна биопсия. Отлагането на С3 и имуноглобулини в тръбната базална мембрана също е установено при ентерична хипероксалурия [4].
Новите разработки относно молекулярните механизми на тубулни епителни увреждания и интерстициално възпаление хвърлиха светлина върху механизма на оксалатната нефропатия. Охалатни свързващи протеини в бъбречните тъкани и медиатори на свързване на калциев оксалат към тубуларните клетки са характеризирани. Хипероксалурията причинява повишена регулация на бъбречната травма Молекула-1 (KIM-1). Установено е, че нивата на оксалат в урината корелират с фактора на туморна некроза и нивата на Fas лиганд и са свързани с апоптоза на бъбречните тубуларни клетки. Инфламазомите са цитозолни високомолекулни комплекси, които са части от вродената имунна система. Нуклеотид-свързващият домен, богата на левцин инфламазома (NALP3, или NLRP3, или криопирин), олигомеризира при активиране и набира протеаза каспаза 1, за да образува възпалителен протеинов комплекс. Активираната каспаза 1 разцепва неактивните предшественици на IL-1β и Il-18, което води до генерирането на активните форми на тези цитокини. Изследвания върху експериментални животни показват, че хипероксалурията активира NALP3 инфламазома и че медиираното от NALP3 възпаление е необходимо за развитието на оксалатна нефропатия ХБН [9].
Вторият важен момент, илюстриран от този доклад, е, че разпознаването на диетичната хипероксалурия и намаляването на приема на оксалати може да доведе до подобряване на бъбречната функция, което може да се запази с години. Диетичната хипероксалурия предлага идеален субстрат за изследване на ефекта от нормализирането на оксалурията върху хода на хипероксалурична ХБН, тъй като единствената причина за хипероксалурия в нашия случай е високият прием на диетичен оксалат. Два предишни доклада [7-8] забелязват подобрение в бъбречната функция след нормализиране на приема на оксалат. Нашият доклад показва, че дори когато ХБН е достигнал напреднал стадий, подобряването на бъбречната функция при диетична хипероксалурия след намаляване на приема на оксалат може да бъде продължително и значително, което води до нормализиране както на серумния креатинин, така и на резултатите от уринирането. Частично подобрение на ХБН се съобщава и при няколко пациенти с напреднала хипероксалурична ХБН вследствие на хроничен прием на големи количества аскорбинова киселина.
Заключения
Бъбречната биопсия е необходима за установяване на диагнозата на ХБН, вторична спрямо диетичната хипероксалурия. При пациенти с ХБН вследствие на диетична хипероксалурия, въвеждането на диета с ниско съдържание на оксалат води до намаляване на екскрецията на оксалат в урината и може да доведе до бързо нормализиране на бъбречната утайка и бавно подобряване на бъбречната функция. Предотвратяването на диетичната хипероксалурия, като се избягва прекомерен прием на храни с високо съдържание на оксалат или неговите прекурсори, трябва да бъде част от диетичното образование на обществеността.
- Диетични подходи за спиране на хипертонията и риск от хронично бъбречно заболяване Систематичен преглед и
- Диетичният протеинов режим преди бъбречна исхемия оказва значително влияние върху постишемичната уремия
- Диетично лечение на метаболитна ацидоза при хронична бъбречна болест
- Ефект от приема на протеини в храната върху общата концентрация на CO2 в серума при хронична бъбречна болест
- Хронична бъбречна недостатъчност при котки - New Plymouth Vet Group