Резюме
Заден план
Дефицитът на тестостерон при мъжете е клинично свързан с развитието на метаболитен синдром, който се проявява като затлъстяване, чернодробна стеатоза и диабет тип 2. Изследвахме ефектите на индуцирания от кастрацията дефицит на тестостерон върху телесното затлъстяване и експресията на гени, свързани с липидния метаболизъм и усвояването на глюкозата и андрогенната сигнализация при мъжки плъхове, хранени с нормална диета (ND) или диета с високо съдържание на мазнини (HFD).
Методи
Промените в метаболизма на липидите и глюкозата и андрогенната сигнализация са изследвани на физиологични и молекулярни нива в мускулите, черния дроб и мастните тъкани на некастрирани и кастрирани плъхове при ND или HFD хранене.
Резултати
Индуциран от кастрация дефицит на тестостерон предразполага животни към ND към ранно развитие на мастен черен дроб чрез активиране на синтеза на мастни киселини (FA), докато HFD активира поемането на чернодробна FA CD36 експресия, водеща до развитие на чернодробна стеатоза. При плъхове, хранени с ND, кастрацията предизвиква натрупване на мускулна мазнина чрез активиране CD36 израз. В подкожната мастна тъкан на плъхове, хранени с ND, кастрацията увеличава затлъстяването и експресията на гени, свързани с синтеза на FA, но намалява експресията на ген на транспортер на глюкоза. В коремната мазнина на плъхове, хранени с ND, кастрацията увеличава затлъстяването чрез повишено регулиране на гените, свързани с синтеза на FA, а HFD насърчава затлъстяването, като индуцира усвояване на FA, транспортер на глюкоза и експресия на гена, свързана с FA синтез. При плъхове, хранени с ND, кастрацията намалява телесния растеж и мускулното тегло и намалява експресията на гените за андрогенно сигнализиране в мускула longissimus dorsi.
Заключения
Дефицитът на тестостерон увеличава затлъстяването по специфичен за тъканите и зависим от диетата начин. Недостигът на тестостерон намалява теглото на тялото и мускулите и регулира андрогенната сигнализация.
Въведение
Тестостеронът играе важна роля в метаболизма на липидите и глюкозата [1]. Kelly et al. [2] предполага, че тестостеронът намалява отлагането на телесни мазнини чрез регулиране на експресията на гени, свързани с липидния и глюкозния метаболизъм. Ниското ниво на тестостерон или дефицитът на тестостерон дерегулират метаболизма на липидите и глюкозата, което води до повишено затлъстяване в черния дроб и периферните тъкани [2,3,4,5]. Дефицитът на тестостерон е свързан с повишено висцерално затлъстяване [6]. Ниското ниво на тестостерон е предсказващо за развитието на метаболитен синдром, който се проявява като затлъстяване, неалкохолна мастна чернодробна болест и диабет тип 2 при мъже [1, 7] и лабораторни животни [2, 5]. Ефектите на дефицита на тестостерон върху затлъстяването и метаболизма на липидите/глюкозата са противоречиви. Например, андрогенният дефицит в комбинация с диета с високо съдържание на мазнини (HFD) влошава затлъстяването и инсулиновата резистентност при мъжки мишки [5]. За разлика от това, нивата на серумна глюкоза и инсулин при мъжки плъхове не се влияят от дефицит на тестостерон и HFD [8]. Следователно ефектите от дефицита на тестостерон върху метаболизма на липидите и глюкозата изискват допълнителни изследвания.
Отлагането на телесни мазнини се модулира от липидните метаболитни пътища, които медиират поемането, синтеза и разграждането на мастните киселини (FA) [9,10,11]. FA транспортерът CD36 посредничи за усвояването на FA и играе важна роля в чернодробната стеатоза [12]. Налична е ограничена информация за ролята на CD36 в отлагането на мазнини при плъхове с дефицит на тестостерон. Kelly et al. [2] докладвани разлики в ефекта на тестостерона върху функцията на подкожната (sc) спрямо висцералната мастна тъкан: тестикуларно-феминизирани мишки (с нефункционален андрогенен рецептор [AR] и ниско ниво на тестостерон) показват намалено GLUT4 експресия в sc, но не и висцерална мастна тъкан. Необходими са по-нататъшни проучвания на ефектите на дефицита на тестостерон върху експресията на гени, свързани с липидния и глюкозния метаболизъм в периферните тъкани (включително черния дроб и скелетните мускули) и мастните депа (sc и коремните [аб] мастни тъкани), за да се разберат механизмите от което затлъстяване се регулира.
Дефицитът на тестостерон намалява растежа и мускулната маса при мишки с орхидектомия и AR-нокаут [5] и намалява мускулната маса при мъжете [13]. Тези открития предполагат значението на тестостерона за растежа на тялото и мускулите. Тестостероновата сигнализация се медиира от AR сигналния път [14, 15] и по този начин се изисква изследване на ефекта от дефицита на тестостерон върху AR сигнализирането.
Храненето с HFD на гризачи променя техния метаболизъм на липидите и глюкозата [16, 17] и често се използва за изследване на метаболитен синдром като висцерално затлъстяване, хиперлипидемия и инсулинова резистентност [18]. Ето защо ефектът от комбинацията на дефицит на тестостерон и HFD трябва да бъде изяснен. Ние предположихме, че дефицитът на тестостерон диференциално дерегулира експресията на гени, свързани с липидния метаболизъм и усвояването на глюкоза по специфичен за тъканите начин, предразполагащ към метаболитен синдром. Също така предположихме, че HFD изостря предизвиканите от дефицит на тестостерон промени в метаболизма на липидите и глюкозата. За да тестваме тези хипотези, ние изследвахме ефекта от кастрацията върху растежа, затлъстяването, скелетната мускулна маса, кръвните параметри и нивата на експресия на гени, свързани с липидния метаболизъм и усвояването на глюкоза в черния дроб, мускулите и депата на мазнини и sc и ab при мъжете плъхове, хранени с нормална диета (ND) или HFD в продължение на 9 седмици.
Материали и методи
Животни, кастрация и диети
Всички експериментални процедури, включващи животни, са одобрени от институционалния комитет по използване и грижи за националните университети в Чонъм (CNU) (номер на разрешение CNU IACUC-YB-R-2010-13). Всички процедури за управление на животните следваха стандартните оперативни протоколи на CNU. Плъховете от мъжки тип Sprague – Dawley са закупени от Orient Bio (Gyeonggi-Do, Република Корея) и са поддържани в контролирана температура (22 ± 1 ° C) и влажност (45–65%) под 12/12 h светлинен/тъмен цикъл с свободен достъп до храна и вода.
Плъховете са кастрирани на 6-седмична възраст, като по това време средното им телесно тегло е 213 g. Всички хирургически инструменти бяха предварително стерилизирани по приемливи методи, включително стерилизация с пара. Мъжките плъхове се анестезират чрез интрамускулно инжектиране на Zoletil ™ 50 (5 mg/kg телесно тегло, Virbac, Франция) и се поставят върху нагряваща подложка. Скротумът на плъховете беше обръснат и почистен с помощта на 70% етанол. През кожата на скротума беше направен малък разрез по средната линия (1 см) и тестисите бяха разположени, внимателно изцедени и отстранени. След това семепроводи, мазнини и кръвоносни съдове бяха възстановени в първоначалното си положение в скроталната торбичка, а семепроводът и кръвоносните съдове бяха лигирани с копринени конци (Ailee, Seoul, Korea). Мускулният слой и кожата бяха затворени с конци, след което плъховете бяха върнати в клетките си и наблюдението на тяхното възстановяване. Контролните плъхове с фалшива хирургия бяха подложени на идентична процедура като кастрираните плъхове, с изключение на липсата на отстраняване на тестисите.
След аклиматизация в продължение на 1 седмица след кастрация с ND хранене, плъховете бяха разделени на следните четири групи (по 8 на група): плъхове, управлявани от фалшиви, хранени с ND или HFD и кастрирани плъхове, хранени с ND или HFD. Нормалната диета AIN93-G (D10012G) и HFD (D12451) са закупени от Research Diets, Inc. (New Brunswick, NJ, USA); техните композиции са показани в поддържащи таблици S1-S3. Накратко, в HFD спрямо ND, 45% срещу 16% от енергията е съответно от мазнини, 35% срещу 64% от въглехидрати и 20% срещу 20% от протеини. Приемът на храна на плъховете се записва ежедневно по едно и също време на деня и телесното им тегло се измерва ежеседмично.
Събиране на кръв и тъкани
В края на 9-седмичния период на хранене, плъховете (на възраст 16 седмици) са гладували в продължение на 8 часа. Плъховете се анестезират с CO2 и кръвните проби се събират чрез сърдечна пункция, прехвърлят се в ET тръба без антикоагулант и се съхраняват при 4 ° С. Кръвните проби се центрофугират при 2000 хж за 20 минути при 4 ° C за събиране на серум, който се съхранява при - 80 ° C до анализ. След анестезиране с CO2 плъховете бяха евтаназирани чрез обезглавяване и черният дроб, мастните тъкани (ab и sc) и скелетните мускулни тъкани (longissimus dorsi, gastrocnemius и soleus) бяха незабавно отстранени и претеглени. Тъканите бяха замразени в течен азот и съхранявани при - 80 ° C за последващо определяне на общите нива на липидите, иРНК и протеините.
Анализ на серума и тъканите
Параметрите на серума са анализирани, както е съобщено по-рано [19, 20]. Накратко, серумното ниво на глюкозата беше анализирано с помощта на хексокиназни реагенти (Green Cross Reference Laboratory, Сеул, Корея). Серумното ниво на триглицеридите се анализира чрез ензимен спектрофотометричен анализ (Green Cross Reference Laboratory). Серумните нива на тестостерон и инсулин са анализирани чрез ензимно-свързан имуносорбентен анализ. Серумното ниво на свободните FA е анализирано чрез метода ацил-коензим А (CoA) синтаза-ацил-CoA оксидаза. Серумните нива на общия холестерол, липопротеините с висока плътност (HDL) и липопротеините с ниска плътност (LDL) са анализирани чрез ензимни колориметрични тестове.
Мускулните тъкани се дисектират и се поставят в течен азот. Общо липиди бяха извлечени от приблизително 50 mg мускулна тъкан по метода на Folch [21].
Хистология
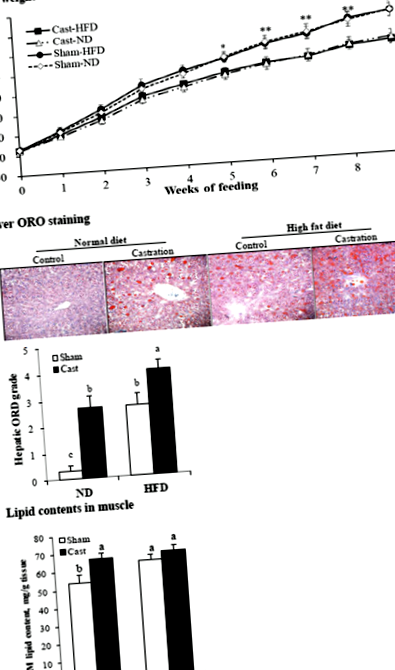
За хистологичен анализ черният дроб беше дисектиран и освободен от видими мазнини и кръв. Извършен е хистологичен анализ и оцветяване с тъмночервено O (ORO) на тъканите, както е съобщено по-рано [20]. Накратко, чернодробните проби бяха фиксирани в 10% формалин, уравновесени в 20% захароза, вградени в съединение с оптимална температура на рязане и нарязани на секции с дебелина 7 μm, използвайки криостат при - 20 ° C. За да се оцени отлагането на мазнини, замразените секции бяха фиксирани в 10% формалин, оцветени с 0,5% ORO и изследвани под микроскоп. Степента на чернодробно оцветяване с ORO беше определена и класифицирана от 0 до 5 (най-ниска до най-висока).
Полимеразна верижна реакция в реално време
Общата РНК беше изолирана, използвайки реагент TRIzol (Molecular Research Center, Cincinnati, OH, USA), съгласно инструкциите на производителя. Общата РНК се определя количествено чрез измерване на абсорбцията при 260 nm и нейната цялост се оценява чрез електрофореза в агарозен гел и оцветяване с етидиев бромид на 28S и 18S РНК ленти. Синтез на кДНК и анализи на верижна реакция на полимераза в реално време бяха извършени, както е описано по-горе [19]. Праймерите са проектирани с помощта на интегрирана ДНК технология (Coralville, IA, САЩ) и софтуера Primer 3, базиран на последователности в GenBank и са синтезирани от Bioneer (Daejeon, Корея). Информация за праймерите е показана в поддържаща таблица S4. Методът 2 -ΔΔCT беше използван за определяне на относително гъвкави промени в нивата на генна експресия, нормализирани към подходящия домакински ген (глицералдехид-3-фосфат дехидрогеназа за черния дроб, β-актин за мускули и кисел рибозомен фосфопротеин P0 за мастна тъкан).
Уестърн блотинг
статистически анализи
Данните са представени като средни стойности ± стандартна грешка (SE). Данните бяха анализирани, като се използва общата процедура на линеен модел в SAS (SAS Institute Inc., Cary, NC, USA). Моделът включва ефектите от кастрацията, диетата (ND или HFD) и взаимодействието кастрация × диета. Когато взаимодействията бяха значителни, опцията PDIFF на LSMEANS в SAS беше използвана за извършване на индивидуални сравнения на средствата. Разликите бяха счетени за значими, когато P стойността е по-малка от 0,05.
Резултати
Кастрацията намалява телесното и мускулното тегло, но увеличава телесното затлъстяване
Кастрираните плъхове в групите с ND и HFD имат по-ниска (P Фиг. 1
Кастрацията се увеличи (P Таблица 2 Серумните параметри на плъхове, подложени на фалшив (контролен) и кастриран мъжки тип, хранени с нормална диета или диета с високо съдържание на мазнини при 8-часово гладуване
Кастрацията и HFD модулират експресията на гени, свързани с липидния метаболизъм и усвояването на глюкозата
Кастрацията модулира експресията на гени, свързани с липидния метаболизъм, по тъканно специфичен начин. Кастрация надрегулирана (P Фиг. 2
Кастрацията не повлия GLUT2 израз в черния дроб или GLUT4 експресия в мускулите и в двете диетични групи (фиг. 2в). За разлика от това, кастрацията е понижена (P
Дискусия
Недостигът на тестостерон увеличава телесното затлъстяване и дерегулира експресията на гени, свързани с липидния метаболизъм и усвояването на глюкоза по специфичен за тъканите и зависим от диетата начин
В това проучване установихме, че индуцираният от кастрация дефицит на тестостерон увеличава затлъстяването в черния дроб, мускулите и sc и ab мазнините при плъхове, хранени с ND, а също така увеличава затлъстяването в черния дроб и sc и ab мазнините, но плъхове, хранени с HFD. В съответствие с нашите резултати, ниското ниво на тестостерон или дефицитът на тестостерон увеличава затлъстяването в черния дроб и няколко периферни тъкани [2, 3, 5], а HFD увеличава затлъстяването на тъканите [4, 5, 18].
Изследвахме нивата на експресия на гени, участващи в усвояването и синтеза на FA, за да оценим молекулярните механизми, лежащи в основата на ефектите от дефицита на тестостерон и типа на диетата върху затлъстяването. Кастрацията увеличи изражението на CD36 в черния дроб и sc и ab мазнини в групата с HFD, но не в групата с ND и в мускулите в групата с ND, но не и в групата с HFD. Активирането на CD36 участва в индуцирана от диетата чернодробна стеатоза [23, 24] и е свързано с безалкохолна мастна чернодробна болест при хората [25]. Активирането на CD36 експресията в мастните мастни клетки е неясна. Нашите открития показват, че HFD-индуцираното регулиране на CD36 експресията е свързана с повишено sc и абдипозия в допълнение към чернодробната стеатоза. Кастрацията увеличи изражението на ACC и FASN в черния дроб в ND групата, но в мускулите в HFD групата. При sc и ab мазнини кастрацията повишава експресията на ACC и/или FASN и в двете диетични групи; увеличеното FASN експресията в sc мазнини е в съответствие с предишно проучване, включващо мишки [5].
Кастрацията също така модулира експресията на гени, свързани с усвояването на глюкозата. В sc мазнините кастрацията значително намалява експресията на GLUT4 в групите ND и HFD. За разлика от това, кастрацията не повлиява експресията на гени, свързани с усвояването на глюкоза в черния дроб или мускулите в групата с ND или HFD. В аб мазнините кастрацията увеличава експресията на GLUT4 в HFD, но не и в ND, група. По подобен начин Kelley et al. [2] съобщи, че GLUT4 експресията е намалена в sc мазнини, но не и в ab мазнини при тестикуларно-феминизирани в сравнение с нормални мишки. В това проучване концентрацията на циркулиращата глюкоза се увеличава при кастрирани плъхове, хранени с ND, но не и при тези, хранени с HFD. Повишените концентрации на глюкоза може да се дължат на комбинирани ефекти от намалената експресия на GLUT4 гена в sc мазнини и намалената мускулна маса, наблюдавана при кастрирани животни.
Нашите резултати също така показват, че ниското ниво на тестостерон е свързано с повишен риск от диабет тип 2, тъй като кастрираните плъхове показват намалена експресия на гени, свързани с усвояването на глюкоза в sc мазнини, както и повишена концентрация на циркулираща глюкоза. След кастрация установихме повишени нива на холестерол в кръвта, които могат да бъдат причинени от намаленото поемане на холестерол в черния дроб и мускулите, като израз на LDLr в черния дроб и мускулите е намалена чрез кастрация на плъховете.
Недостигът на тестостерон намалява теглото на тялото и мускулите и регулира андрогенната сигнализация
Открихме, че кастрацията намалява теглото на тялото, longissimus dorsi и гастрокнемиуса на плъховете. Кастрацията също намаля STAT5a и AR експресия в мускула на лонгисимус гръб и AR експресията беше допълнително намалена от HFD. По този начин индуцираният от кастрация дефицит на тестостерон дерегулира AR сигнализирането и е необходимо нормално ниво на тестостерон за AR сигнализиране. Освен това, HFD увеличава индуцираното от кастрацията намаляване на мускулната маса и AR израз. Следователно правилното хранене е важно за поддържане на мускулната маса при наличие на ниско ниво на тестостерон, тъй като ниското ниво на тестостерон може да влоши индуцираното от HFD намаляване на мускулната маса. Намалената мускулна маса може да намали използването на глюкоза от мускулите, което води до хипергликемия и дерегулация на хомеостазата на глюкозата. Това отчасти може да обясни повишеното затлъстяване при дефицит на тестостерон в ND и HFD групите.
Zirkin и Tenover [27] съобщават, че нивото на циркулиращия тестостерон обикновено намалява с възрастта. Всъщност лечението на възрастни мъже с хормон на растежа и тестостерон подобри тяхната чиста телесна маса [28]. Дефицитът на тестостерон, който може да бъде причинен от хипогонадизъм, централно затлъстяване или лишаване от андроген при пациенти с рак на простатата, е свързан с метаболитни синдроми, включително инсулинова резистентност и диабет тип 2 [29]. При животните HFD диференцирано влияе върху метаболизма на тялото и метаболитните заболявания с възрастта. Храненето с HFD води до по-голямо увеличение на телесното тегло и нивата на общия холестерол и глюкоза в серума при по-възрастните мишки в сравнение с по-младите мишки [30]. Нашето проучване предполага, че консумацията на HFD от възрастни мъже, които обикновено имат ниски нива на тестостерон, може да насърчи развитието на метаболитен синдром.
В това проучване плъховете са кастрирани на 6-седмична възраст, когато са били незрели. Следователно кастрацията може да е повлияла на цялостното развитие на животните и да допринесе за физиологични различия спрямо некастрираните животни. При мъжете нивата на тестостерон обикновено намаляват в напреднала възраст. Следователно може да има ограничение за пряко въздействие на нашите открития върху мъжете, тъй като плъховете са били кастрирани в незряла възраст.
Проучване за добавяне на тестостерон на кастрирани плъхове може да потвърди модела на дефицит на тестостерон чрез кастрация, въпреки че не проведохме експеримента.
Заключения
- Какво представляват иглички Състоянието може да бъде причинено от недостиг на диета
- Ефектът на 5-алфа редуктазата върху тестостерона при мъжете - изглед в пълен текст
- Поддиагностицираните мъжки хранителни разстройства стават все по-идентифицирани NPR
- Ефектът от лишаването от свобода върху траекториите на ИТМ за възрастни мъже, САЩ, 1981–2006
- Симптомите на мъжката менопауза разархивирани - ScienceDaily