Субекти
Диетата има признато влияние върху развитието и развитието на рака. Ефектът от модификациите на диетата върху имунната система обаче остава неуловим. Rubio-Patiño и колеги предоставят доказателства, че диетата с ниско съдържание на протеини засилва противораковия имунен отговор при мишки, носещи тумор, и подчертават потенциала на тази диетична интервенция при пациенти с рак.
Отнася се до Rubio-Patiño, C. et al. Диетата с ниско съдържание на протеини предизвиква IRE1α-зависим противораков имунонаблюдение. Cell Metab. 27, 828–842.e7 (2018).
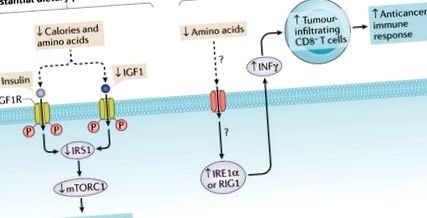
Разгънатите протеинови пътища на отговор бяха регулирани в туморните клетки от мишки, хранени с нископротеинова диета, в сравнение с туморни клетки от мишки, хранени с контролната диета. Интересното е, че изследователите наблюдават, че инхибирането на ендоплазмен ретикулум, зависим от стреса протеин 1α (IRE1α) и индуцируем с ретиноева киселина ген 1 протеин (RIG1; известен също като DDX58), сигнализира негативно върху противораковия имунен отговор, причинен от ниско протеиновия диета. Това повишено регулиране на IRE1α и RIG1 в туморните клетки предполага, че това може да е молекулният механизъм, лежащ в основата на туморния имунен отговор, предизвикан от тази диетична намеса. Изследователите стигнаха до заключението, че техните данни оспорват „общата догма“, че намаляването на протеините в диетата ограничава развитието на тумори чрез намаляване на пролиферацията на тумори и аргументират ролята на циркулиращия IGF1 (въпреки че този растежен фактор не е пряко измерен). Те също така предлагат, че диетата с ниско съдържание на протеини индуцира IRE1α-зависима активация на туморни клетки на специфични противоракови CD8 + Т-клетки, които не включват пътя на mTOR.
По-рано съобщавахме, че изокалорична диета с по-голямо ограничение на протеините (
65% по-малко протеини) от диетата с ниско съдържание на протеини, използвана от изследователите, има значителен антитуморен ефект при модели на рак на простатата и рак на гърдата при човека 8. Драматичното инхибиране на туморния растеж е свързано със значително инхибиране на чувствителния на хранителни вещества mTOR път и отмяната на пролиферацията на туморни клетки. Нашите открития обаче се различават от тези, наблюдавани от Рубио-Патиньо и колеги, които не съобщават за съществена модулация на пътя mTOR-AKT. Интересното е, че намаляването на размера на тумора, индуцирано от нископротеинова диета, се наблюдава при имунодефицитни мишки, които нямат CD8 + Т клетки, което предполага директен антипролиферативен ефект върху туморните клетки и/или ефект върху вродената имунна система 8. По този начин сега съществуват убедителни доказателства, че ограничаването на протеините в храната има потенциален противораков ефект и активността на антипролиферативния или проимунния отговор може да бъде пряко свързана с нивото на ограничаване на протеините 7,8 (фиг. 1). Въпреки това, общото схващане, че диетата с високо съдържание на протеини е полезна при пациенти с рак, трябва да се разглежда с повишено внимание.
Значително ограничаване на протеини и калории може директно да инхибира пролиферацията на туморни клетки чрез инсулин-инсулиноподобен растежен фактор 1 (IGF1) –инсулинов рецепторен субстрат 1 (IRS1) - бозайникова цел на оста на рапамицин комплекс 1 (mTORC1). Умереното протеиново ограничение може да индуцира експресия на протеин 1α (IRE1α) -ретиноева киселина-индуцируем протеин 1-ретинова киселина (RIG1) в туморни клетки, да увеличи секрецията на IFNy и последващо набиране на тумор-инфилтриращи CD8 + Т-клетки и индукция на противораков отговор. ? и пунктирани стрелки представляват неизвестен рецептор и механизъм. IGFR1, IGF1 рецептор.
Важен въпрос, който остава, се отнася до подходящото ниво на ограничаване на хранителните протеини, за да се получи оптималният противотуморен имунен отговор. Трябва да се отбележи, че изследователите установиха, че 12,5% и 25% намаление на хранителните протеини има подобен противораков ефект, но 40% намаление няма ефект, което предполага не само липсата на линеен полезен ефект с това специфично хранително ограничение, но също така и потенциален бимодален резултат 7. Това наблюдение може да има транслационно значение и предполага необходимостта от идентифициране на „сладкото място“ за всеки пациент или тип тумор. В допълнение, времето на интервенцията може да повлияе на ефекта от диетичното ограничаване на протеините. Противораковият имунен отговор може да е различен в зависимост от това кога се прилага интервенцията, например по време на започване на тумора, когато заболяването вече е установено или в напреднал стадий. Освен това, аминокиселинният състав и различните източници на храна може да са важни, за да предизвикат благоприятния ефект от диетичното ограничаване на протеините. Интригуващи данни от нашата група наистина предполагат, че противораковият ефект, постигнат с диетично ограничаване на протеините, може да се получи и чрез заместване на животински протеин казеин с растителна соя 8 .
Като цяло данните, представени от изследователите, предоставят доста убедителни доказателства за потенциалната роля на умереното ограничаване на протеините върху прогресията на тумора, но не непременно върху инициирането на тумора. Диетата с ниско съдържание на протеини не е тествана в онкогенен модел на рак, както се съобщава при други интервенции за ограничаване на диетата, за да се проучат ранните ефекти на имуномодулацията върху установяването на тумор 9. В допълнение, предклиничните данни от диети, имитиращи гладуване или калорични ограничения върху имунологичното наблюдение на тумора и имунореакцията, предполагат, че различни интервенции за ограничаване на храненето могат да постигнат подобни резултати 9,10. Преходните диетични интервенции при пациенти с рак могат да бъдат осъществими, но най-важният въпрос е дали тези лечения ще засилят ефекта от настоящата и бъдещите имунотерапии. По-изчерпателното разбиране на влиянието на диетите с ниско съдържание на протеини и други диетични ограничения върху кръстосаната връзка между вродения и адаптивния имунен отговор ще доведе до обосновка за клинични тестове.
Предстои да разберем как, но не и дали тези интригуващи открития ще бъдат пренесени в клиниката. Необходими са по-нататъшни проучвания, за да се характеризира специфичната роля на модулирането на хранително-чувствителните пътища върху различните компоненти на туморната микросреда. Дори диетата с ниско съдържание на протеини да не е готова за „прайм тайм“, несъмнено работата на Рубио-Патиньо и колеги изглежда оспорва общоприетото схващане, което засяга много пациенти с рак - „захарта храни ли рака?“ - и да предоставят обосновка за начина на хранене, който може да им помогне да се борят с болестта си.
Препратки
Fontana, L., Weiss, E. P., Villareal, D. T., Klein, S. & Holloszy, J. O. Дългосрочни ефекти от ограничаването на калориите или протеините върху серумната концентрация на IGF-1 и IGFBP-3 при хора. Старееща клетка 7, 681–687 (2008).
Wilson, K. M., Giovannucci, E. L. & Mucci, L. A. Лайфстайл и диетични фактори в превенцията на летален рак на простатата. Азиатец J. Androl. 14., 365–374 (2012).
Chen, W. et al. Индуцираната от макрофаги туморна ангиогенеза се регулира от TSC2 – mTOR пътя. Рак Res. 72, 1363–1372 (2012).
Августсон, К. и сътр. Проспективно проучване на приема на риба и морски мастни киселини и рак на простатата. Рак Епидемиол. Биомаркери Пред. 12, 64–67 (2003).
Fontana, L. & Partridge, L. Насърчаване на здравето и дълголетието чрез диета: от моделни организми до хора. Клетка 161, 106–118 (2015).
Lee, W. J. & Hase, K. Чревни метаболити, генерирани от микробиота в здравето на животните и болестите. Нат. Chem. Biol. 10, 416–424 (2014).
Rubio-Patino, C. et al. Диетата с ниско съдържание на протеини предизвиква IRE1α-зависим противораков имунонаблюдение. Cell Metab. 27, 828–842.e7 (2018).
Fontana, L. et al. Ограничаването на хранителните протеини инхибира растежа на тумора при модели на човешки ксенотрансплантат. Oncotarget 4, 2451–2461 (2013).
Pietrocola, F. et al. Миметиците за ограничаване на калориите подобряват противораковото имунонаблюдение. Ракова клетка 30, 147–160 (2016).
Di Biase, S. et al. Диетата, имитираща гладуването, намалява HO-1 за насърчаване на Т-клетъчно-медиираната туморна цитотоксичност. Ракова клетка 30, 136–146 (2016).
- Нискокалорични диети при лечението на захарен диабет тип 2 Ендокринология
- Диета с ниско съдържание на протеини - Грижа за рака в Западен Ню Йорк
- Ето как диета с ниско съдържание на протеини може да намали риска от рак
- Прекалено дебел ли е черният ви дроб Време е да го поставите на диета - The Globe and Mail
- Имам глаукома Трябва ли да променя диетата си Най-доброто