Резюме
Заден план
При хора и животински модели прекомерният прием на хранителни мазнини, фруктоза и холестерол е свързан с развитието на безалкохолна мастна чернодробна болест (NAFLD). Индивидуалните роли на хранителните компоненти обаче остават неясни. За да изследваме това допълнително, сравнихме ефектите от диета с високо съдържание на мазнини, диета с високо съдържание на фруктоза и комбинирана диета с добавен холестерол върху развитието на NAFLD при плъхове.
Методи
Четиридесет мъжки плъхове Sprague – Dawley бяха рандомизирани в четири групи, получаващи или контролна диета (Контрол: 10% мазнини); диета с високо съдържание на мазнини (HFD: 60% мазнини, 20% въглехидрати), диета с високо съдържание на фруктоза [HFr: 10% мазнини, 70% въглехидрати (главно фруктоза)] или богата на мазнини/с високо съдържание на фруктоза/с висок холестерол -диета (NASH: 40% мазнини, 40% въглехидрати (главно фруктоза), 2% холестерол) в продължение на 16 седмици.
Резултати
След 16 седмици чернодробната хистология разкрива обширна стеатоза и възпаление както при плъхове, хранени с NASH, така и при HFD, докато чернодробните промени при HFr-плъховете са много по-фини. Тези открития се потвърждават от значително повишено съдържание на чернодробни триглицериди и в двете NASH- (стр
Заден план
Безалкохолната мастна чернодробна болест (NAFLD) представлява все по-разпространено чернодробно заболяване и се предполага, че е чернодробната проява на метаболитния синдром [1]. Понастоящем NAFLD приема пропорции на епидемия, засягащи над 25% от населението на света, вероятно свързани с едновременно нарастване на разпространението на затлъстяване и диабет тип 2 [2], въпреки че нарастващ дял от хората с нормално тегло също са засегнати, сочещи към дислипидемия като важен независим рисков фактор [3]. NAFLD обозначава широк спектър от чернодробни патологии, вариращи от проста чернодробна стеатоза до напреднал неалкохолен стеатохепатит (NASH), който без намеса може да премине към цироза и хепатоцелуларен карцином, изискващи трансплантация. Докато простата чернодробна стеатоза се характеризира главно с натрупване на липиди в> 5% от хепатоцитите, NASH е състояние, допълнително усложнено от лобуларни възпалителни инфилтрации и наличие на балониращи хепатоцити със или без съпътстваща фиброза [4].
Предполага се, че прогресията през етапите на NAFLD включва множество неблагоприятни „удари“, където както чернодробното възпаление, така и оксидативният стрес са ключови фасилитатори [5]. Съответно, установено е, че серумните и чернодробните нива на възпалителни цитокини като тумор-некротичен фактор алфа (TNF-α) и моноцит-хемоаттрактант протеин-1 (MCP-1) са повишени при пациенти както с проста чернодробна стеатоза, така и с NASH [6, 7,8,9]. Също така е доказано, че гликопротеините хаптоглобин и тъканният инхибитор на металопротеиназа 1 (TIMP-1) са повишени в плазмата на пациенти с по-напреднали стадии на NAFLD и поради това наскоро се предлагат като полезни клинични плазмени биомаркери, показателни за балонирането на хепатоцитите и чернодробна фиброза, съответно [10, 11].
Въпреки че специфичната етиология на NAFLD остава неясна, хранителните мазнини и холестеролът са свързани с развитието на чернодробна стеатоза и NASH както при хора, така и при животински модели [12,13,14] и напоследък, забележимото увеличение на консумацията на прости въглехидратната фруктоза, се посочва като друг възможен фактор, допринасящ за това [15, 16]. Осъзнаването, че диетата е важен фактор за патогенезата на NAFLD, доведе до значително разнообразие от диетични животински модели, където по-голямата част (освен тези, базирани на хранителни дефицити) се основава на диета с високо съдържание на мазнини с различни нива на прости въглехидрати и холестерол [17, 18]. Въпреки това, индивидуалните роли на мазнините, въглехидратите и холестерола в развитието на NAFLD все още не са напълно ясни. По този начин, подобрената представа от проучвания върху животни за индивидуалния принос на мазнини, прости въглехидрати и холестерол към метаболитните и възпалителни характеристики на NAFLD е важна предпоставка за разбиране на сложността на заболяването при пациентите. Освен това, създаването на животински модели на NAFLD/NASH, които по-адекватно имитират човешка патология, ще бъде ценно при тестване на нови терапевтични средства за NAFLD/NASH.
Следователно целта на настоящото проучване беше да се сравнят ефектите от диети с високо съдържание на хранителни мазнини, диетична фруктоза или комбинирана диета с добавен холестерол върху развитието на NAFLD, дислипидемия и възпаление при плъхове Sprague – Dawley. Развитието на NAFLD беше оценено с течение на времето както хистологично, така и биохимично и количествената компютърна томография (qCT) беше използвана като неинвазивен маркер на чернодробна стеатоза, което позволява проследяване на прогресията на NAFLD през целия период на изследване.
Методи
Животни
Четиридесет мъжки плъха Sprague – Dawley са закупени от лабораториите на Charles River (Sulzfeld, Германия). Животните се аклиматизират за 2 седмици при пристигането им и са на възраст 12 седмици в началото на експеримента, с тегло приблизително 440–460 g. Те бяха настанени по двама на клетка с достъп до нехлорирана, некиселинна чешмяна вода и с неограничен достъп до стандартна гризачка за гризачи (Altromin 1324, Brogaarden, Дания) до започване на експеримента. Температурата в помещенията за животни се поддържаше на 20–25 ° C с цикъл светлина/тъмнина 12/12 часа, относителна влажност 30–70% и смяна на въздуха 8–15 пъти/час.
Експериментален дизайн
Проби от плазма
Взети са кръвни проби от сублингвалната вена при съзнателни животни, които не са гладували. Те бяха събрани в K3-EDTA микровети и след центрофугиране плазмата беше изолирана и държана при - 20 ° C до по-нататъшен анализ. Триглицериди (TG), общ холестерол (TC), липопротеинов холестерол с висока плътност (HDL-C), свободни мастни киселини (FFA), аланин аминотрансфераза (ALAT), аспартат аминотрансфераза (ASAT), хаптоглобин и β-хидроксибутират са измерени с помощта на Инструмент Cobas 6000 c501 (Roche Diagnostics GmbH, D-68296 Mannheim, Германия), съгласно инструкциите на производителя. Плазмените нива на MCP-1 и TIMP-1 бяха анализирани с помощта на мултиплекс анализ (K15179-C1, Mesoscale Discovery, MD, USA).
В допълнение, плазмените проби бяха събрани от 4-часови гладни животни на 15-та седмица (събрани 1 седмица преди 16-та седмица кръвни проби, за да се избегне нарушаването на гладно с параметрите на плазмените липиди) и анализирани за ендогенен инсулин и глюкоза. Проби за измерване на кръвната захар (10 µL) се събират в капилярни епруветки и се прехвърлят в 500 µL системен разтвор. Нивата на кръвната глюкоза се анализират, използвайки метода на глюкозната оксидаза в апарат Biosen (EKF Diagnostics, Barleben, Германия), съгласно инструкциите на производителя. Проби за ендогенни инсулинови измервания се събират в K3-EDTA микровети и след центрофугиране; плазма беше изолирана и анализирана, както беше описано по-рано [20]. Нивата на лептин са количествено определени с помощта на Milliplex анализ (RADPKMAG80-K, Merck, Hellerup, DK).
qMR и qCT
За да се определи общата маса на мазнините, всички животни са подложени на qMR сканиране след 8 и 16 седмици с помощта на EchoMRI анализатор на състава на тялото (EchoMRI, Хюстън, Тексас, САЩ). Измерванията на масата на мастната тъкан се извършват в съответствие с инструкциите на производителя и както е описано по-рано [21].
За да се оцени развитието и прогресията на NAFLD, бяха използвани qCT сканирания за количествено определяне на плътността на черния дроб като индиректна мярка за чернодробното съдържание на мазнини. QCT-сканиране на черния дроб се извършва след 8 и 16 седмици при анестезирани на изофлуран плъхове с помощта на CT-скенер Latheta (серия LCT-200, Aloka co. LTD, Токио, Япония). Промените в плътността на черния дроб бяха изчислени чрез изваждане на изходните стойности на qCT от стойностите на 8 и 16 седмица.
Чернодробна биохимия
Нивата на чернодробен TG, TC и чернодробен гликоген бяха анализирани върху хомогенизирана чернодробна тъкан, взета проба от левия страничен лоб с помощта на инструмент Cobas 6000 c501 (Roche Diagnostics GmbH 68206 Mannheim, Германия) в съответствие с инструкциите на производителя и както е описано по-горе [22].
Хистология
Възпалителни маркери в тъканите
Както е описано по-горе, черният дроб, епидидимните мастни депа и йеюналните сегменти се изрязват от животните веднага след умъртвяването и се съхраняват при - 80 ° C до анализ. Концентрациите на тъканни протеини в трите тъкани първо се определят с помощта на Pierce BCA Protein Assay Kit (Thermo Fisher Scientific, MA, USA) съгласно инструкциите на производителя. Впоследствие нивата на TNF-α и MCP-1 бяха определени в тъканни хомогенати с комплекти за ензимно свързан имуносорбентен анализ (ELISA) (AB100785 и AB100778; Abcam, Cambridge, UK), съгласно инструкциите на производителя. Абсорбцията беше отчетена с помощта на четец за микроплаки Spectramax 340PC384 при 450 nm (Molecular Devices, CA, USA).
Статистически анализ
Статистическите анализи бяха направени с помощта на GraphPad Prism версия 6.05 (GraphPad Software Inc., La Jolla, CA, USA). Предполагаше се, че данните са нормално разпределени и потвърдени чрез визуална проверка на qq-графики. В случай на сериозни отклонения от нормалността се извършват статистически анализи на логарифмично трансформирани данни (естествен логаритъм) или с използване на непараметрични тестове. Данните са представени като средна стойност ± SEM, с изключение на трансформирани в дневник данни, които са представени като геометрични средства с 95% доверителни интервали. Разликите в средните стойности между диетичните групи за всеки параметър бяха анализирани с помощта на еднопосочен ANOVA, повторни измервания на двупосочни ANOVA или тестове на Kruskal – Wallis, където е подходящо, и сравнение след 16 седмици на диетите. Корекциите Bonferroni или Dunn, съответно, бяха използвани за настройка за множество сравнения. Отклоненията в наборите от данни бяха идентифицирани и премахнати с помощта на функцията ROUT в GraphPad Prism. p-стойности
Резултати
Базовите характеристики за контролни, HFD, HFr и NASH-групи са дадени в таблица 2 и показват, че групите са били сравними в началото на изследването за всички параметри.
Ефекти от диетата върху телесното тегло, енергийния прием и разпределението на мазнините
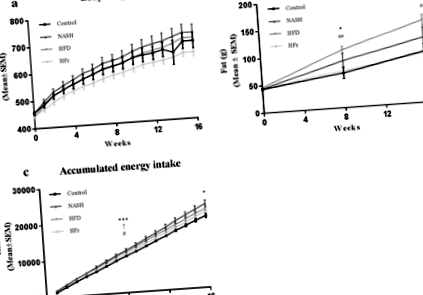
Фигура 1 показва промени в телесното тегло, мастната маса и енергийния прием. Телесното тегло се увеличава по време на проучването във всички групи, но не се различава от контрола след 16 седмици (фиг. 1а). Мастната маса беше значително увеличена при животни, хранени с HFD, в сравнение както с тези, хранени с Control, така и с HFr диети (стр Фиг. 1
Ефекти от диетата върху черния дроб
По време на проучването плътността на черния дроб (използвана като индиректна мярка за съдържанието на мазнини в черния дроб) непрекъснато намалява и при четирите диетични групи, измерена чрез qCT, като ефектът е най-изразен в групата на NASH (фиг. 2а). И на 8, и на 16 седмици намаляването на чернодробната плътност е значително по-голямо при NASH и HFD в сравнение с контрола (стр Фиг. 2
Черният дроб от плъхове, хранени с NASH, тежи значително повече в сравнение с контрола (стр Таблица 3 Метаболитни и възпалителни ефекти при плъхове след 16 седмици на NASH-, HFD- и HFr-диета
Хистологична оценка на чернодробни секции от контролни, NASH-, HFD- и HFr-хранени плъхове. Ред 1: представителни H & E-петна от нормален черен дроб от а Контролно хранени плъхове и чернодробна стеатоза през б Хранена с NASH плъх, ° С HFD-хранени плъхове и д HFr-хранени плъхове. Чернодробната стеатоза при плъхове, хранени с HFD, е почти изключително установена, че е микровезикуларна (° С); при плъхове, хранени с HFr, почти изключително макровезикуларни (д); докато стеатозата при плъхове, хранени с NASH, представлява междинно съединение между двете, както с макро-, така и с микровезикуларна стеатоза (б). Ред 2: по-голямо увеличение на представителните чернодробни секции, оцветени с H&E. д Чернодробната морфология изглежда нормална при контролно хранени плъхове, докато възпалителни инфилтрати са наблюдавани при черния дроб от е Плъхове, хранени с NASH, ж Плъхове, хранени с HFD и з Плъхове, хранени с HFr Ред 3: Маслено червени O петна от чернодробни секции от j Плъхове, хранени с NASH, к Плъхове, хранени с HFD и л Плъхове, хранени с HFr, потвърждават чернодробна стеатоза, наблюдавана през б-д. i Маслено червено O оцветяване на черния дроб от контролно хранени плъхове
Ефекти от диетата върху плазмените липиди и общото метаболитно състояние
Плазменият FFA не се различава между групите (Таблица 3). HFr-храненето индуцира значително увеличение на циркулиращия TG в сравнение с Control-, NASH- и HFD (стр
Дискусия
Настоящото проучване показва, че храненето на плъхове с високо съдържание на диетични мазнини или диетична фруктоза води до отчетливо различни чернодробни, метаболитни и възпалителни профили при плъхове. При сравняване на ефекта от хранителните мазнини и фруктоза, храненето с високо съдържание на мазнини по-мощно предизвиква развитие на мастен черен дроб и свързано с него чернодробно възпаление, без да се засяга циркулиращия липиден басейн. За разлика от това, храненето с високо фруктоза изглежда има най-силно изразени ефекти върху плазмения липиден профил, докато се наблюдават само фини ефекти върху черния дроб. Комбинацията от мазнини, фруктоза и холестерол изостря и засилва общите ефекти върху черния дроб. Силата на това проучване е директното сравнение на хранителните мазнини (с много ограничени количества въглехидрати) и диетичната фруктоза (с много ограничени количества мазнини) по параметри, свързани с NAFLD. Това дава възможност за по-подробна оценка на индивидуалните роли на тези макронутриенти в прогресията на заболяването. Освен това, използването на qCT позволява неинвазивна оценка на прогресията на NAFLD през цялото проучване, метод, който досега не е бил прилаган в проучвания при плъхове, сравняващ прогресията на NAFLD след прилагане на различни диети.
NAFLD при хората често се свързва със затлъстяване и инсулинова резистентност и тези метаболитни нарушения са по-отразени в HFD-групата. Съответно, само плъхове, хранени с HFD, затлъстяват и въпреки че кумулативният енергиен прием в тази група е преходно по-висок от контролните животни на 8-та седмица, разликите в енергийния прием вече не отчитат индуцираното от HFD затлъстяване след 16 седмици. Нивата на циркулиращ лептин също са значително повишени само при плъхове, хранени с HFD, което отразява увеличаването на размера на депото на мастната тъкан в рамките на тази група. Хипергликемия на гладно присъства във всички групи при прекратяване на проучването, което показва нарушения в метаболизма на глюкозата, въпреки че нивата на инсулин на гладно остават сходни между групите. Тези нарушения се потвърждават допълнително от повишените нива на чернодробен TG и намален/непроменен чернодробен гликоген, наблюдаван и при плъхове, хранени с NASH-, HFD- и HFr, показателни за селективна инсулинова резистентност [23].
Дислипидемията е един от белезите на метаболитния синдром и е доказано, че е силно свързана с NAFLD [36]. Дислипидемията, свързана с NAFLD, обикновено се характеризира с повишени нива на циркулиращ TG и липопротеинов холестерол с ниска плътност (LDL-C), както и намалени нива на HDL-C [37]. Само плъхове, хранени с HFr-диета, развиват дислипидемия, както се определя от наличието на хипертриглицеридемия. Предишни проучвания също установяват, че диетичната фруктоза мощно увеличава TG в плазмата за сравнително кратък период от време както при плъхове, така и при мишки [34, 38]. При плъхове се предполага, че това се дължи отчасти на способността на фруктозата както да увеличава чернодробната секреция на липопротеини с много ниска плътност (VLDL) -TG, така и да намалява клирънса на VLDL-TG от кръвообращението, дори при липса на хиперинсулинемия [39, 40]. Механично се предполага, че повишаването на секрецията на VLDL-TG е резултат от комбиниран ефект на индуцирани от фруктоза отговори на чернодробния стрес [40] и активиране на чернодробните ензими, участващи в синтеза на мастни киселини de novo (de novo липогенеза) [41 ].
Предполага се, че фруктозата и мазнините могат да предизвикат възпалителното им действие в черния дроб не само чрез диетично претоварване, но и чрез стимулиране на бактериален свръхрастеж в червата, повишаване на чревната пропускливост и по този начин улесняване на транслокацията на ендотоксини през чревната бариера, които след това се транспортират към черния дроб [46, 47]. В настоящото проучване не успяхме да открием повишени чревни нива на TNF-алфа или MCP-1 в никоя диетична група. Освен това не открихме повишени нива на MCP-1 и TNF-алфа във висцералната мастна тъкан в никоя от групите, въпреки че възпалението, особено в отделението на мастната тъкан, е силно свързано с NAFLD/NASH при хората [48]. За отбелязване е, че цитокиновите анализи в това проучване са извършени върху епидидимални мастни депа, които може да не представляват адекватно висцерални депа на мастна тъкан при хора [49].
Заключение
Изглежда, че диетичните мазнини основно стимулират развитието на NAFLD при плъхове Sprague – Dawley с мощни ефекти върху натрупването и възпалението на черния дроб, докато диетичната фруктоза засяга предимно циркулиращите липиди с много по-фини ефекти върху черния дроб. Комбинирането на мазнини, фруктоза и холестерол ускорява развитието на NAFLD и увеличава общата тежест на промените, наблюдавани в черния дроб.
- Диетични фактори при нивата на кръвната захар на гладно и наддаването на тегло при женските плъхове Даули Sprague
- Идеи за мазна черна вечеря Какво да ядем за NAFLD
- Копирайтър за Nutritional; Диетични добавки, съставяне на вашето копие за продажба
- Диетични фибри
- Диетичните риби като основен компонент на диетичния ефект за отслабване върху серумните липиди, глюкозата и