Хуей Лин Чуа
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
П. Артур Плет
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
Карол Х. Сампсън
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
Мандар Джоши
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
Ребека Табей
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
Бари Кац
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
Томас Дж. Маквити
† Университет на Мериленд в Медицинското училище в Балтимор, Балтимор, MD, САЩ
Кристи М. Оршел
* Медицинско училище в Индиана, Индианаполис, IN, САЩ
Резюме
ВЪВЕДЕНИЕ
Нарастващата заплаха от терористични събития, включващи радиация, както и потенциалът за радиационни аварии, подчертава необходимостта от медицинска готовност за управление на жертвите на радиация. В зависимост от абсорбираната доза на облъчване и вида на експозицията, терапевтичните стратегии и непосредствените и дългосрочните клинични резултати ще се различават при жертвите. Докато леталната доза за 50% от хората на 60 дни след експозицията (LD50/60) се оценява на 3,5-4,5Gy (Lushbaugh 1969, Vriesendorp и Van Bekkum 1984), това може да бъде удължено до 6-7Gy, когато антибиотиците и течностите се предоставят като поддържаща грижа (Dainiak 2002). Експозициите над 10Gy водят до бърза смърт поради обширни неврологични и стомашно-чревни увреждания. Експозициите между 1 и 10Gy засягат предимно хемопоетичната система, една от най-силно пролиферативните и по този начин радиочувствителни тъкани в човешкото тяло. Радиационното увреждане на хематопоетичната система води до това, което е известно като хематопоетичен синдром на острия радиационен синдром (H-ARS), с доста доброкачествени симптоми в долния край на диапазона, но вероятна смърт поради тежка неутропения и тромбоцитопения при по-високата край.
Хематопоетичните стволови клетки (HSC) са специализирана група от редки клетки на костния мозък (BM), които притежават две уникални качества, отличаващи ги от другите BM клетки: 1) способността да се диференцират в хематопоетични клетки-предшественици (HPC), които пораждат зрели клетки, принадлежащи на всички линии, съдържащи образуваните елементи на кръвта (неутрофили, тромбоцити, еритроцити и т.н.), и 2) способността да се самообновява, процес, при който HSC се разделя и поражда дъщерна HSC със сходен хематопоетичен потенциал като HSC (Till and McCulloch 1961, Abramson et al. 1977, Visser et al. 1984, Jones et al. 1989, Jones et al. 1990). Смята се, че чрез тези два процеса HSC са способни да поддържат хемопоеза през целия живот и да възстановят нормалните функции на BM след трансплантация, излагане на радио- или химиотерапия или нежелана висока доза йонизираща радиация (Till and McCulloch 1961, Visser et al. 1984, Jones et al. 1990, Keller and Snodgrass 1990). Примитивните мозъчни хемопоетични клетки-предшественици (HPC) също водят до поява на тимусни предшественици, които напускат BM и засяват тимуса, за да инициират възстановяване на имунната система (Kondo et al. 1997, Perry et al. 2003, Perry et al. 2004). Загубата на HSC и HPC са крайните причини за заболеваемост и смъртност при H-ARS.
Целта на настоящите проучвания е да се определи степента и естеството на дългосрочните увреждания на хемопоетичната система и HSC отделението при оцелелите от летално облъчване и до каква степен това увреждане допринася за RBMD. Очаква се констатациите да доведат до по-добро разбиране на механизмите зад RBMD и последствията от RBMD, тъй като жертвите на радиация стареят, с важната цел да се разработят потенциални медицински противодействия за облекчаване на това изтощително състояние.
МЕТОДИ
Мишки, радиация, дозиметрия и отглеждане
Информация за облъчени (TBI) и съпоставени с възрастта не облъчени (не-TBI) контролни мишки C57Bl/6 (CD45.2 +), анализирани в тези проучвания, както и отглеждане, облъчване, дозиметрия и мониторинг на здравния статус са описани в придружаващата статия от Plett et al (в пресата). Получаващи мишки и донори на конкурентни клетки, използвани в проучвания за трансплантация на костен мозък, са вродени мъжки или женски Ptrc a Pep3 b/BoyJ (B6.BoyJ; CD45.1 +) или F1 хибрид на мишки C57Bl/6 и B6.BoyJ (CD45. 2 +/CD45.1 +). B6.BoyJ и F1 хибридите са били отглеждани вътрешно и са използвани между 8-12 седмична възраст. Всички проучвания са одобрени от Институционалния комитет по грижа и употреба на животните в Университета в Индиана.
Експериментален дизайн
Проточни цитометрични анализи
Клетките на костния мозък, експресиращи фенотип на клетъчната повърхност c-Kit +, Sca-1 +, родословие, CD150 + (клетки KSLCD150 +) представляват популация от клетки, силно обогатени за HSC потенциал (Kiel et al. 2005, Chen et al. 2008). По този начин избрахме да използваме този фенотип като предполагаемата ни популация на HSC в тези проучвания.
За анализ на хематопоетични популации, използващи SLAM маркери (Kiel et al. 2005, Chen et al. 2008) и статус на клетъчния цикъл, LDBM клетки от TBI или не-TBI мишки бяха оцветени за хематопоетични маркери, използвайки CD3-FITC, Gr1-FITC, B220 -FITC, Sca-1-PE, c-Kit-APC и CD150-PerCPCy5-5 антитела. Клетките бяха фиксирани за една нощ в 1% (v/v) формалдехид и след това оцветени с DAPI (Invitrogen, Eugene, OR) в някои експерименти.
Съдържанието на реактивни кислородни форми (ROS) в примитивни хемопоетични клетки се определя чрез предварително инкубиране на LDBM с C-DFDA (Invitrogen), последвано от оцветяване с CD3-APC, Gr1-APC, B220-APC, Sca-1-PECy7, c-kit-PE и CD150-PerCPCy5-5 антитела.
За да се определи донорният химеризъм при реципиенти на трансплантация, периферната кръв (PB) се получава чрез отрязване на опашката и се подлага на лизис на амониев хлорид (0,16 М NH4Cl, 0,01 М KHCO3). Lysed PB се оцветява с CD45.1-PE антитела за откриване на бели кръвни клетки с реципиентен произход (B6.BoyJ или F1 хибрид от мишки C57Bl/6 и B6.BoyJ) и CD45.2-FITC антитела за откриване на бели кръвни клетки на донорски произход (TBI или не-TBI C57Bl/6 мишки). За да се определи възстановяването на много линии при реципиенти на трансплантация след 6 месеца след трансплантацията, PB се оцветява с CD45.1-PE, CD45.2-PerCPCy5.5, CD8a-Тихоокеанско синьо, CD4-Alexa Fluor 647, B220-PE Texas Red и Gr1-FITC.
Всички протоколи за оцветяване на антитела се провеждат в продължение на 30 минути при 4 ° С, последвано от промиване (1% говежди телешки серум/PBS) чрез центрофугиране при 2000 об/мин при 4 ° С. Провежда се цитометричен анализ с използване на системи FACScan или LSRII [Becton Dickinson Immunocytometry Systems (BDIS), Сан Хосе, Калифорния]. Всички антитела са закупени от BD Biosciences (Сан Хосе, Калифорния) с изключение на CD150-PerCPCy5.5 (Biolegend, Сан Диего, Калифорния) и Sca-PECy7 (eBiosciences, Сан Диего, Калифорния). Приблизително 1,0 до 2,0 × 10 5 събития бяха придобити за химеризъм и анализ на родословието, а 0,2 до 1,0 × 10 6 събития бяха придобити за примитивно хемопоетично клетъчно фенотипиране и анализ на клетъчния цикъл.
Сортиране на поточна цитометрична клетка
LDBM (3 до 20 × 10 6) от TBI или не-TBI мишки се оцветяват с CD3-FITC, B220-FITC, Gr1-FITC, Sca-1-PE, c-Kit-APC и CD150-PerCPCy5.5 антитела и сортирани за KSLCD150 + клетки, използвайки системи FACSVantage SE или FACSAria (Becton Dickinson, Franklin Lakes, NJ) или Reflection (iCyt, Champaign, IL). Изградена е основна порта за разсейване на светлина, която се използва за визуализиране на клетки, изразяващи маркери на родословието. Втора порта е конструирана около отрицателни по линия клетки и се използва за визуализиране на клетки c-Kit + и Sca-1 + [клетки c-Kit + Sca-1 + lin - (KSL)]. За изследване и сортиране на CD150 + клетки беше използвана последна порта, определяща KSL клетки. KSLCD150 + клетки бяха събрани в IMDM (Lonza, Walkersville, MD), съдържащи 10% (v/v) фетален говежди серум (Atlanta Biologicals, Lawrenceville, GA).
Дългосрочна конкурентна трансплантация
Пречистени KSLCD150 + клетки от TBI или не-TBI мишки (C57Bl/6) бяха получени чрез поточно цитометрично сортиране на клетки и 150 от тези клетки бяха трансплантирани интравенозно заедно с 1.0 × 10 5 вроден конкурент LDBM (B6.BoyJ или F1 хибрид на C57Bl/6 и мишки B6.BoyJ) в вродени реципиенти (B6.BoyJ или F1 хибрид на мишки C57Bl/6 и B6.BoyJ), които са били смъртоносно облъчени с разделена доза от 700cGy, последвана от 400cGy 4 часа по-късно, за общо 1100cGy. Използването на вродени хибриди C57Bl/6, B6.BoyJ и F1 в конкурентни изследвания за трансплантация на BM е описано по-рано от нас (Plett et al. 2002, Plett et al. 2003) и други (Hoggatt et al. 2009). На получателите беше предоставена доксициклин чау и вода от неомицин, започващи една седмица преди трансплантацията и продължаващи един месец след това. PB се анализира на месечни интервали до 6 месеца за донорски химеризъм и за възстановяване на родословната линия на 6 месеца след трансплантацията.
Анализи на хематопоетични родови клетки
1,0 × 105 LDBM клетки бяха суспендирани в два екземпляра в 1 ml метилцелулозна среда, съдържаща хематопоетични растежни фактори фактор на миши стволови клетки, миши интерлевкин-3, рекомбинантен човешки интерлевкин-6 и рекомбинантен човешки еритропоетин (Methocult M3434, Stem Cell Technologies, Vancouver, Пр. Н. Е., Канада). Културите бяха инкубирани в 100% овлажнен 5% CO2 във въздуха при 37 ° C и изброени 13 дни по-късно за колонии CFU-GM, BFU-E и CFU-GEMM под светлинен микроскоп, използващ бензидинов разтвор за визуализиране на BFU-E колонии. (Кларк и Хусман 1977).
Анализи на колонии преди B
1.0 × 105 LDBM клетки бяха суспендирани в два екземпляра в 1 ml метилцелулозна среда, съдържаща рекомбинантен човешки IL-7 (MethocultvM3630, Stem Cell Technologies, Ванкувър, Британска Колумбия, Канада). Културите бяха инкубирани в 100% овлажнен 5% CO2 във въздуха при 37 ° C и изброени 7-8 дни по-късно за пре-В лимфоидни колонии.
Статистически анализи
Използвани са двупосочни ANOVA модели за изследване на връзката на групата на лечението и месеците след облъчването с тегло, химеризъм на донора, клетъчност на BM, параметри на CBC, честота и брой на предшественика на мишка, процент и брой на мишка от примитивни хемопоетични клетки на BM, KSL и KSLCD150 +) и% G0G1 от lin-, KSL и KSLCD150 +. За всеки параметър този анализ сравнява TBI и не-TBI мишки след коригиране за времето. По този начин сравненията включват всички мишки, а не множество сравнения между малки групи мишки в отделни моменти от време. Взаимодействието между групата на лечението и месеците след облъчването също е изследвано при всички модели.
РЕЗУЛТАТИ
Тегло на тялото и CBC
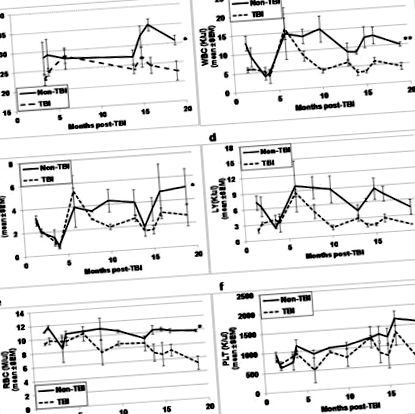
Визуално TBI и non-TBI не се различават на външен вид, освен че козината на мишките с TBI е много по-светла и по-сива на цвят в сравнение с тази на мишки, които не са TBI. Преди евтаназия за анализи на HSC и HPC в различните периоди след експозицията, мишките с TBI и без TBI се претеглят и кръвта се събира чрез изрязване на опашки за CBC анализи. Докато телесното тегло (Фиг. 1а) и всички CBC параметри (Фиг. 1b-1f) на TBI мишки изглеждаха подобни на тези на не-TBI мишки в ранните часови точки след експозиция, разликите във всички тези параметри станаха съвсем очевидни във времевите моменти повече от 10 до 13 месеца след TBI (p≤0,01). Докато телесното тегло и CBC параметрите обикновено се увеличават при не-TBI мишки с напредване на възрастта, всички параметри имат тенденция да намаляват при TBI мишки с възрастта.
Смъртоносно облъчени вродени миши реципиенти бяха трансплантирани със 150 KSLCD150 + клетки, изолирани или от TBI, или от не-TBI донори, заедно с 1,0 × 105 LDBM конкурентни клетки от вроден произход. Периферната кръв от опашките се получава от трансплантирани реципиенти на месечни интервали и се анализира чрез поточна цитометрия за определяне на донорен химеризъм, използвайки антитела срещу CD45.1 и CD45.2. Линиите представляват средна стойност ± SEM донорен химеризъм на 6 месеца след трансплантацията (с изключение на данните на месеци 3,5, 15 и 16, които представляват химеризъм в текущи експерименти, анализирани съответно на 4, 3 и 2 месеца след трансплантацията). * p Фиг. 5а), докато KSLCD150 + клетки от не-TBI мишки (Фиг. 5b), или конкурентни клетки, ко-трансплантирани или с TBI (Фиг. 5в), или не-TBI (Фиг. 5г) KSLCD150 + клетки, осигуряват нормален модел за възстановяване на родословието при реципиенти. Тези данни показват, че TBI HSC вероятно никога няма да възвърне пълния HSC потенциал по време на живота на облъчения оцелял. Интерес и в съгласие с други (Morrison et al. 1996, Kim et al. 2003), HSC от възрастни не-TBI мишки показва изкривяване към миелоидния произход, както се вижда от по-голям процент от получените от донори гранулоцити към 13 месец в сравнение до по-ранните месеци (фиг. 5б).
Мишки, трансплантирани с TBI или не-TBI KSLCD150 + клетки на Фигура 4, бяха анализирани за възстановяване на произхождащата от донори линия на 6 месеца след трансплантацията. Периферната кръв от опашките беше оцветена с флуоресцентно маркирани антитела към CD45.1, CD45.2, CD4, CD8, B220 и Gr1 и анализирана чрез поточна цитометрия за CD4 + и CD8 + Т клетки, получени от донори или конкуренти, В клетки, и гранулоцити. Панел а изобразява възстановяването на линия от 150 KSLCD150 + клетки от TBI донори (изразено като процент от общите TBI донорски клетки). Данните за месеци 2, 8 и 10 в панел а са n = 1, тъй като мишките, трансплантирани с клетки TBI KSLCD150 +, често не показват достатъчно висок донорен химеризъм, за да позволят по-нататъшно фенотипиране на родовите клетки. Панел b показва възстановяването на линия на 150 KSLCD150 + клетки от не-TBI донори (изразено като процент от общите клетки, които не са TBI донори). Панели c и d показват възстановяване на линията от вродени конкурентни клетки (изразени като процент от общите конкурентни клетки), които са били ко-трансплантирани съответно с KSLCD150 + от TBI или не-TBI донори, което действа като вътрешен стандарт за нормално възстановяване на родословната линия. . Пръчките представляват средно ± SEM; n = 1-7 мишки получатели на група за времева точка.
Анализ на клетъчния цикъл
TBI и не-TBI мишки бяха умъртвени по различно време между 1.5 и 16 месеца след експозиция и KSL клетките на костния мозък бяха анализирани чрез поточна цитометрия за ROS съдържание, използвайки C-DFDA. Стълбовете представляват средната стойност ± SEM на средната интензивност на флуоресценция (MFI) на C-DFDA на C-DFDA + KSL клетки; * p Фиг. 2h). Повишена експресия на CD150 върху HPC от облъчени мишки е докладвана от други (Simonnet et al. 2009), макар и в по-ранни моменти след експозицията. Въпреки че функцията на CD150 върху HSC е неизвестна, CD150 е известно, че се регулира от цитокини и LPS в лимфоидните клетки (Sidorenko and Clark 1993) и регулира AKT и/или ERK1/2 (Yurchenko and Sidorenko 2010), което предполага възможни роли в оцеляване на клетките (Yurchenko et al. 2011). Възможно е хроничното повишаване на CD150 в HSC от облъчени мишки да отразява пост-експозиционното хронично възпалително състояние и може да бъде защитен механизъм за опит за контрол на апоптозата на клетките, увредени от облъчване.
И накрая, оценява се, че моделите TBI не имитират ядрения терористичен сценарий или други неконтролирани ядрени събития. Екранирането на мястото на радиационната авария вероятно ще възникне поради физически препятствия между жертвата и източника, тежко облекло или телесни тъкани. Това екраниране ще позволи щаденето на някои HSC, които могат да помогнат за възстановяване от острите ефекти на радиацията. Защитните ефекти на екранирането на част от хемопоетичната система върху острата леталност са докладвани още през 1949 г., когато Jacobsen et. ал. (Jacobsen et al. 1949) показа, че LD50 при мишки може да бъде увеличен от 5.50Gy на 9.75Gy чрез предпазване на далака. Други проучвания показват защита чрез предпазване на един крак или опашка при мишки (Robinson et al. 1965, Carsten and Bond 1968, Carsten and Bond 1969). По този начин екранирането може също да повлияе на проявите на RBMD. Такива проучвания са извън обхвата на настоящия документ, но ще бъдат разгледани в текущите проучвания за „частично облъчване на тялото“ (PBI), при които 5% от мишката BM е защитена от облъчване. Въздействието на PBI в други моделни системи е отчетено в други статии на други места в този брой (в пресата).
ЗАКЛЮЧЕНИЯ
Взети заедно, тези данни предполагат, че увеличеното циклиране сред примитивните хематопоетични клетки при оцелелите от смъртоносна радиация може да допринесе за изтощаването на хематопоетични стволови клетки, продължително имунно потискане и последващо RBMD. Тези данни документират, че функцията на хематопоетичните стволови клетки остава силно депресирана при смъртоносно облъчени мишки до 19 месеца след експозицията, а „вторият удар“ на стареенето допълнително компрометира и без това недостатъчната функция на HSC при тези мишки.
1,0 × 105 LDBM от TBI и не-TBI мишки, изолирани между 1,5 и 19 месеца след експозицията, бяха суспендирани в два екземпляра в 1 ml метилцелулозна среда, съдържаща muSCF, muIL-3, rhuIL-6 и rhuEPO (за хематопоетични родоначалници), или в 1 ml метилцелулозна среда, съдържаща рекомбинантен човешки IL-7 (за пре-В лимфоидни колонии). Клетките се инкубират в 100% овлажнен 5% СО2 във въздуха при 37 ° C и се изброяват 13 дни по-късно за CFU-GM, BFU-E и CFU-GEMM колонии, или 7 дни по-късно за пре-В лимфоидни колонии. Честотата на комбинираните CFU-GM, BFU-E и CFU-GEMM и общият брой на тях на мишка са показани съответно в панели a и b. Панелите c и d дават честотата и общия брой на пре-В лимфоидни колонии, съответно на мишка. Пръчките представляват средно ± SEM; p стойности, сравняващи не-TBI с TBI, са дадени на всяка фигура. n = 1-3 мишки на група за времева точка.
Благодарности
Финансиране:
Този проект е финансиран изцяло или частично с федерални средства от Националния институт по алергии и инфекциозни болести (Договорни номера HHSN266200500043C и HHSN272201000046C) и от Националния институт за сърце, белия дроб и кръв (Номер на наградата R01HL075660 на CMO), Национални институти на здравеопазването, Министерство на здравеопазването и хуманитарните услуги. Съдържанието е отговорност единствено на авторите и не представлява непременно официалните възгледи на Националните здравни институти.
Бележки под линия
Никой от авторите не е декларирал финансов конфликт на интереси.
- Управление на възстановяването при разстройство с преяждане в дългосрочен план
- Много жени имат дългосрочно отслабване след подгъване на корема, съобщава за пластична и реконструктивна хирургия
- Съсиреци на краката (известна още като дълбока венозна тромбоза) непосредствена и дългосрочна опасност за здравето - Харвардски здравен блог
- Италиански модел се зарича да даде 19 милиона мъже орален секс Мъжко здраве
- Как да получим тяло като модел на бельо - Business Insider