Лукас Х. Хофмайстер
1 отдел по клинична фармакология, Медицински факултет на университета Вандербилт, Нешвил, Тенеси, САЩ
Стоян Перишич
2 Интердисциплинарен център за клинични изследвания и Катедра по нефрология и хипертония, Universitätsklinikum Erlangen и Friedrich-Alexander Universität (FAU) Erlangen-Nürnberg, Германия
Йенс Титце
1 отдел по клинична фармакология, Медицински факултет на университета Вандербилт, Нешвил, Тенеси, САЩ
2 Интердисциплинарен център за клинични изследвания и Катедра по нефрология и хипертония, Universitätsklinikum Erlangen и Friedrich-Alexander Universität (FAU) Erlangen-Nürnberg, Германия
Резюме
Последните доказателства от химическия анализ на тъканния електролит и състава на водата показват, че съдържанието на Na + в тялото при експериментални животни не е постоянно, не винаги се уравновесява лесно с вода и не може да бъде контролирано изключително от процеса на пречистване на бъбречната кръв. Вместо това големи количества Na + се съхраняват в кожата и в скелетните мускули. Количественото неинвазивно откриване на резервоари с Na + с 23NaMRI предполага, че това мистериозно съхранение на Na + е не само любопитство на изследователските животни, но съществува и при хората. В клинични проучвания съхранението на Na + в тъкани е тясно свързано с есенциална хипертония. При експерименти с животни модулирането на съдържанието на Na + в резервоарната тъкан води до предсказуеми промени в кръвното налягане. По този начин наличните доказателства предполагат, че патологичният (?) - физиологичен процес на съхранение на Na + може дори да е от значение за човешкото здраве и болести.
Феноменът на извънбъбречното съхранение на Na + е подробно разгледан наскоро [29,10,27,30,28]. Смятаме, че друг преглед на наличните доказателства би плагиатствал тези обобщения. Ето защо накратко изтъкваме допълнителни скорошни доказателства в подкрепа на идеята, че кръвното налягане се регулира в кожата, а след това се фокусираме върху все още много ограничената информация за образуването на електролитен градиент в кожата.
Регулиране на кръвното налягане: само кожата в дълбочина и свързана с метаболизма на електролитите в кожата?
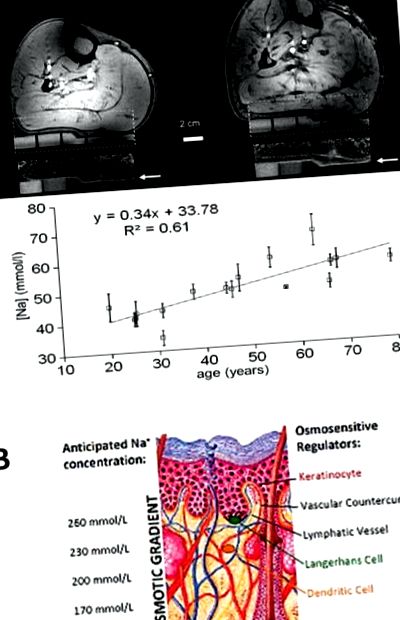
Панел А. 1 H/23 Na MR изображения на човешка телешка кожа. Вляво: 1H изображение (отгоре и 23Na MR изображение (отдолу) на долния крайник на 25-годишен мъж. Вдясно: същата процедура за изображения при 67-годишен мъж. При силна сила на полето от 7T, кожата (маркирана с стрелки) е много добре очертана в изображенията с ЯМР 23Na, които също показват стандартите на агарозен гел с нарастващо съдържание на Na + (бяло). Na + се натрупва главно в или директно под епидермиса. Количественият анализ показва, че съхранението на сол в този епидермис/субепидермален слой се увеличава с възрастта. Адаптиран от Linz et al., [Ref 16], с разрешение. Панел B. Предложена концентрация на електролит в противотечащата система на кожата. Кератиноцитите изпомпват Na + в дермата, създавайки повишена концентрация на Na + в горната част на дермалната папила, където се намират клетките на Лангерханс и дендритните клетки. Дермалната папила се влива с кръвосъдова противотокова система, която допълнително ще концентрира интерстициални електролити в дермалната папила и с дренираща лимфо-капилярна система, което ще намали интерстициалните електролити чрез лимфен дренаж. Имунните клетки, пребиваващи в различните слоеве с различни концентрации на електролити, могат да действат като физиологични регулатори на холеостазата на електролита на кожата.
Въпреки че тези подробности показват, че кожата може да функционира като „бъбречноподобна“ противотокова система, физиологични проучвания върху концентрацията на електролити от противоток в кожата изненадващо не са провеждани. Тук използваме наличната оскъдна информация за микроанатомията на разпределението на електролитите в кожата, която според нас подкрепя хипотезата, че кожата действа като функционална противотокова система. Механизмът на противотока може да позволи на кожата да контролира диференцирано собствената си микросреда, създавайки хиперосмолална биологична бариера, предназначена да предотврати загубата на интерстициална течност, както беше предложено от Тейлър и колеги по-рано [32,33].
Избор на данни
Проверихме литературата за налични измервания на концентрацията на електролит в кожата вътре и под кератиноцитния слой на кожата. Wei et al. изследва разпределението на елементите в кожата на морски свинчета чрез рентгенов анализ със сканираща електронна микроскопия и предоставя данни за нивата на Na +, K + и хлор в епидермиса и дермата. Авторите посочват, че „хлорираните въглеводороди, които се срещат в микроскопската колона, могат да замърсят пробите по време на рентгенова микроанализа.“ [34] Следователно, ние не включихме данни за хлоридите и ограничихме анализа на нашия модел до Na + и K +. Сравнимо образуване на градиент Na + и K + се наблюдава по-късно при проучвания на човешка кожа [33,7,1,18]. По този начин предполагаме, че избраните данни могат да предоставят представителна проба за образуване на електролитен градиент на кожата в кожата на бозайниците.
Представяне на данни, генериране на модел и ограничения
Електронният сонда анализ на съдържанието на Na + и K + в кожата не може да прави разлика между вътреклетъчна или извънклетъчна микросреда. В опит да се обърнем към енергийните аспекти на потенциалното образуване на Na + и K + градиент в епидермиса, ние формирахме три опростени теоретични модела на електролитния състав на кожата (фиг. 2А). Общото предположение е, че петте измерени слоя на кожата (stratum corneum, stratum granulosum, stratum spinosum, stratum germinativum и dermis) представляват четири следващи бинарни подсистеми, разделени от теоретични полупропускливи мембрани (фиг. 2Б). Нашият модел предполага, че всички съседни слоеве съдържат вода като идеален разтворител, в който Na + и K + могат лесно да се уравновесят. Wei et al измерват микроанатомичното разпределение на съдържанието на епидермален електролит в mmol/kg тегло на влажна тъкан [34]. За да прехвърлим тези измервания на съдържанието на електролит в приближения на концентрацията на електролит в епидермалните слоеве, използвахме три различни модела.
Панел А - представлява хистоморфологичните образувания на кожата, със съответните дебелини на слоевете (адаптирани от справка [25], с разрешение). Панел Б - предложени модели, които до голяма степен влияят върху колигативните свойства в кожните слоеве. Модел 1 - двата слоя се считат за идеални решения. Модел 2 - твърдото вещество в слоя представлява 50% от обема на слоя, като идеалното решение запълва втората половина. Модел 3 - епидермалните слоеве се държат като идеално решение, докато дермата се състои от 50% твърдо вещество и 50% идеален разтворител. Панел C - предложени концентрации на K + и Na +, произтичащи от моделите, показани в панел B, и измервания, извършени в лиофилизирани кожни участъци. Оригиналните измервания са от Wei et al., Справка [24].
Модел 1 приема, че всеки измерен слой на кожата представлява идеализиран разтворител. Използваме оригиналните данни, които са докладвани в mmol/kg тъкан, и ги изразяваме като mmol/dm 3 течност във всяко измерено отделение (Фиг. 2B). Моделът не може да прави разлика между разликите в концентрациите на Na + и K + между вътре- и извънклетъчното пространство във всеки слой. Той не взема предвид никакво вътреклетъчно или извънклетъчно разделяне на течните пространства и по този начин също пренебрегва, че може да има разлики в ефективността на разтвореното вещество при генериране на осмотична движеща сила (обикновено индексирана от коефициента на отражение). Тъй като този модел също пренебрегва присъствието на твърдо вещество вътре в клетките и в извънклетъчния матрикс, той ще подцени действителните концентрации на електролити във водното пространство. Сравними предположения са направени по-рано от Warner et al. [32,33].
За разлика от Модел 1, Модел 2 допълнително взема предвид, че клетките и извънклетъчният матрикс се състоят от вода и твърдо вещество. Предполага се, че двата слоя се състоят от 50% твърдо вещество и от 50% вода, което представлява идеализиран разтворител, където всички Na + и K + се разтварят и лесно се уравновесяват. Подобно на модел 1, няма разлика между вътреклетъчното и извънклетъчното пространство в слоевете. Моделът отново не отчита никакво вътреклетъчно или извънклетъчно разделяне на течните пространства и пренебрегва потенциалните разлики в коефициентите на отражение. Следователно в сравнение с модел 1, този модел се характеризира с двукратно увеличение на концентрациите на Na + и K + в идеализирания разтворител (фиг. 2Б).
Подобно на Модел 1, Модел 3 предполага, че всеки от епидермалните кератиноцитни слоеве представлява идеализиран разтворител без твърдо вещество. Подобно на Модел 2, дермата, която е богата на извънклетъчен матрикс, ще се състои от 50% твърдо вещество и 50% разтворител. Няма дискриминация между вътреклетъчното извънклетъчно пространство, пренебрегвайки разделянето на водата или електролитите.
Изчисляване на енергията на Гибс
Първо, ние се опитахме да определим дали концентрациите на електролити, измерени от Wei et al, могат да бъдат причинени от пасивно натрупване на електролити в кожата или от активно установен градиент. За да направим това, сметнахме, че енергията на Гибс (ΔG 0, уравнение 1) показва съхранената енергия в системата.
където ci е моларна концентрация (моларност) на електролита в бинарни слоеве 1 (′) и 2 (″),
Съвършено неселективните мембрани ще дадат еквивалентни rNa и rK. Тази връзка се отнася за слоевете телесна течност, в които съотношенията на Na + и K + йони са еквивалентни и следователно ΔG 0 се доближава до нула. Това състояние е известно като идеалното равновесие на Донан и се интерпретира, че означава, че разделянето е мембранно неселективно. За клетките и тъканите, които извършват активна селекция на Na + и K + през мембраните, промяната в енергията на Гибс е различна от нула. Положителната промяна в ΔG 0 по този начин показва система в неравновесно състояние, изискваща вложена енергия, за да поддържа разликата. Както се вижда тук, електролитното разпределение в кожата води до положителна промяна в енергията на Гибс във всички модели при прехода от stratum germinativum към дермата (Фиг. 3 - 5B). Това предполага, че електролитният градиент в бинарната система на епидермиса/дермата е установен чрез активен транспорт. Наблюдаваме ΔG 0 почти нула в горните слоеве на кожата, където първоначално жизнеспособните епидермални клетки се мащабират и най-вероятно губят способността си активно да транспортират електролити.
(А) показва приблизителните моларни концентрации на Na + и K + (mmol/dm 3) през епидермалните слоеве (s. corneum, s. granulosum, s. spinosum и s. germinativum), дермата и в плазмата. (Б) показва промяната на енергията на Гибс (kJ/mol) в кожните слоеве и плазмата. (° С) представлява потенциала на клетъчната батерия на [Na +] или [Na + + K +] в mV, изчислени от стойностите, представени на графика (A), получени от нашия модел 1. (Д) представлява изчисленото осмотично налягане съгласно условията, определени от Модел 1.
(А) показва приблизителните моларни концентрации на Na + и K + (mmol/dm 3) през епидермалните слоеве (s. corneum, s. granulosum, s. spinosum и s. germinativum), дермата и в плазмата. (Б) показва промяната на енергията на Гибс (kJ/mol) в кожните слоеве и плазмата. (° С) представлява потенциалите на клетъчната батерия на [Na +] или [Na + + K +] в mV, изчислени от стойностите, представени на графика (A), получени от нашия модел 3. (Д) представлява изчисленото осмотично налягане съгласно условията, определени от Модел 3.
Изчисляване на електрическия потенциал
Докато енергията на Гибс може да бъде изчислена от измерими съотношения на йони, по-често срещаната практика е да се измерва електрически потенциал. Затова използвахме уравнението на Голдман (уравнение 2), за да изчислим теоретичната разлика в електрическия потенциал между слоевете, използвайки концентрациите от модели 1–3.
където F = 96500 C mol z = заряд [C] P = относителна пропускливост
В нашите модели приемаме, че относителната пропускливост на всеки йон е еквивалентна и следователно P = 1 както за Na +, така и за K +. Транспортът на Na + в кератиноцитите е от значение за генерирането на електролитен градиент в слоя germinativum [37]. Поради това разгледахме електрическия потенциал, причинен само от разпределението на натрий, както и потенциала, причинен от разпределението на натрий и калий. Както се вижда на графиките (фиг. 3 - 5С), зародишът/дермата на пласта може да генерира електрически потенциал от около 50 mV, като отрицателният знак се отнася до серума. Този резултат се потвърждава от експериментални измервания на транскутанните електрически потенциали, направени от Barker et al при морски свинчета [1]. Приемаме това като индикация, че лечението на съотношението електролит-вода на кожата в тези моделни системи дава физиологично значим резултат.
Изчисляване на осмотичното налягане
За да изчислим осмотичното налягане, използвахме уравнението на Морс за идеално решение на неразделни електролити:
ci - моларна концентрация (моларност) на електролита, R - универсална газова константа, T - температура, i - безразмерен фактор на Van’t Hoff.
Изчисленията се основават на следните допълнителни предположения: сумата от Na + и K + приближава общия брой катиони, присъстващи в идеално решение. Всяка двоична система от два съседни слоя е в състояние на равновесие. Пренебрегвайки образуването на електрически градиент, ние също така приемаме, че Na + и K + са придружени от равен брой съответни моновалентни аниони, което води до идеална дисоциация на осмолитите по следния начин:
Заключения
(А) показва приблизителните моларни концентрации на Na + и K + (mmol/dm 3) през епидермалните слоеве (s. corneum, s. granulosum, s. spinosum и s. germinativum), дермата и в плазмата. (Б) показва промяната на енергията на Гибс (kJ/mol) в кожните слоеве и плазмата. (° С) представлява потенциалите на клетъчната батерия на [Na +] или [Na + + K +] в mV, изчислени от стойностите, представени на графика (A), получени от нашия модел 2. (Д) представлява изчисленото осмотично налягане съгласно условията, определени от Модел 2.
Благодарности
JT се подкрепя от безвъзмездни средства от германското Федерално министерство на икономиката и технологиите/DLR Forschung unter Weltraumbedingungen (50WB0920), Интердисциплинарния център за клинични изследвания (IZKF Junior Research Group 2), NIH (RO1 HL118579-01), AHA (14SFRN20770008 ) и награда за клинична транслационна наука 1UL-1RR024975 от Националния център за изследователски ресурси.
- Загуба на тегло, свързана с инхибиране на натрий-глюкоза котранспортер-2 преглед на доказателства и
- Избелването на кораловия шепот и загубата на тъкани в коралите - какво; s Разликата
- Разбиране на бъбречната диета натрий
- Използвайте натрий, за да изглеждате пълни, съдови и разкъсани мускули; Фитнес
- Влиянието върху здравето на диетичния натрий и диетата с ниско съдържание на сол