Субекти
Резюме
Предишни проучвания идентифицират ролята на хипоталамусната глия в регулирането на енергийния баланс; тесният фокус на хипоталамуса обаче предоставя непълно разбиране за това как глията в мозъка реагира и регулира енергийната хомеостаза. Изследвахме отговорите на глията в дорзалния вагусен комплекс (DVC) на адипокин лептин и затлъстяване, предизвикано от диета с високо съдържание на мазнини. DVC астроцитите функционално експресират лептиновия рецептор; in vivo фармакологични проучвания показват, че DVC астроцитите частично медиират аноректичните ефекти на лептина при слаби, но не и индуцирани от диета плъхове със затлъстяване. Изображенията ex vivo с калций показват, че тези промени са свързани с по-нисък дял на клетки, реагиращи на лептин, в DVC на затлъстели животни в сравнение с слаби. И накрая, ние изследвахме отговорите на DVC микроглия и астроглия към нарушаване на регулацията на лептина и енергийния баланс in vivo: затлъстяването намалява DVC астроглиозата, докато липсата на лептинова сигнализация при плъхове Zucker е свързана с обширна астроглиоза в DVC и намалена хипоталамусна микро- и астроглиоза. Тези данни разкриват нова функционална хетерогенност на астроцитите в различни мозъчни ядра от значение за сигнализирането за лептин и регулирането на енергийния баланс.
Въведение
Поглеждайки отвъд хипоталамуса, дорзалният вагусен комплекс (DVC) на каудалния мозъчен ствол представлява друг възел на ЦНС при откриването, интегрирането и обработката на множество метаболитни и ендокринни сигнали, включително лептин 27,28,29. DVC се състои от ядро трактус солитариус (NTS), област postrema (AP) и дорзално моторно ядро на вагуса. Сигнализирането за рецептор на лептин в DVC потиска приема на храна и най-вече усилва потискащите ефекти на приема на сигнали за насищане в рамките на храненето (напр. Стомашно разтягане и холецистокинин) 28,30,31,32,33,34. Въпреки ясната роля на DVC в енергийната хомеостаза, много малко изследвания характеризират специфичните клетъчни фенотипове, които експресират LepR в DVC. Доказателствата за експресия на LepR върху NTS астроцити 35 доведоха до настоящата хипотеза, разследвана тук, че DVC глиите са основна клетъчна цел за централна лептинова сигнализация. Изследвахме експресията на LepR върху астроцитите в DVC и оценихме ролята на DVC астроцитите в медиирането на аноректичните ефекти на лептина. Нещо повече, ние изследваме влиянието на затлъстяването и пертурбациите в сигнализирането за лептин върху глиалния пейзаж както в DVC, така и в хипоталамуса.
Материали и методи
Животни
Плъховете мъжки Sprague Dawley (250–265 g, Charles River (UPenn) или Envigo (PBRC)) се поддържат или на стандартна чау (Purina Rodent Chow 5001; Ralston Purina Company, Сейнт Луис, Мисури) или на 60% високо съдържание на мазнини диета (HFD; Diet Diet D12492; Research Diets, New Brunswick, New Jersey) с либитум достъп до чешмяна вода. Диабетичните плъхове на Zucker (ZDF; Charles River) се поддържат на стандартна диета с чау. Животните бяха настанени еднократно в окачени телени клетки в контролирана от температура и влажност среда в обратен цикъл 12h: 12h светлина-тъмнина. Всички поведенчески експерименти бяха проведени в контрабалансиран, вътрешно-субективен дизайн, без да е необходимо рандомизиране. Всички експериментални процедури са проведени с одобрението на Институционалните комитети за грижа и употреба на животните в Университета на Пенсилвания и в Пенингтън.
Стереотаксични операции
Плъховете бяха анестезирани с интрамускулно инжектиране на кетамин (90 mg/kg; Butler Schein), ксилазин (2,7 mg/kg; Ветеринарна доставка в Средния Запад) и ацепромазин (0,64 mg/kg; Среднозападни ветеринарни доставки). Използвайки стереотаксична хирургия, плъховете бяха имплантирани с постоянна канюла (26-габаритна; Plastics One), насочена към 4-тия мозъчно-вентрикула (4V; координати: на средната линия, 2,5 mm отпред на тилния шев и 7,2 mm вентрално към черепа 36). (2 mg/kg мелоксикам) се прилага подкожно в продължение на 2 дни и животните се оставят да се възстановят в продължение на една седмица. Правилното разположение и проходимостта на канюлата са проверени преди поведенческо тестване чрез индуцирана от 5-тио-D-глюкоза (210 μg) хипергликемия като описани по-рано 37; тествани са само животни, които са преминали проверка.
Синтез и приложение на Cy5-белязан лептин
Рекомбинантен миши лептин (2,0 mg; NHPP) се разтваря в 500 μL 50 mM фосфатен буфер (рН 7,4) и внимателно се разклаща в незалепващи епруветки Eppendorf (Thermo Scientific, Cat. № 3451). Количество 0,2 mg сулфо-цианин 5 NHS естер (Lumiprobe, Cat. № 23320) се разтваря в 50 μL DMSO и след това се добавя към предварително разтворения лептин в 10-μL аликвотни части за 1 h. Реакцията се разбърква при стайна температура в продължение на една нощ, след което се пречиства, като се използва HPLC на Shimadzu Prominence с колона C18 (Eclipse XDB-C18 5μm, 4.6 x 150 mm) и градиент от [1% CH3CN/H2O + 0.1% до TFA] до [70 % CH3CN/H2O + 0,1% до TFA] за 15 минути. Продуктът е получен с а
Флуоресцентна in situ хибридизация на астроцитен LepR
За проверка на лептиновия рецептор върху DVC астроцити на плъх, едно животно (н = 1) е анестезиран за бързо отстраняване на мозъка и светкавично замразен в изопентан върху сух лед. Мозъкът беше разделен на криостат с дебелина 18 μm, монтиран на плъзгач и съхраняван при -80 ° C. Флуоресцентна in situ хибридизация (FISH) беше извършена с помощта на RNAscope Multiplex Fluorescent Reagent kit v2 (Cat № 323100; ACDBio, Hayward, CA) съгласно инструкциите на производителя. Откриването се извършва с помощта на сонди, проектирани от ACDBio за LepR иРНК (Rn-LepR-C1, Cat. № 415951), специфичен за астроцитите маркер Aldh1L1 (Rn-Aldh1L1-C2, Cat. № 459821-C2) и невронален маркер RbFox3 (Rn-RbFox3-C3, Кат. № 436351-C3). След поредица от стъпки на усилване, секции бяха монтирани с DAPI-съдържаща монтажна среда (Fluorogel; Fischer Scientific). Секциите бяха визуализирани с конфокален микроскоп Leica SP5 X с 40x обектив. Z-купчините изображения бяха събрани с размер на стъпка от 1 μm. Събраните изображения в z-stack бяха обработени с помощта на софтуера Imaris 8.1.2 (Bitplane).
Изображения на живи клетъчни Ca +2 на неврони и астроцити в препарати на NTS филийки
Плъхове мъжки Sprague Dawley (290–420 g; чау н = 4, HFD н = 3) са дълбоко упоени с уретан (1,5 g/kg, интраперитонеално; етил карбамат, Sigma; този анестетик е избран, тъй като лесно се измива от ex vivo филийки 38) и са поставени в стереотаксична рамка. С помощта на асептична техника са приложени 4 едностранни инжекции (по 40 nL) от 0,4% Cal520 (AAT Bioquest), 0,3% сулфородамин 101 (SR101; Sigma Chemical) и 10% плуроник-DMSO (F-127, Invitrogen) в нормален разтвор на Krebs в медиалния NTS. След 60 минути плъховете бяха обезглавени и мозъчният ствол беше бързо прибран. Предварително маркираните мозъчни стволове бяха нарязани на 300 μm коронални секции с помощта на вибриращ микротом (Leica VT1200) и потопени в студ (
4 ° C) карбоксигениран (95% O2; 5% CO2) разтвор за рязане. NTS филийките се поставят в нормален разтвор на Krebs и се барботират с 95% O2/5% CO2 при постоянна температура от 29 ° C. Разрезите бяха оставени да се уравновесят за 1 h преди изображения 39 .
Извършва се изобразяване на калций на живи клетки с предварително маркирани неврони и астроцити, както е описано по-рано 39,40,41. Предварително маркираните резени Cal-520/SR101 бяха прехвърлени в персонализирана камера за изображения 42. По-рано се съобщава за имунохистохимично потвърждение на специфичността на SR101 към астроцитите в DVC 43. Записващата камера непрекъснато се перфузира със скорост от 2.5 mL/min с нормален разтвор на Krebs ’(или съдържащ 100 ng/mL лептин) при постоянна температура от 33 ° C. Резените на заден мозък бяха разгледани с микроскоп Zeiss Axioskop 2 с фиксиран етап, оборудван с нормална оптика за епифлуоресценция, лазерна конфокална сканираща глава Yokogawa CSU21 и камера Hamamatsu ORCA-ER. Предварително маркираните клетки, които представляват интерес, бяха избрани визуално с епифлуоресцентна оптика и впоследствие конфокални изображения бяха заснети с ORCA-ER камера със скорост от 1 кадър в секунда.
Веднъж попаднали в камерата за запис, резените на задния мозък бяха перфузирани с нормален разтвор на Krebs за минимум 10 минути. Изображения с двойна експозиция (т.е. 488 nm и 591 nm) са събрани непосредствено преди всяко експериментално изпитване, за да се потвърди записването на клетъчните типове. След това всички филийки бяха предизвикани с коктейл от 100 μM ATP и 500 μM глутамат, за да се определи кои клетки в полето са жизнеспособни 39,44. Жизнеспособността се определя като минимално увеличение на флуоресценцията от 7% в отговор на предизвикателството АТФ/глутамат 45. След това филийките бяха изложени на разтвор на Krebs плюс 100 ng/ml лептин в продължение на 30 s. Промените във вътреклетъчните концентрации на калций в отговор на стимулите на лептин в Cal-520 предварително маркирани NST астроцити и неврони бяха регистрирани едновременно с помощта на 488-nm лазерна линия за възбуждане на Cal-520. Повишаването на вътреклетъчните концентрации на калций е идентифицирано като увеличаване на флуоресценцията и е интерпретирано, че представлява повишена клетъчна активност. По време на експериментални изпитания, проследяваните във времето снимки на смесени полета на NTS астроцити и неврони бяха наблюдавани за отговори на предизвикателството с лептин. Променени лазерни конфокални изображения на промени в вътреклетъчните нива на калций както на астроцитите, така и на невроните бяха заснети с ORCA-ER със скорост от 1 кадър в секунда.
Поведенчески експерименти
Плъховете се поддържат на всеки от стандартните чау (н = 10) или диета с високо съдържание на мазнини за 2 седмици (н = 7). Всички животни бяха имплантирани с канюла, насочена към 4-та камера (4V), за да се даде възможност за интрацеребровентрикуларно (icv) приложение. Периодът на възстановяване беше 1 седмица, през което време беше проверено поставянето на канюлата с хипергликемичен отговор на 5-TG 46,47. Бункерите за храна бяха премахнати и животните бяха претеглени приблизително 1 час преди началото на тъмнината. Тридесет минути преди началото на тъмнината, животните са получили 4V icv носител (0,1 M PBS) или 50 nmol флуороцитратна предварителна обработка (Sigma Aldrich 40,48,49,50), последвано от носител (0,1 M NaHCO3) или 5 μg/ml лептин (NHPP 51) . Флуороцитратът е добре установен фармакологичен агент, използван за временно инхибиране на цикъла на Kreb по специфичен за астроцитите начин 48,50,52,53,54. Избраната доза от 50 nmol флуороцитрат е установена като специфична за астроцитите 40,48. При тъмно начало бункерите за храна бяха заменени и кумулативният прием на храна беше регистриран на 1, 3, 6 и 24 часа. Теглото на тялото се записва на 0 и 24 часа след инжектирането. Експерименталните инжекции се разделят чрез период на измиване от 72 часа.
Имунохистохимичен анализ на глиозата
Статистика
Всички данни са представени като средна стойност ± стандартна грешка на средната стойност. Анализът на мощността беше проведен преди провеждането на експерименти с използване на алфа от 0,05 и 80% мощност. Сравненията в проучванията на qPCR бяха направени с помощта на еднопосочен дисперсионен анализ (ANOVA) с post hoc тестове на Dunnet. За изобразяване на калций на живо значимостта се определя чрез еднопосочен ANOVA с t-тестове на Bonferroni. Сравнението на процента на реагиращите клетки се извършва с помощта на точния тест на Fisher. За поведенчески сравнения на приема на храна и телесното тегло, ние приложихме повторна мярка съответно 3- или двупосочна ANOVA, съответно с post-hoc анализи на Neuman-Keuls. Статистическата значимост беше определена на стр
Резултати
Астроцитите на DVC експресират лептиновия рецептор
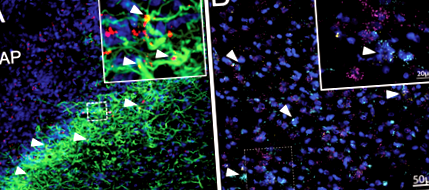
Експресията на лептиновия рецептор върху астроцитите на хипоталамуса е добре установена при плъхове и мишки 14, 15, 35, 59. Като допълнение, ние проведохме имунохистохимия, за да потвърдим експресията на LepR върху астроцитите на DVC при плъхове. След 4-та интрацеребровентрикуларна (4V) инжекция на флуоресцентно белязан лептин (4,5 ng Cy5-Lep), наблюдавахме колокализация с DVC астроцити (GFAP; зелено; фиг. 1а), предимно в субпостремата, границата на AP и NTS . Наличието на експресия на LepR върху астроцитите на DVC на плъхове беше открито чрез FISH, използвайки РНК-обхват. Експресия на mRNA на LepR (жълто) се наблюдава както върху невроните (магента), така и върху астроцитите (циан) в рамките на субпостремата и медиалния NTS (фиг. 1б; допълнително видео 1).
а Имунохистохимична визуализация на Cy5-Lep (4V icv 4.5 ng; червен), колокализиран в DVC астроцити (GFAP; зелен), DAPI в синьо; 63x изображение (вложка: 2x оптично увеличение). б FISH визуализация на страничния NTS (на нивото на AP) на LEP-Rb (жълт) експресия върху DVC астроцити (ALDH1L1; циан) и неврони (RbFox3; магента). Контраст с DAPI (син); 40x изображение (вложка: 3,4x оптично увеличение с гаусов филтър). Вижте Допълнително видео 1 за 3D ротационно изображение на областта, очертана от пунктираното поле.
Затлъстяването, предизвикано от диета с високо съдържание на мазнини, намалява процента както на DVC астроцитите, така и на невроните, показващи индуцирана от лептин Ca +2 сигнализация в препарати ex vivo на мозъчен ствол
За да охарактеризираме по-добре ролята на DVC астроцитите в енергийната хомеостаза, следващото изследване на индуцираните от лептин вътреклетъчни Ca +2 отговори в DVC неврони и астроцити в препарати ex vivo на мозъчен ствол (фиг. 2). Освен това изследвахме дали индуцираните от лептин отговори са променени от диетичния статус и затлъстяването (т.е. сравнение на сигнала Ca +2 в DVC на слаби плъхове, поддържани на стандартна чау или плъхове със затлъстяване, поддържани на 60% богата на мазнини диета) . Експерименти с изображения върху предварително маркираните филийки на задния мозък от плъхове, поддържани от чау (н = 4) даде 61 жизнеспособни неврони и 35 жизнеспособни астроцити; диети, поддържани с високо съдържание на мазнини (н = 3) даде 37 жизнеспособни неврони и 24 жизнеспособни астроцити.
Както невроните, така и астроцитите от слаби животни произвеждат жив клетъчен поток Са +2 (т.е. увеличаване на цитоплазматичния Са +2) в отговор на приложението на баня от 100 нг/мл лептин (фиг. 2ч). Поддържането на диета с високо съдържание на мазнини отслабва отговора на DVC неврон Ca +2, без да засяга реакциите на астроцитите (F3,62 = 4,072; стр = 0,01). Освен това животните, изложени на диета с високо съдържание на мазнини, са имали значително намаляване на процента на реагиращи на лептин неврони и астроцити в сравнение с слаби животни (фиг. 2i, j). В астроцитите това предполага потенциална промяна във функционалната експресия на LepR, а не промени в реакцията на лептин на клетъчно ниво. Представителни видеоклипове показват смесено невро-астроцитно поле на живо изображение на калций след прилагане на лептин в чау (допълнително видео 2) и HFD (допълнително видео 3) поддържани плъхове.
Астроцитите на DVC частично медиират аноректичните ефекти на лептина при слаби, но не при затлъстели плъхове
Поддържането на диета с високо съдържание на мазнини намалява активирането на DVC астроцитите
Загубата на LepR сигнализиране насърчава астроглиозата в DVC
Диабетните мастни плъхове на Zucker (ZDF) имат мутация в лептиновия рецептор, която предотвратява сигнализирането надолу по веригата след свързване с лептин 61,62. Тази форма на дефицит на лептинов рецептор води до затлъстяване, хиперфагия и хипергликемия (допълнителна фигура 3). Затлъстяването, дължащо се на недостатъчно сигнализиране за лептинов рецептор при тези плъхове на ZDF, е свързано със значително по-висока астроглиоза в DVC (фиг. 5а – г), но значително намаляване на плътността на GFAP-положителни клетки в дъгообразното ядро в сравнение с контролни плъхове от див тип ( Фиг. 5д). Плътността на микроглията е значително по-ниска в дъгообразното ядро на плъховете ZDF в сравнение с плъховете от див тип (фиг. 5j). За разлика от това, не се наблюдава промяна в плътността на микроглията при DVC на плъховете ZDF в сравнение с контролните плъхове (Фиг. 5f – i).
Друго основно откритие на настоящите данни, когато се разглежда в контекста на съществуващата литература за хипоталамуса, е забележителното разминаване в отговорите на DVC и клетките на хипоталамусната глия към затлъстяването. Тъй като микроглиите служат като резидентни имунокомпетентни клетки на централната нервна система 74 и преди това са показали, че реагират на диета с високо съдържание на мазнини и затлъстяване, ние измерихме ефектите на HFD и липсата на лептинова сигнализация върху плътността на микроглията. Излагането само на диета с високо съдържание на мазнини не е довело до промени в плътността на микроглията нито в DVC, нито в хипоталамуса. Необходима е бъдеща характеристика на състоянието на микроглията, т.е. почивка срещу активиране, за да се определи дали диетата и/или лептинът увеличават броя на активираните микроглии.
Взети заедно, тези открития подкрепят хипотезата, че астроцитите на DVC допринасят за регулирането на енергийния баланс и представляват компонент на дезадаптивните промени, които се случват в отговор на затлъстяването, предизвикано от диетата. Освен това, нашите резултати показват, че астроцитите в DVC могат да бъдат особено податливи на загубата на лептинова сигнализация.
Настоящото проучване имаше няколко ограничения. Едно предупреждение е, че индуцираните от HFD плъхове със затлъстяване са хипергликемични, но не са диабетици, докато ZDF животните показват пълен диабетен фенотип тип II, което увеличава възможността хипергликемията и инсулиновата резистентност да допринесат за наблюдавания ефект върху астроцитите. Нашите имунохистохимични анализи на глиоза не дават рафинирана характеристика на ефектите от диетата върху глиините клетки. Необходими са бъдещи анализи на индуцираните от диетата ефекти върху глиогенезата, морфологичните промени в глиалните процеси, активирането на глията и асоциациите с невроналните синапси. Второ, разчитахме на историческа литература, изследваща взаимодействието на хипоталамусния лептин-астроцити 11,13,14,15. Напълно възможно е всеки от предишните доклади да има някои специфични подробни методологични ограничения в извършените количествени оценки на IHC.
Независимо от тези ограничения, настоящите данни категорично предполагат, че полето ще се възползва от разширяването на нашето разбиране за дивергентни отговори на астроцитите в различни мозъчни ядра до затлъстяване и промени в сигнализирането на лептин, ако искаме да разберем напълно ролята, която астроцитите играят в регулирането на енергийния баланс.
В заключение, LepR се експресира функционално върху астроцитите на DVC и изпълнява различна функционална роля в DVC, отколкото в хипоталамуса. За разлика от астроцитите на хипоталамуса, DVC астроцитите могат да бъдат особено уязвими от липсата на лептинова сигнализация. Бъдещите усилия трябва да се съсредоточат върху изясняване на нервните пътища, подкрепени от различните функционални роли на DVC спрямо хипоталамусната глия, както и да се изследва приносът на сигнала на лептин-астроцитите в други ядра на ЦНС от значение за контрола на енергийния баланс. Колективно настоящите констатации разкриват нова роля на DVC астроцитите при посредничеството в действията на лептина.
- Енергиен баланс и телесна мастност Международен фонд за изследване на рака International
- Пилешки адаптивен отговор на нискоенергийна диета основна роля на хипоталамусния липиден метаболизъм
- Систематичен преглед на подкомисията по енергиен баланс и управление на теглото
- Енергиен баланс и малтузиански параметър, m, на паша на малки гризачи SpringerLink
- Близнаци с двойна енергия се справят с хранителни алергии - Независимият Санта Барбара