Резюме
Добре известно е, че фенотипът на животните може да бъде модифициран чрез хранителните модулации чрез епигенетични механизми. Като ключов и централен компонент на епигенетичната мрежа, метилирането на ДНК е лабилно в отговор на хранителните влияния. Промените в профилите на метилиране на ДНК могат да доведат до промени в генната експресия, което води до различни фенотипове с потенциал за намален растеж и здраве. Тук прегледах биологичния процес на метилиране на ДНК, който води до добавяне на метилови групи към ДНК; възможните начини, включително метилни донори, активност на ДНК метилтрансфераза (DNMT) и други кофактори, критичните периоди, включително пренатални, постнатални и диетични преходни периоди, и тъканна специфичност на епигенетичната модулация на ДНК метилирането чрез хранене и неговите механизми при животните.
1. Въведение
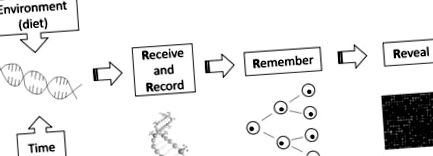
Добре известно е, че много организми могат да реагират на различни екологични/хранителни фактори, като проявяват фенотипна пластичност. Едно от примерите е, че пчелите растат или като маточници, или работнички в зависимост от това дали са хранени с пчелно млечице или пчелен хляб (Kucharski et al., 2008). Друг парадигматичен пример е този на модела на мишката Agouti, където диетичното съдържание на метил по майката влияе върху цвета на козината на потомството на гризачи (Wolff et al., 1998, Waterland and Jirtle, 2003, Dolinoy et al., 2006). Тези наблюдения показват, че фенотипът на животните може да бъде модифициран от хранителните модулации чрез епигенетични механизми, което означава, че излагането на диети може да има дългосрочни последици за растежа и здравето (McKay и Mathers, 2011). Mathers (2008) разработва модел на четири Rs, за да обясни механизма на хранителната епигеномика (фиг. 1).
Концептуалният модел на Четирите Rs на хранителната епигеномика. Променените епигеномични маркировки, получени в резултат на експозициите на околната среда (хранителни), са получени, записани, запомнени и разкрити (Mathers, 2008).
През последните години има все повече доказателства, че екологичните (хранителни) стимули могат да модифицират метилирането на ДНК и следователно да повлияят на фенотипната експресия на гени (Lillycrop et al., 2005, van Straten et al., 2010, Farias et al., 2015, Farkas и др., 2015, Day et al., 2015). Те работят или емпирично - възможни промени в епигенетичните белези са изследвани в отговор на диетичния фактор, или са изследвани теоретично - хипотетични механизми, чрез които хранителните вещества могат да повлияят на епигенетичните маркировки. ДНК метилирането е ключов компонент на епигенетичната мрежа (Kucharski et al., 2008) и отдавна се счита за централно в областта на епигенетиката. Процесът на метилиране на ДНК допринася с най-голямо значение на префикса "epi" за "epigenetics". Следователно тук бяха разгледани механизмите, критичните периоди и тъканната специфичност на хранителната модулация на ДНК метилирането.
2. ДНК метилиране
Цитозинът се метилира in vivo от ДНК метилтрансфераза (DNMT), която използва S-Adenosylmethionine (SAM) като електрофилен метилов източник, за да произведе 5-метилцитозин (mC) в цитозин-фосфат-гуанин (CpG) места в двуверижна ДНК. Поддръжка DNMT може след това да метилира допълнителния цитозин, за да произведе двуверижно CpG метилиране. Иначе стабилен епигенетичен белег, mC може да се окисли от a-кетоглутарат (a-KG) -зависима десет-единадесет транслокационна (Tet) фамилия диоксигенази, за да се получи 5-хидроксиметилцитозин (hmC), което е първата стъпка в отстраняването на метила като епигенетична марка (Day et al., 2015).
Независимо от това, mC може да се окисли от a-KG-зависимото Tet семейство диоксигенази, за да се получи 5-хидроксиметилцитозин (hmC) (фиг. 2) (Tahiliani et al., 2009, Day et al., 2015). Самата хидроксиметилова марка е стабилна и съществува в относително повишени нива в мозъка. Това обаче е и първата стъпка в активното деметилиране и или прекомерното окисляване от протеиновото семейство Tet до алдехидни или карбоксилатни продукти, или механизми за дезаминиране, последвано от реципиране на база, след което изтрива алкилирането на цитозин (Ito et al., 2011, Song et ал., 2013).
3. Механизми на хранителна модулация на метилирането на ДНК
Понастоящем има все повече доказателства в подкрепа на това, че хранителните вещества могат да променят модела на метилиране на ДНК, или в глобален мащаб, или в специфични за локуса места (Vucetic et al., 2010, Bogdarina et al., 2010, Jousse et al., 2011, Dudley и др., 2011, Altmann et al., 2012). Има три възможни начина, по които храненето влияе върху моделите на метилиране на ДНК (фиг. 3): първо, осигуряването на субстрати, необходими за правилното метилиране на ДНК; второ, осигуряване на кофактори, модулиращи ензимната активност на DNMT; трето, променяща се активност на ензимите, регулиращи едновъглеродния цикъл. Важното е, че и трите механизма са взаимно съвместими и могат да работят заедно във времето.
Възможни начини, по които храненето влияе върху моделите на метилиране на ДНК (Преработено от McKay and Mathers, 2011). MAT = метионин аденозилтрансфераза; SAM = S-аденозил метионин; SHMT = серин хидроксиметилтрансфераза; THF = тетрахидрофолат; DNMT = ДНК метилтрансфераза; MTR = 5-метилтетрагидрофолат-хомоцистеин метилтрансфераза; MTHFR = метилентетрахидрофолат редуктаза; Hcy = хомоцистеин; SAH = S-аденозилхомоцистеин; mDNA = метилирана ДНК.
3.1. Донори на метил от диетата
Като универсален метил-донор за ДНК и протеинови метилтрансферази (Loenen, 2006), S-Adenosylmethionine (SAM) се синтезира в цикъла на метионин от няколко предшественици, присъстващи в диетата (McKay and Mathers, 2011, Feil и Fraga, 2012). Всички тези прекурсори, включително метионин, фолат, холин, бетаин и витамини B2, B6 и B12, навлизат на различни места в метиониновия път и допринасят за нетния синтез на SAM. Следователно намалената наличност на метилни донори трябва да доведе до нисък синтез на SAM и глобално ДНК хипометилиране и обратно.
Всъщност има многобройна информация за ефектите на донорите на метил върху метилирането на ДНК от проучвания с животински модели (Pogribny et al., 2008, Cordero et al., 2013, Cordero et al., 2014, Amarasekera et al., 2014, Llanos et al., 2015, Farkas et al., 2015). Съответно диетите с недостиг на метилни донори водят до глобално ДНК хипометилиране при гризачи (Pogribny et al., 2008, Pogribny et al., 2009, Mehedint et al., 2010, Craciunescu et al., 2010). И обратно, майчината диета, допълнена с метилни донори, увеличава метилирането на ДНК в специфични локуси (Waterland, 2006, Waterland et al., 2008, de Vogel et al., 2011, Li et al., 2015, Farias et al., 2015).
Въпреки че донорите на метил могат да променят моделите на метилиране на ДНК, малко се знае за необходимите дози и точната продължителност на хранителната експозиция или изчерпването, допринасящи за промени в епигенетичните белези. Има твърде много несигурности относно ефектите на различните дози и продължителността на диетичното излагане върху метилирането на ДНК (Cravo et al., 1994, Cravo et al., 1998). Следователно заслужава по-систематични проучвания, за да се предоставят по-недвусмислени констатации.
Освен това други проучвания показват по-сложен сценарий. Ниско протеиново или 50% недохранване по време на бременността при мишки доведе до хипер- и хипо-метилиране на специфични локуси в потомството (van Straten et al., 2010). По същия начин недохранването вътреутробно при хора води както до хипо-, така и до хипер-метилиране на различни специфични локуси (Heijmans et al., 2008, Tobi et al., 2009, Waterland et al., 2010). Не се съобщава дали количеството на метил-донорите е намалено в тези специфични проучвания, но общоприето е, че недохранването корелира с намалената наличност на метил-донори. Следователно няма проста връзка между концентрацията на донора на метил и метилирането на ДНК. Други механизми могат да допринесат за установяване на модели на метилиране на ДНК в клетките.
3.2. ДНК метилтрансферазна активност
Добре известно е, че DNMT изискват SAM като кофактор за пълното им активиране. Донорите на метил от диетата могат да допринесат за модулиране на DNMT активността чрез промяна на вътреклетъчната концентрация на SAM. Освен непрякото регулиране на моделите на метилиране на ДНК чрез модулация на пулове SAM, няколко съединения могат също така директно да повлияят на експресията или активността на DNMT (Mukherjee et al., 2015). Демонстрирани са доказателства за конкурентно инхибиране на активността на DNMT за (-) - епигалокатехин-3-галат (EGCG), полифенол в зелен чай или генистеин, присъстващ в соята (Fang et al., 2007, Vanhees et al., 2011, Xie et al., 2014, Zampieri et al., 2015). Мирицетинът също може да намали метилирането на ДНК чрез инхибиране на SssI DNMT (Lee et al., 2005).
3.3. Активност на ензимите от цикъла на метионин
Витамините B2, B6 и B12 са кофактори, участващи в регулирането на каталитичната активност на ензимите от фолатния цикъл, като по този начин определят бионаличността на SAM. По-конкретно, витамин В6 е кофактор към серин хидроксиметилтрансфераза (SHMT) при превръщането на тетрахидрофолат (THF) в 5,10-метилен THF. Витамин В2 е предшественик на FAD, който е кофактор на метилентетрахирофолат редуктазата (MTHFR) при превръщането на 5,10-метилен THF в 5-метил THF. Витамин В12 е кофактор на 5-метилтетрахидрофолат-хомоцистеин метилтрансферазата (MTR), който катализира превръщането на хомоцистеин (Hcy) в метионин, директният предшественик на SAM. Следователно бионаличността на тези кофактори може да повлияе на метилирането на ДНК чрез модифициране на активността на едновъглеродния цикъл и производството на SAM (Feil и Fraga, 2012).
По този начин е възможно да се допълни диетата с тези витамини ще допринесе за поддържането или установяването на ДНК метилови марки. Farias et al. (2015) показаха за първи път, че клетките HCT116, LS174T и SW480, отглеждани без адекватна фолиева киселина, значително нарушават способността за образуване на колоносфера. Тези различия бяха придружени от съпътстващи промени в ензимната експресия на ДНК метилтрансфераза (DNMT) и нивата на метилиране на ДНК. Li et al. (2015) съобщават, че фолиевата киселина може да регулира фосфорилирането на тау протеин чрез инхибиране на реакциите на деметилиране на PP2A. Високите концентрации на фолиева киселина (20 и 40 µmol/L) увеличават съотношението на SAM към SAH и жизнеспособността на клетките.
4. Критични периоди на хранителна модулация на метилирането на ДНК
4.1. Пренатален период
Ранната ембриогенеза при бозайниците е най-критичният период за установяване на епигенома. Неизпълнението на тези програми навреме може да бъде необратимо и да доведе до трайна дисрегулация на генната експресия (Lumey et al., 1993, Gallou-Kabani and Junien, 2005). Важно е, че това е период, особено уязвим за екологични сигнали, като храненето, който може да наруши правилното установяване на епигенетични белези, които, след като бъдат установени, остават силно стабилни (Burdge and Lillycrop, 2010). Това е причината хранителните предизвикателства по време на ранния етап на развитие да имат такива дългосрочни ефекти.
Има по-големи доказателства за въздействието на майчиното хранене върху епигенетичните белези в потомството (Dominguez-Salas et al., 2014, Cannon et al., 2014, Mozhui et al., 2015). Ограничаването на протеините е често използван модел за недохранване на майките. Например, храненето с нископротеинова диета на бременни плъхове води до глобални или локус специфични промени в метилирането на ДНК (Rees et al., 2000, Altmann et al., 2013). Съобщените гени (или локуси), засегнати от недохранване с протеини, включват глюкокортикоиден рецептор (GR), активиран от пероксизома пролифератор рецептор алфа (PPARa) и чернодробен X рецептор-алфа (Lxra) в черния дроб (Lillycrop et al., 2007, Lillycrop et al., 2008, van Straten et al., 2010, van Straten et al., 2012, Altmann et al., 2013); хепатоцитният ядрен фактор-4-алфа (Hnf4a) в островни клетки (Sandovici et al., 2011); AT (1b) ангиотензиновия рецептор в надбъбречната жлеза (Bogdarina et al., 2007, Bogdarina et al., 2010); орексигенните/анорексигенните гени невропептид Y (Npy) и проопиомеланокортин С (Pomc) в хипоталамуса (Coupé et al., 2010); и лептиновия ген (Lep) в мастната тъкан (Jousse et al., 2011).
Важно е, че промените в метилирането на ДНК корелират с променената генна експресия. Следователно, такива хранителни промени в метилирането на ДНК могат да обяснят, поне отчасти, метаболитната дисфункция при възрастен. сега има достатъчно доказателства в подкрепа на това, че недохранването на майката може да предизвика трайни промени в генната експресия чрез епигенетични модификации.
4.2. Следродилен период
4.3. Диетичен преходен период
Епигенетичните вариации не са ограничени до пред- или постнаталния период, но могат да се появят по време на индивидуален жизнен цикъл (Grayson et al., 2014). Епигенетичните изследвания, включващи еднояйчни близнаци, които са родени с идентични геноми, но въпреки това показват различни фенотипове по-късно в живота, са отличен пример за това колко влиятелни фактори на околната среда могат да бъдат върху пластичността на организмите в развитието. Такива епигенетични вариации се натрупват в продължение на дълъг период и в крайна сметка могат да повлияят на фенотипните резултати (растеж и здраве). Въпреки това, количеството данни, свързващи диетичните интервенции при възрастни с епигенетични модификации, е много по-ограничено от това за диетичните интервенции по време на преди и след раждането. Независимо от това, храненето все още може да има дълготрайни ефекти, особено по време на дългосрочни „Диетични преходи“ (Jiménez-Chillarón et al., 2012), които могат да бъдат определени като период, в който животните са изложени за продължителен период от време (в диапазона от седмици – месеци при животните) до диета, характеризираща се с недохранване. Този тип преходи могат да причинят фини дълготрайни (или постоянни) промени в генната експресия. Епигенетично свързаните промени в тези генни експресии, макар и потенциално обратими, са склонни да бъдат стабилни и допринасят за възрастово зависимото намаляване на растежа и здравето (Li et al., 2011a, Chalkiadaki and Guarente, 2012, Jiménez-Chillarón et al., 2012 ).
Например, хроничното хранене с високо съдържание на мазнини при мишки (от отбиване до> 15 седмици) променя моделите на метилиране на ДНК в промоторните области на му-опиоидния рецептор както в VTA, така и в NAc в мозъка (Vucetic et al., 2011, Pitman и Borgland, 2015). По същия начин диетата след отбиване (високо съдържание на мазнини и въглехидрати) влияе върху моделите на метилиране на чернодробните интрацистернални частици (IAP) при мишки (Warzak et al., 2015). Нещо повече, диетата с високо съдържание на мазнини предразполага потомството на мишките към затлъстяване и настъпва хипометилиране на промотора на проопиомеланокортин (POMC) в хипоталамуса (Zheng et al., 2015). По същия начин мъжките мишки, хранени с диета с ниско съдържание на протеини от отбиването на възраст до 9 до 12 седмици, предизвикват множество промени в метилирането на ДНК, както се оценява чрез анализ на микрочипове, в черния дроб от потомството. Сред положителните локуси беше идентифициран подобрител на липидния регулаторен протеин PPARa (Carone et al., 2010). Отново, продължителна диетична промяна в епигенома на изогенни мишки с добавка на метил в продължение на 6 поколения увеличава варирането на ДНК метилиране в черния дроб (Li et al., 2011b), което предполага, че някои от предизвиканите промени са наследствени. Освен това, ограничаването на калориите влияе върху експресията на специфични гени, свързани с свързани с възрастта заболявания и стареене, чрез модулиране на обогатяващото свързване на HDAC1 с техните промоторни региони (Ferguson-Smith и Patti, 2011, Li et al., 2011b).
5. Тъкан, специфична за хранителната модулация на метилирането на ДНК
6. Перспектива за хранителна модулация на метилиране на ДНК
Благодарности
Тази работа беше подкрепена от Специалния фонд за агро-научни изследвания в обществен интерес (201303143) и Фонда на китайския съвет за стипендии (201403250010).
Бележки под линия
Партньорска проверка под отговорността на Китайската асоциация по наука за животните и ветеринарна медицина.
- Хранителните насоки са печеливша за всички за храненето, околната среда и животните
- Честване на Националния месец на храненето
- Готвене със суперхрани Рецепти за хранене с китайско зеле
- Диетологът на знаменитостите Pooja Makhija разбива най-големите митове за диетата; Хранене - NDTV Храна
- Еволюция, а не революция Хранене и затлъстяване