Лаборатория по сигнализиране и развитие на лимфоцити, Институт Бабрахам, Кеймбридж, Великобритания
Лаборатория по сигнализиране и развитие на лимфоцити, Институт Бабрахам, Кеймбридж, Великобритания
Лаборатория по сигнализиране и развитие на лимфоцити, Институт Бабрахам, Кеймбридж, Великобритания
Лаборатория по сигнализиране и развитие на лимфоцити, Институт Бабрахам, Кеймбридж, Великобритания
Обобщение
Външните повърхности на тялото, като кожата и стомашно-чревната лигавица, са важна защитна линия, предотвратяваща инвазията на микроорганизми и техните продукти. Имунните клетки на лигавицата, особено интраепителните лимфоцити, участват в поддържането на целостта на тези епителни бариери. Те допринасят за толерантността към коменсалните организми, които заемат същите тези места, и към имунния отговор срещу вредните организми и техните продукти. Съставът на микробиотата се влияе от имунните клетки, както и от външните фактори на околната среда, особено използването на антибиотици и диета. Все повече се оценява, че микробиотата засяга системните имунни реакции в допълнение към местния имунитет. Невъзможността да се контролира заетостта от микроорганизми може да доведе до нарушаване на деликатната хомеостаза между полезни и вредни микроорганизми и да допринесе за възпалителни патологии. Този преглед ще обсъди някои от сегашните ни разбирания за въздействието на имунните клетки и диетата върху микробиотата.
Въведение
Изглежда, че гостоприемникът и неговите симбионти са се развили в посока на взаимноизгодно състояние на съжителство. 6 Техните кръстосани разговори улесняват храносмилателните и анаболните функции на гостоприемника и предпазват епителните бариери от колонизация от патогени. 7 Микробите се съревновават за хранителни вещества и места за прикрепване към епителните клетки (ЕК). Някои дори могат да участват в химическа война и да произвеждат (бактериоцини) или да предизвикват антимикробни вещества, директно убивайки конкурентите. Промените в състава на микробиотата, дисбиозата, могат да допринесат за развитието на различни възпалителни разстройства. Следователно стриктното управление на имунния отговор е от решаващо значение за функцията на гостоприемника и оцеляването, като се поддържа оптимален баланс между толерантността към безвредни съединения, както и коменсалната флора, като същевременно ефективно се изчистват патогените и техните токсини. 8
Структурна организация на лигавичните повърхности
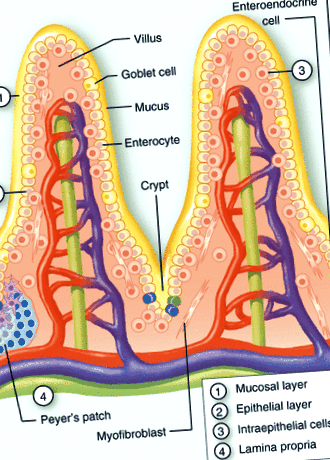
Имунната система на лигавицата може да бъде разделена на индуктивни и ефекторни места. Индуктивните места се състоят от организирана свързана с лигавицата лимфоидна тъкан, както и дрениращи лигавицата лимфни възли, докато ефекторните места са представени от lamina propria, стромата на екзокринните жлези и повърхностния епител. 9, 10 Ограничаването на контакта между луминалната микробна общност и чревната повърхност може да се счита за първата защитна линия (фиг. 1). Гликопротеините, образуващи мукозен слой, градиенти на имуноглобулини (IgA) и антимикробни пептиди предотвратяват проникването на повечето бактерии. Въпреки че микробицидното действие на антимикробните пептиди често се счита за леко, концентрациите в криптите могат да достигнат нива, достатъчни за силен бактериален лизис. 11.
Структурна организация на чревната лигавица. Схематично представяне на тънкочревната лигавична бариера, състояща се от мукозен слой (1) и градиенти на IgA и антимикробни фактори, епителните клетки (2), съставени от ентероцити, клетки на Панет, бокални клетки и ентероендокринни клетки, интраепителни лимфоцити (3), и lamina propria (4). Допълнителни вторични лимфоидни структури, като криптопачове и пластири на Peyers ’присъстват в lamina propria.
Интраепителните лимфоидни клетки
Епителните слоеве на повърхността на лигавицата на бозайниците съдържат специализирана лимфоидна популация, интраепителните лимфоцити (IEL), които участват пряко в защитата на гостоприемника, както и в поддържането на бариерите; съставляващи третата отбранителна линия (фиг. 1). IEL запълват всички повърхности на тялото. Те представляват една от най-големите лимфоцитни популации, открити при бозайниците, но въпреки това са най-слабо разбрани и представляват хетерогенна популация, съставена главно от неконвенционални Т клетки. IELs могат да споделят много свойства с конвенционалните Т-клетки, които експресират T-клетъчен рецептор (TCR), състоящ се от веригите TCR-α и TCR-beta, но има съществени разлики. За разлика от конвенционалните Т-клетки, IELs експресират антигенни рецептори с ограничено разнообразие 24 и се поддържат в повишено състояние на активиране, като се избягва необходимостта от начална стъпка преди пълното активиране и ненужно забавяне. В допълнение, те могат да реагират, без да е необходимо клоново разширяване на рядка прекурсорна клетка, която експресира определен TCR, който разпознава антиген от интерес. При активиране IELs незабавно освобождават цитокини, които допринасят за активирането и набирането на вродени имунни клетки и които могат да допринесат за оркестрацията на последващ адаптивен имунен отговор.
Лимфоцитите, експресиращи алтернативен TCR, състоящ се от веригите TCR γ и TCR δ δ, са относително малка популация при гръбначните животни, но са силно обогатени във всички епителни места. В епидермиса TCR-γδ Т-клетките са единствената популация от лимфоцити, докато в дихателните и чревните пътища те съжителстват с TCR-αβ Т-клетки. Тънките чревни IEL, в допълнение към TCR-γδ Т клетки, включват TCR-αβ T клетки от нетрадиционен характер, експресиращи CD8αα хомодимерен рецептор или нито CD4, нито CD8. 26 Интригуващо е, че тъканното разпределение на TCR γγ Т клетки в мишката е в съответствие с експресията на тяхната TCR γ верига. В червата клоновият репертоар на миши TCR ‐ γδ Т клетки е ограничен до TCR-Vγ5, свързан с Vδ4 или Vδ6. 27 Популацията на епидермална TCR γγ е ограничена единствено до TCR-Vγ3, съчетана с TCR-Vδ1 и показва много ограничена, ако има такава, вариабилност. Еквивалентът на TCR-Vγ3 IELs не присъства при хората поради липсата на тимусния стромален имуноглобулиноподобен детерминант skint1. 28 TCR ‐ Vγ4 имат привидно по-широко разпространение, заемайки епителните слоеве на белите дробове, женските репродуктивни органи и езика.
Разграничаване на добро от лошо?
Взаимодействието между ЕК и микробите обикновено не води до иницииране на възпалителни реакции, вместо това такива взаимодействия с все още неидентифициран характер са изключително полезни. Микробната колонизация е от първостепенно значение за развитието на чревната микроваскулатура и индуцирането на експресията на безброй гени, участващи в метаболизма, имунния отговор и целостта на чревната бариера. 29, 30 Подмладяването на общата лигавица на ЕС, постигнато в рамките на една седмица, зависи от пролиферацията на чревни стволови клетки 31 и е половината от нормалната скорост при липса на микроби. 32 Резултатът от намалената пролиферация е повишената чувствителност към увреждане на епителните клетки. Ограниченото ни разбиране за това как микробиотата влияе върху нашите епителни бариери се подчертава от наблюденията, че податливостта към увреждане се влияе отрицателно както от отсъствието, така и от наличието на микробни компоненти. 15, 33, 34 Това се отнася до изискването на микроорганизмите за (структурно) развитие и подготвяне на имунната система, отсъствието на които може да доведе до невъзможност да се отговори, докато конкретното присъствие на други микроорганизми ще допринесе отрицателно за имунопатологията 35 (фиг. 2).
Влияния, влияещи върху чревния микробен състав и бариерната хомеостаза. Освен генетиката на гостоприемника, случайни срещи, стрес и ефекти на стареене, диетата оказва голямо влияние върху чревния микробен състав. Особено съдържанието на фибри и техните метаболитни продукти като късоверижни мастни киселини (SCFA), ацетат, пропаноат и бутират оказват голямо влияние върху взаимноизгодната връзка (симбиоза) между гостоприемника и микробиотата. В допълнение, микробните фактори като полизахарид А (PSA) и пептидогликани (PTGN) допринасят пряко за тази връзка. Промените в микробния състав, дисбиозата, могат да доведат до увреждане на епителната бариера и стрес в резултат на намаляване на защитните микробни фактори и увеличаване на патогенните микроорганизми.
Поддържане на бариерата
За разлика от конвенционалните Т-лимфоцити, IEL запълват местата на епителната бариера преди раждането. 24 По време и малко след раждането бозайниците са изложени на микроорганизми и придобиват своята микробиота. След това луминалните микроорганизми оказват влияние върху развитието и функцията на IEL. Мишките, отглеждани без микроби, приютяват намален брой IEL, а IEL, носещи TCR γγ, показват намален цитолитичен капацитет при липса на микроби. 56, 57 Проучвания от няколко лаборатории показват, че IELs играят уникална роля за поддържане на EC хомеостаза и отговори на възстановяването на тъканите и злокачествените заболявания. Взаимовръзката на връзката между IEL, епителната бариера и микробиотата се илюстрира допълнително от способността на IEL, в допълнение към микробиотата, да подпомага растежа и оборота на ЕС. 58, 59 Това предполага, че IELs, чрез производството на цитокини, хемокини и растежни фактори, са важни за поддържането на епителните бариери и могат индиректно да повлияят на чревните микробни общности (Фиг. 3).
Поддържане на „оградата“. Балансиране на здравето на епителната бариера чрез кръстосани разговори между епителните клетки и луминалните микроорганизми и клетките на имунната система, особено интраепителните лимфоцити (IEL), които се поддържат чрез получени от храната лиганди на арилни въглеводородни рецептори (AhR) като индол-3-карбинол (I3C). IEL поддържат епителната бариера чрез освобождаване на растежни фактори и подпомагат активирането на антимикробни пептиди. При пробив на бариерата, IELs са пряко включени в цитолитичния имунен отговор, премахвайки заразените клетки и организирайки последващ адаптивен имунитет, както и реакцията на възстановяване на бариерата.
Диетични полизахариди
В допълнение към пола и възрастта, диетата оказва основно влияние върху състава на чревната микробиота. 67-69 В замяна на това промените в микробния състав и техните метаболити могат понякога да имат неочаквани ефекти върху местния и системен имунитет на гостоприемника, нещо, което едва наскоро беше признато. 45, 70-73 Като такава, диетата може да допринесе значително за драстичното нарастване на възпалителните заболявания като астма, множествена склероза, диабет тип 1 и болест на Crohn, както е регистрирано през последните 50 години. 74, 75 Такава връзка вече е установена с люлеещи се епидемиологични данни за връзката между затлъстяването и диабета, 76 затлъстяването и астмата, 77 диета и астма, 78 и диети с ниско съдържание на плодове и зеленчуци и възпалителни заболявания на червата (IBD). 79-81 Ако диетата е такъв основен фактор, който допринася за целостта на чревната бариера и за бързото нарастване на алергиите и автоимунните разстройства в развития свят, това предвижда, че съставът на микробиотата е значително различен при популациите в Европа и селските райони на Африка. Всъщност африканските деца консумират диета с много по-високо съдържание на фибри и тяхната микробиота е обогатена със специфична симбиотична Бактериодети видове и намалени в Фиксира в сравнение с европейските деца. 67
Чревната микробиота е до голяма степен получена от майката по време на раждането, но след това се модифицира чрез диета и случайни срещи в околната среда, като инфекции и употреба на антибиотици. Първоначалният прием е изключително мляко, състоящо се от разнообразие от полизахариди, модифицирани в млечната жлеза, за да съдържат лактозни клони. От особено значение са комбинациите на лактоза със сиалова киселина. Както бе споменато, фукозилирането на чревните епителни гликани насърчава бактериалната колонизация с определени видове. 12 Млечните олигозахариди, които не могат да бъдат абсорбирани или усвоени от гостоприемника и са сходни по структура на ЕС гликаните, действат като неутрализиращи лиганди, предотвратявайки свързването на някои бактерии над желания симбиотик Бифидобактерии видове. Всъщност мишките, отглеждани в мляко, липсващи сиалилирани олигозахариди, показват променен състав на своята микробиота, което влияе върху способността им да поддържат своята епителна бариера. 82
Значителна микробна промяна настъпва, когато се въвеждат твърди вещества, а полизахаридите под формата на растителни влакна и техните метаболити, късоверижни мастни киселини, ацетат, бутират и пропаноат, влияят положително върху микробния състав на червата (фиг. 2 ). Рецепторите за късоверижни мастни киселини са рецептори, свързани с G протеини, като GPR41 и GPR43, последният от които се експресира върху клетките на вродената имунна система. Изненадващо, липсата на GPR43 води до обострен и лошо разрешаващ се имунен отговор, 72 подобен на този, наблюдаван при мишки без микроби, които имат малко късоверижни мастни киселини. 35, 72, 83 За отбелязване е наблюдението, че нивата на късоверижните мастни киселини обикновено са по-ниски при пациенти с IBD. 81
Диетични витамини и фитохимикали
Микробиотата и диетата представляват основни субстрати за биосинтеза и метаболизма на важни витамини, особено кобаламин (витамин В12), структурно сложен и в момента все още се произвежда само чрез синтез на бактериална ферментация, и витамин К, синтезиран в листни зелени зеленчуци като филохинон, необходими за чревни бактерии за превръщането в няколко форми на витамин К и тяхното усвояване. Наскоро два допълнителни витамина са пряко замесени в поддържането на целостта на чревната бариера, витамини D и А. Първият и неговият рецептор (VDR) изглеждат важни за развитието на една от чревните IEL популации, TCR ‐ αβ + CD8αα +, без да се засягат TEL ‐ γδ IELs. 84 Липсата на VDR или витамин D води до повишено възпаление на стомашно-чревния тракт, което може да е резултат от многостранни изисквания за този витамин. Намаляването на IEL на TCR-αβ CD8αα може да намали бариерната хомеостаза и цитолитичната активност, но TCR-γδ IELs биха могли да компенсират. Витамин D обаче е необходим и за производството на микробицидни кателицидини, 85 липсата на които може допълнително да допринесе за променен чревен микробен товар или състав.
Метаболитно активните производни на витамин А включват ретиноева киселина, която свързана с нейните ядрени хормонални рецептори може да индуцира транскрипция на гени. Първоначалните доклади предполагат, че ретиноевата киселина участва в поддържането на балансиран чревен TCR-αβ + CD4 + T помощник (Th) клетъчно отделение, увеличавайки противовъзпалителните регулаторни Т клетки, като същевременно инхибира провъзпалителните Th17 клетки. 86-90 Въпреки че това предполага, че консумацията на витамин А е противовъзпалителна, две скорошни проучвания оспориха това. 91, 92 Ретиноевата киселина изглежда важна за общите Th-медиирани реакции, в нейно отсъствие мишките не успяват да установят силен Th1 и Th17 отговор. 92 Местоположението и контекстът също могат да бъдат ключови за ефекта на витамин А. Концентрациите на витамин А могат да бъдат най-високи в точката на усвояване, чревната лигавица, което може да има различни биологични ефекти. 93 По-важното е, че наличието на свързани с микроорганизми молекулни модели може да даде контекст на сигнал за витамин А. 94 Интересното е, че присъствието на IL-15, съществен фактор за оцеляване на IEL и ретиноева киселина изглежда създават особено благоприятни условия за развитие на Th1 и Th17, като потенциално предоставят механистичен поглед върху причината за цьолиакия. 91
Храните, които влияят на чревната хомеостаза, имат силни връзки с диетичния растителен компонент, като осигуряват както витамини, така и фибри. Неотдавнашните ни данни подчертават още един фитохимикал, получен от зеленчуци, който има изненадващо и драматично влияние върху бариерния имунитет. Индол-3-карбинолът се получава чрез разграждането на глюкозинолат глюкобрасицин, генериран по време на фотосинтеза от триптофан. Той присъства на високи нива в базиличните растения и е част от диетата чрез кръстоцветните зеленчуци като зеле и броколи. Стомашните киселини кондензират индол-3-карбинол до дииндолилметан и индолокарбазол, два високоафинитетни лиганда за арилния въглеводороден рецептор (AhR). Интересното е, че всички IELs изразяват относително високи нива на AhR и имат клетъчно автономно изискване за неговото активиране, без което те не успяват да оцелеят в целевите си тъкани. 71 Въпреки че Th17 и системният TCR-γδ експресират AhR, 95, 96, липсата му води само до селективно изчезване на чревните TCR-γδ и TCR-αβ CD8αα IEL и TCR-Vγ3 епидермални IEL и мишки, хранени с диета с ниско съдържание на зеленчуци съдържанието губят по-голямата част от чревните си IEL. 71
Съобщава се, че интраепителните лимфоцити освобождават антимикробни пептиди при увреждане на епитела, взаимодействат с клетъчните типове на епителния слой и по този начин могат директно да ограничат транслокацията и разпространението на чревни микроорганизми при увреждане на бариерата. 97 Интересното е, че мишките с дефицит на AhR или тези на диета с ниско съдържание на растителен материал, показват повишено CD4-медиирано производство на интерферон-γ, EC хиперплазия, намален епителен оборот, разширение на апикален цитоплазмен муцин, намалена експресия на антимикробни пептиди и повишено бактериално натоварване с повишен принос на видовете във вида Бактероидети. 71 Тези наблюдения са отличителни белези на IBD, 98, 99 и са в съответствие с предпоставката, че IBD се развива при генетично чувствителни гостоприемници, но че факторите на околната среда ускоряват началото или реактивирането и тежестта на заболяването.
Заключения и перспективи
Домакинът контролира реакцията на ЕС към заемащите бактерии чрез кръстосан разговор със същите тези бактерии, като по този начин ограничава възпалението на местата на епителната бариера. Това до голяма степен е отговорно за състоянието на имунна толерантност, повишаващо и култивиращо взаимноизгодното взаимодействие между гостоприемника и неговите микробни обитатели, освен ако не се нарушат бариерите и не се нанесат щети. Дерегулацията на този кръстосан разговор е свързана със загуба на EC хомеостаза и нарушаване на сложната мрежа от взаимозависими микробни видове, заемащи тези повърхности. Резултатът е активиране на провъзпалителни пътища с потенциал за разпространение на дисбаланса и ако не бъде разрешен, в крайна сметка води до хронично възпаление и имунопатология.
Благодарности
Авторите искат да признаят финансирането от BBSRC (M.V.) и Фондацията Wiener-Anspach (E.M.).
Разкриване
Авторите нямат противоречащи си финансови интереси.
- Ефикасност на кетогенната диета Кои епилепсии реагират Thammongkol - 2012 - Епилепсия - Wiley
- Диета и хранене 3 храни, които ви карат да се чувствате по-пълноценни, добри опции за меню в алтернативен ден
- Хранете се правилно, хапка по хапка Как да накарате доброто хранене да работи за вас
- Писането на храна толкова добро, че можете да го опитате от Dianne Jacob
- Celeb Trend на; IV витамини; Не е добра идея Риана Наука на живо