Кларис А. Мароц
магистърска програма по биомедицински науки, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния
Амир Заринринпар
b Отдел по гастроентерология, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния
Резюме
Световното разпространение на метаболитния синдром, който включва затлъстяването и свързаните с него заболявания, бързо нараства. Микробиомът на човешките черва е признат като независим модулатор на околната среда за здравето и заболяванията на метаболизма на гостоприемника. Изследванията върху животински модели показват, че чревният микробиом има функционалната способност да индуцира или облекчава метаболитния синдром. Един от начините за модифициране на микробиома на човешките черва е чрез трансплантация на фекални вещества, които съдържат изобилие от живи микроорганизми, от здрав индивид на болен с надеждата да облекчи заболяването. Тук правим преглед на последните доказателства, предполагащи ефикасността на трансплантацията на фекална микробиота (FMT) при животински модели и хора за лечение на затлъстяване и свързаните с него метаболитни нарушения.
Въведение
През последния половин век разпространението на затлъстяването и свързаните с него метаболитни нарушения, като диабет тип 2 (T2D), безалкохолна мастна чернодробна болест и хиперхолестеролемия, се е увеличило драстично. Като цяло тези заболявания причиняват неправомерно бреме върху разходите за здравеопазване и значителна заболеваемост и смъртност. Докато тези заболявания са свързани с човешката генетика и промени в начина на живот, човешкият чревен микробиом или микроорганизмите, живеещи в червата и техните колективни геноми, сега е признат, че играе нова роля в метаболитното здраве и болести [1,2]. Трилиони различни организми, включително бактерии, гъби, археи и вируси, са се развили съвместно, за да живеят в човешките черва [3]. Тези коменсални организми включват чревния микробиом, а техният колективен геном, наричан метагеном, съдържа повече от стократно броя на гените, отколкото гостоприемникът им [4]. Определени метагеномни модели са свързани със затлъстяването, както и други фенотипове [5]. Тези модели реагират на промяна на теглото при индивиди [6], което предполага, че модулирането на чревния микробиом е динамично свързано с метаболитния фенотип на човешкия гостоприемник.
Има много начини за промяна на чревната микробиота, включително пробиотици (непатогенни организми, полезни за гостоприемника), пребиотици (химикали, които предизвикват растеж и/или активност на коменсални организми) и трансплантация на фекална микробиота (FMT) [7] . Въпреки че в много проучвания са докладвани благоприятни ефекти на пробиотиците, нито едно не показва промяна в състава на фекалната микробиота [8]. FMT, от друга страна, причинява значителни промени в състава на фекалната микробиота [9]. FMT като потенциален терапевтичен лекар има дълга история. Успешната практика за промяна на чревната микробиота с FMT от здрав до болен индивид е регистрирана за първи път през 4-ти век за лечение на тежка диария [10]. Наскоро рандомизираните контролирани клинични проучвания показват поразителни успехи за повтаряща се, рефрактерна инфекция с Clostridium dificile (CDI). Многобройни проучвания съобщават за по-голяма от 90 процента ефикасност, значително по-успешна от традиционната терапия, за разрешаване на повтарящи се CDI [11]. Последните данни от животински и човешки модели предполагат, че FMT може да се използва и като терапевтична интервенция срещу затлъстяването [12,13]. В този преглед ще предоставим актуална информация за ролята на FMT при лечението на затлъстяването и свързаните с него метаболитни нарушения.
Чревна микробиота и метаболизъм на гостоприемника
Докато междуиндивидуалният състав на микробиотата може да варира драстично, запазеният набор от бактериални функционални генни профили присъства при всички здрави индивиди, което предполага роля на микробиома във физиологичното функциониране на червата [1,14,15]. Промените в тази сложна физиологична бактериална популация, свързани с отрицателни функционални резултати или заболяване, известно като дисбиоза, могат да причинят възпаление на ниско ниво и променена чревна хомеостаза. Дисбиозата е свързана с различни заболявания, включително затлъстяването и свързаните с него метаболитни нарушения [16].
Методология за трансплантация на фекални въпроси
Понастоящем само повтарящи се CDI са одобрени от FDA за FMT терапия, без да се изисква одобрение на ново лекарство (IND). Поради това по-голямата част от реципиентите на FMT са лекувани за тежък CDI. Тези хора се провалиха при многократно лечение с антибиотици и им останаха малко терапевтични възможности. В допълнение, FMT е изследван при възпалителни заболявания на червата (IBD), тъй като етиологията на това заболяване, поне отчасти, е резултат от дисбиоза. Въпреки това, има малко контролирани, рандомизирани проучвания за пациенти с IBD и няма доказателства, че FMT подобрява клиничните резултати. Като цяло FMT се извършва при предимно болни лица, които са изложени на висок риск от усложнения. Следователно потенциалните рискове и усложнения за относително здрави пациенти със затлъстяване или метаболитен синдром остават хипотетично по-ниски в сравнение с предишни проучвания, проведени при пациенти с рефрактерни, повтарящи се CDI или IBD.
Въпреки че FMT е сравнително лесен за изпълнение, има голяма междуинституционална променливост в методологията. Например, като подготовка за FMT, някои институции дават на своите пациенти многократни дози доксициклин или ванкомицин в опит да намалят местната, дисбиотична популация [29]. В много институции, непосредствено преди FMT, на пациентите обикновено се дава препарат от полиетилен гликол за дебелото черво, за да се увеличи възможността за трансплантирания микробиом да колонизира успешно червата, независимо дали FMT се въвежда в горния стомашно-чревен тракт или чрез колоноскопия. Въпреки това няма публикувани доказателства, които предполагат, че този препарат подобрява клиничните резултати на FMT [22].
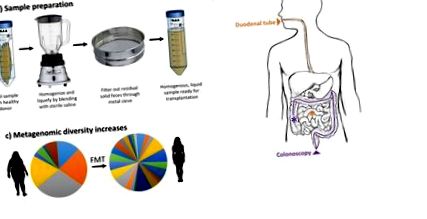
Обработката на фекални вещества за трансплантация не е стандартизирана и трябва да бъде валидирана експериментално за оптимална ефикасност. Общият принцип обаче е повече или по-малко универсален. Както е посочено на фигура 1, дареното изпражнение първо се смесва с физиологичен разтвор, за да го хомогенизира в течна проба и след това се филтрира, за да се отстранят всички твърди изпражнения, които могат да попречат на трансплантацията. За да се стандартизира обработката на фекални вещества, проучванията сравняват ефикасността на замразени и пресни проби на изпражненията преди обработката и трансплантацията. Досега тези проучвания не показват значителна разлика в първичните резултати [30,31]. Докато проучванията са провеждали секвениране на 16s рРНК преди и след обработката, за да се оцени загубата на проби, фекалното вещество съдържа 99 процента анаеробни видове, които може да не оцелеят при енергично аеробно смесване [32,33]. Освен това, 16s rRNA секвениране не различава жизнеспособните от мъртвите клетки. Независимо от това, огромният брой положителни резултати, получени от FMT при лечение на пациенти с CDI, предполага, че или жизнеспособността на клетките е относително маловажна, или че малка част от оцелелите клетки е достатъчна, за да предизвика промяна в микробиома на реципиента и терапевтичен ефект.
Схема за трансплантация на фекална микробиота. А) Фекалните вещества на донора се смесват с физиологичен разтвор и се прокарват през метално сито, за да се получи хомогенен течен разтвор. Б) Обработената фекална микробиота се доставя или чрез дуоденална тръба, или чрез колоноскопия. ° С) Представителни данни, показващи метагеномно разнообразие, се увеличават след FMT от слаб донор до затлъстял реципиент.
Обработените фекални вещества обикновено се доставят в стомашно-чревния тракт на пациента чрез колоноскопия или дуоденална тръба/горна ендоскопия (фиг. 1В). Докато начинът на доставка често варира от проучване до проучване, не се отчита статистически значима разлика в резултата между методите на доставка за лечение на CDI [11,34]. Това откритие остава да бъде потвърдено за лечение на други заболявания, като IBD или затлъстяване. Независимо от това е важно да се вземат предвид потенциалните рискове, свързани с всеки потенциален път на доставка.
Протоколът за FMT е широко променлив, както е обобщено в таблица 1, и стандартизацията на тази техника трябва да помогне за изясняване на ефикасността на FMT.
маса 1
| Точки на променливост | Потенциална методология | Потенциални последици |
| Подготовка на пациента | Вид/продължителност на антибиотичното лечение, продължителност на подготовката на дебелото черво | Състоянието на чревния микробиом на пациента може да повлияе на податливостта към трансплантация |
| Дарител | Пациентски роднина, „супер донор“, дизайнерски култури? | Идентифицирането на „супердонори“ намеква за възможността да се премине към създаването на по-безопасни, по-стандартизирани синтетични пробиотични общности |
| приготвяне на пробата | Аеробни срещу анаеробни; пресни срещу замразени срещу лиофилизирани | Неотдавнашно клинично проучване съобщи, че няма разлика в клиничната разделителна способност между използването на прясна или замразена фекална проба за трансплантация |
| Администрация | Дуоденална тръба, колоноскопия, клизма, хапче | Максимизирането на практичността на тази техника, като същевременно поддържа ефективността, може да повлияе на нейното предписване и цена |
| Сайт за доставка | Двоеточие, тънко черво | Пространствената динамика на човешкия микробиом остава слабо характеризирана, но може да доведе до по-целенасочена терапия |
Чувствителността към инсулин се прехвърля от донори на получатели
Последните проучвания върху животински модели показват функционална връзка между чревния микробиом и затлъстяването и свързаните с него метаболитни нарушения. Например, затлъстяването и инсулиновата резистентност при възрастни плъхове на диета с високо съдържание на фруктоза е било обърнато с перорално прилагани антибиотици или орално FMT от контролни плъхове [13]. Наскоро беше изследвано трансплантирането на фекални вещества от близнаци, несъответстващи на затлъстяването, в мишки без микроби [35]. Мишките, населени с микробиома от затлъстелия близнак, са имали повишено затлъстяване и намалено бактериално разнообразие в сравнение с мишки, населени с микробиома от постния близнак. Тези резултати демонстрират способността на микробиома да променя метаболитния фенотип на гостоприемника.
Към днешна дата има само едно публикувано проучване, тестващо ефикасността на FMT специално за лечение на метаболитни нарушения при хора. Отличителната черта на метаболитния синдром е инсулиновата резистентност, при която клетките реагират хипореактивно на инсулин и следователно не могат да поддържат глюкозната хомеостаза. Фекална микробиота от здрави, слаби донори, прехвърлени през дуоденална тръба към затлъстели индивиди с диагноза T2D, засегнати метаболизма на гостоприемника [12]. Проучването сравнява пациенти, които са получили алогенна трансплантация (n = 9) (т.е. изпражнения от здрав донор) с автоложна трансплантация (n = 9) (т.е. собствени изпражнения). Въпреки че няма съобщена разлика в индекса на телесна маса шест седмици след трансплантацията, се наблюдава значително увеличение на инсулиновата чувствителност (измерена чрез средната скорост на изчезване на глюкозата) и разнообразието на фекална микробиота и намаляване на фекалните SCFA в алогенната спрямо автоложната група . Тези обещаващи резултати са широко цитирани и вдъхновяват множество клинични изпитвания (обсъдени по-долу). Въпреки че FMT може да предизвика промяна в микробиома към донорската популация до 24 седмици след FMT [29], са необходими допълнителни проучвания, за да се определи дали FMT може да има дългосрочни ефекти върху инсулиновата чувствителност или теглото.
Необходими са допълнителни клинични изпитвания за валидиране на ефектите на FMT при тези със затлъстяване или метаболитен синдром. Важно е, че тези проучвания трябва да бъдат рандомизирани, да включват автоложни контроли, да съдържат щателни метаданни и да проследяват дългосрочните данни за микробиома и резултатите от пациента. ClinicalTrials.gov изброява четири текущи клинични изпитвания, тестващи FMT за лечение на метаболитен синдром. Клинично изпитване във фаза 2 в Обща болница в Масачузетс оценява въздействието на капсулите FMT върху първичния резултат от намаляване на телесното тегло в продължение на 18 седмици [ClinicalTrials.gov ID> NCT02530385]. Италианско клинично изпитване фаза 3 проследява хомеостазата на глюкозата в продължение на 6 месеца след FMT в комбинация с диета и упражнения [ClinicalTrials.gov ID> NCT02050607]. Изследователи от Китайския медицински университет в Нанкин оценяват резултатите от фаза 3 клинично изпитване на единичен FMT, доставен на назогастрал върху T2D за период от две години [ClinicalTrials.gov ID> NCT01790711]. Канадско двойно-сляпо пилотно проучване тества ефективността на FMT както при метаболитен синдром, така и при безалкохолно мастно чернодробно заболяване, което е тясно свързано със затлъстяването [ClinicalTrials.gov ID> NCT02496390].
Резултатите от тези клинични проучвания трябва да ни дадат по-добра представа за функционалната роля на микробиома при човешкото метаболитно разстройство. Бъдещите проучвания трябва да бъдат разработени, за да се идентифицират кои бактериални популации или функционални връзки между микроби и гостоприемници са в основата на това явление.
Супердонори
Изборът на донор за FMT не е стандартизиран, въпреки че има общ консенсус относно необходимостта от това [36]. Първоначално донорите обикновено са членове на семейството, идентифицирани от пациента. Последните проучвания обаче подчертават практическите предимства на използването на стандартизирани доброволчески донори и създаването на скринирани биобанки [31,34]. По принцип донорите се изследват за здравословно движение на червата според диаграмата на изпражненията в Бристол, заразни заболявания, скорошна история на пътуванията и история на антибиотици.
В следващите публикации и конференции Vrieze et al. отбеляза, че пациентите, които са имали по-силно подобрение на инсулиновата чувствителност след FMT, са получили трансплантация от същия ограничен брой донори [37]. Това означава, че малка част от донорните проби предизвикват силен отговор, докато други проби нямат ефект върху метаболизма на пациентите. Следователно успехът на намесата би могъл да се отдаде на „супердонорите“. Изследвания върху ефектите на FMT за облекчаване на симптомите на IBD по подобен начин са установили, че фекалните проби от определени донори имат много по-голям терапевтичен ефект върху множество реципиенти [38]. Понастоящем няма начин да се идентифицират супердонорите, докато не започнат експериментите. По-новите проучвания на ФМТ се опитват да идентифицират супердонорите по-рано, за да се извърши по-строг анализ на техния микробиом за идентифициране на терапевтична микробиота, което би могло да позволи разработването на по-добра алтернатива на ФМТ.
Съществува силна социална стигма с ФМТ [39]. Тъй като фекалната материя е трудна за стандартизиране, етичните и социални усложнения при трансплантацията на изпражнения и трудността при монетизирането, активно се търсят алтернативи на директното ФМТ [40]. Гел капсули с фекална микробиота е обещаваща нова техника, която изключва необходимостта от всякаква стомашно-чревна процедура [34,41] и е предпочитана от пациентите [42,43]. Всъщност частните компании вече доставят FMT чрез орални капсули, главно за лечение на CDI. Не е ясно обаче дали тези капсули са толкова ефективни, колкото самия FMT.
Друго потенциално лечение е проектирането и производството на пробиотици по независим от донорите начин. Например, проучването Vrieze et al., Идентифицира повишено производство на бутират микроби при пациенти с повишена чувствителност към инсулин след FMT [8]. Ако увеличаването на произвеждащите бутират бактерии е важно за подобряване на метаболитните симптоми, тогава има възможност за по-директно лечение на метаболитния синдром чрез про/пребиотици, което би било по-лесно да се контролира и администрира.
Потенциални рискове
Едно предизвикателство с FMT е трудността при намирането на точни мерки за нежелани реакции. Досега по-голямата част от реципиентите са болни и е трудно да се направи разлика между нормалното прогресиране на заболяването и ефектите на FMT. Независимо от това, въпреки че стотици индивиди са претърпели FMT, са съобщени малко отрицателни резултати, дори при имунокомпрометирани пациенти [44]. По-голямата част от съобщените отрицателни симптоми са леки, включително диария или треска [45-47]. Смъртността е наблюдавана при проучвания с ФМТ, но тя се дължи на несвързани причини при тежко болни или възрастни пациенти. Микробиотата може да предразположи податливостта към атеросклероза, използвайки причинни доказателства при мишки и корелативни доказателства при хора [48]. В допълнение, разпространението на трансмисивна болест, макар и да не се съобщава, все още е жизнеспособна заплаха, особено за имунокомпрометирани (напр. Пациент с IBD на имуномодулираща терапия, пациент с ХИВ с CDI). Тези доклади подчертават важността на строгия скрининг на донори. И накрая, тези рискове трябва да бъдат смекчени с заболеваемостта и смъртността, свързани със затлъстяването и свързаните с него метаболитни заболявания, които все още имат малко ефективни лечения.
Изненадващо, обезогенните свойства на чревния микробиом могат да се предават и чрез FMT. Доклад за случай документира предаването на фенотип със затлъстяване от донор с наднормено тегло на слаб пациент след FMT за лечение на CDI [49]. Донорът е млад, затлъстял роднина, претърпял бързо наддаване на тегло по време на дарението. Получателят е лице, което никога не е било със затлъстяване. След получаване на FMT, получателят има бързо неволно наддаване на тегло, което не може да бъде обяснено само с възстановяване от CDI. Интересното е, че получателят съобщава за повишен апетит. Тези наблюдения остават противоречиви, като се има предвид, че става въпрос за казус. Това обаче е в съответствие с проучвания върху гризачи, при които прехвърлянето на фекални вещества от затлъстели мишки към мишки без микроби предава метаболитния фенотип [35]. Независимо от това, резултатите от този доклад са засегнали протокола за FMT в много институции, които сега изключват донорите със затлъстяване.
Заключение
FMT остава вълнуваща терапия с богат потенциал. Въпреки това липсват контролирани, рандомизирани проучвания за метаболитно заболяване. Първоначално FDA счита FMT за IND, което затруднява практикуващите да използват, докато не бъдат изчерпани всички други терапевтични възможности. През 2014 г. обаче FDA заяви, че ще упражнява право на преценка, като позволява на лекарите да използват FMT без приложения на IND за лечение на CDI. За повече показания за изследване на FMT, все още се изисква приложение на IND с FDA.
Като се има предвид количеството контролирани клинични проучвания, които понастоящем тестват FMT за метаболитен синдром, трябва да имаме ясна индикация през следващите няколко години дали промените в микробиотата са причинителни или корелативни в тази нарастваща епидемия и дали промяната на чревния микробиом чрез FMT или подобни процедури ще осигури нови терапевтични възможности за затлъстяване и свързаните с него метаболитни нарушения.
- Ефекти от кленовия сироп върху разнообразието на чревната микробиота и метаболитния синдром - изглед в пълен текст
- Трансплантация на фекална микробиота при лечение на затлъстяване - клиничен съветник
- Фекална трансплантация за лечение на затлъстяване и диабет MedPage днес
- Ефекти от индуцираното от флеботомия намаляване на запасите от желязо в тялото върху метаболитния синдром са резултат от a
- Център за метаболизъм и отслабване на Capital Health; Покритие на затлъстяването