Хуей Жанг
1 Училище по фармация, Университет по традиционна китайска медицина в Шандонг, Дзинан 250355, Китай
Yibo Tang
2 Училище за основни медицински науки, Пекински университет по китайска медицина, Пекин 100029, Китай
Ин Джан
3 Департамент по дерматология, Първата болница на Китайската народноосвободителна армия, Гансу 730030, Китай
Шуофън Джанг
4 School of Chinese Materia Medica, Пекински университет по китайска медицина, Пекин 100029, Китай
Jing Qu
2 Училище за основни медицински науки, Пекински университет по китайска медицина, Пекин 100029, Китай
Сю Уанг
2 Училище за основни медицински науки, Пекински университет по китайска медицина, Пекин 100029, Китай
Ран Конг
4 School of Chinese Materia Medica, Пекински университет по китайска медицина, Пекин 100029, Китай
Чунчао Хан
1 Училище по фармация, Университет по традиционна китайска медицина в Шандонг, Дзинан 250355, Китай
Zhenquan Liu
2 Училище за основни медицински науки, Пекински университет по китайска медицина, Пекин 100029, Китай
Резюме
Фукоксантин, аленов каротиноид, може да бъде изолиран от ядливи кафяви водорасли. Последните проучвания съобщават, че фукоксантинът има много физиологични функции и биологични свойства, като затлъстяване, противотуморно, антидиабетно, антиоксидантно, противовъзпалително и хепатопротективно действие, както и сърдечно-съдови и мозъчно-съдови защитни ефекти. Следователно, фукоксантин може да се използва както като лечебна, така и като хранителна съставка за предотвратяване и лечение на хронични заболявания. Въпреки че фукоксантинът притежава много лекарствени съставки и хранителни качества, проучванията показват, че неговата структура е нестабилна. В тази статия разгледахме текущите документи и разгледахме структурните свойства и фактори, влияещи върху стабилността на фукоксантин. Също така докладвахме за метаболизма, безопасността, фармакологичните дейности и методите за подобряване на бионаличността на фукоксантин. Въз основа на тези проучвания, предоставящи основни познания, фукоксантинът може да се превърне в морски лекарства и хранителни продукти.
1. Въведение
Напоследък приемът на мазнини, захари и калории се увеличава, докато упражненията и физическите дейности намаляват. Този начин на живот допринася за свързани заболявания, като затлъстяване, захарен диабет, рак и други хронични заболявания. За профилактика и лечение на заболявания, свързани с начина на живот, не е достатъчно да се използва изключително фармакологично лечение. Храненето също играе критична роля [1]. Ето защо изследователите започват да намират безопасни и ефективни функционални съставки в храната за предотвратяване и лечение на заболявания, свързани с начина на живот [2]. Една от тези функционални съставки е фукоксантин.
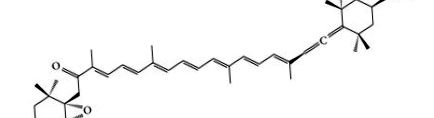
Фукоксантинът е морски каротиноид и присъства в макроводораслите и микроводораслите, като Undaria pinnatifida (Wakame), Laminaria japonica (Ma-Kombu), Phaeodactylum tricornutum и Cylindrotheca closterium [3]. Структурата на фукоксантин се определя от Englert et al. [4]. Фукоксантин има уникална молекулярна структура (Фигура 1), включваща необичайна аленова връзка, 5,6-моноепоксид и 9 конюгирани двойни граници [5, 6]. Аленовата връзка беше главно във фукоксантин, който не беше открит в други каротеноиди в кафявите водорасли [7]. Уникалната структура и хиралност на фукоксантин обаче са нестабилни. Лесно се влияе от нагряване, въздушна експозиция и осветление [8, 9]. Въпреки че фукоксантинът е нестабилен, факторите, допринасящи за неговата нестабилност, са добре проучени. Поради своята нестабилна структура и аленовата връзка, фукоксантинът показва висока антиоксидантна активност [10]. Нещо повече, фукоксантинът също така показва затлъстяване, антидиабет, противовъзпалително, противораково и хепатопротективно действие, както и сърдечно-съдови и мозъчно-съдови защитни ефекти [11–54]. В тази статия разгледахме факторите, влияещи върху стабилността на фукоксантин, метаболизма и безопасността на фукоксантин, фармакологичните дейности и фармакологичния механизъм на фукоксантин.
Химичната структура на фукоксантин.
2. Структура на фукоксантин
Структурата на фукоксантин е тясно свързана с фармакологичните дейности на фукоксантин. Следователно свойствата на неговата структура са необходими, за да бъдат добре известни. Фукоксантинът е характерен каротеноид, който е открит в кафявите водорасли. Структурата на фукоксантин (Фигура 1) е подобна на неоксантин, диноксантин и перидинин. За разлика от други каротеноиди, фукоксантинът има уникална структура, в която присъстват необичайна аленова връзка, 9 конюгирани двойни граници, 5,6-моноепоксид и някои кислородни функционални групи, включително хидроксилни, епоксидни, карбонилни и карбоксилни части [55, 56 ].
3. Метаболизъм и бионаличност на фукоксантин
Абсорбцията и метаболизмът на фукоксантин са тясно свързани с неговата бионаличност. От съществено значение е да се знае метаболитният процес и методът за подобряване на бионаличността на фукоксантин (Фигура 2).
Химичните структури на фукоксантин, фукоксантинол и амаруциаксантин А.
Фукоксантинол и амаруциаксантин А са основните метаболити на фукоксантин. Изглежда, че фукоксантин бързо се хидролизира до фукоксантинол в стомашно-чревния тракт в рамките на 2 часа след приложението и не се открива непроменен фукоксантин в плазмата или черния дроб при мишки [59]. Фукоксантинолът се превръща в амаруциаксантин А, който се проявява предимно в чернодробни микрозоми на мишки и в клетки HepG2 [59]. Изследването in vitro от Hashimoto et al. [60] демонстрира, че диетичният фукоксантин се натрупва в сърцето и черния дроб като фукоксантинол и в мастната тъкан като амаруциаксантин А.
Yonekura et al. [61] изследва метаболизма, разпределението в тъканите и изчерпването на фукоксантин при ICR мишки. Те откриха фукоксантинол и амаруциаксантин А при мишки, разпределени повече в мастните тъкани, отколкото в плазмата, черния дроб и бъбреците. Полуживотът на изчерпване (t 1/2) на метаболитите на фукоксантин в мастните тъкани (> 41 d) е по-дълъг от този в плазмата (1,16 d), черния дроб (2,63 d) и бъбреците (4,44 d) [61] . Освен това те стигнаха до заключението, че тъканното разпределение на метаболитите на фукоксантин не е свързано с тяхната липофилност, но изчерпването изглежда е по-бавно поради тяхната по-висока липофилност.
Фармакокинетиката на лекарствата зависи от вида. Mordenti [62] съобщава, че елиминирането на лекарства е най-бързо при мишки и най-бавно при хора сред сравняваните видове. Изследването на Hashimoto et al. [63] показа, че бионаличността на фукоксантинол е по-висока при хора, отколкото при мишки. Те също така откриха, че метаболизмът на фукоксантин се различава между хората и мишките. Фукоксантинолът се счита за основния активен метаболит при човека. И в плазмата на доброволеца не е открит амаруциаксантин А.
При перорално приложение трябва да се има предвид разтворимостта на фукоксантин като важен фактор. Maeda et al. [64, 65] установи, че фукоксантинът е трудно разтворим в соево масло и растителни масла, докато лесно може да се разтвори в рибено масло и средноверижни триацилглицероли (MCT). Увеличаването на теглото на бялата мастна тъкан (WAT) е по-малко при KK-A y мишки, хранени с фукоксантин и рибено масло, отколкото това при мишки, хранени само с фукоксантин [64]. Експресията на разединяващ протеин 1 (UCP1) е по-ясна при мишки, хранени с фукоксантин и МСТ, отколкото при мишки, хранени само с пречистен фукоксантин или МСТ [65]. Тези данни показват, че скоростта на абсорбция на фукоксантин може да бъде увеличена чрез рибено масло и MCT. Освен това, изследването на Sugawara et al. [66] показа, че лизофосфатидилхолинът (lysoPC) и фосфолипазата А2 (PLA2) са от голямо значение за повишаване на абсорбцията на каротеноиди в храносмилателния тракт и подпомагане на прост дифузионен механизъм за асимилация на каротеноиди от чревния епител. По този начин, скоростта на абсорбция на фукоксантин може да бъде значително повлияна от някои компоненти, особено липидите.
4. Безопасност на Фукоксантин
Фукоксантин е безопасна фармацевтична съставка. Клиничните изследвания показват, че приемането на фукоксантин се смята за ускоряване на метаболизма, но метаболитният тласък не стимулира централната нервна система [67]. 4-седмично проучване за токсичност при многократно перорално дозиране на фукоксантин (95% чистота) върху плъхове е проведено от Kadekaru et al. [68]. Резултатите показват, че фукоксантин не показва очевидна токсичност при плъховете [68]. Токсичността на екстрактите, съдържащи 0,0012% фукоксантин, е определена при мишки от Zaragozá et al. [69]. Екстрактите не показват съответни токсични ефекти при тест за остра токсичност след 4-седмично ежедневно лечение. Освен това фукоксантинолът, метаболитът на фукоксантин, не показва значителни неблагоприятни ефекти in vivo [70].
5. Фармакологични дейности на фукоксантин
5.1. Ефект на затлъстяването
Дългосрочната консумация на диети с високо съдържание на мазнини може да промени липидния метаболизъм, което води до натрупване на висцерална мастна тъкан и води до затлъстяване и свързани с това разстройства, като захарен диабет, хипертония, дислипидемия и сърдечно-съдови заболявания [71, 72]. Следователно, намирането на ефективни стратегии за предотвратяване на затлъстяването е от решаващо значение. Изследователите установяват, че добавките с фукоксантин могат да играят благоприятна роля за затлъстяването по различни пътища (Фигура 3).
Антибест на фукоксантин. ↑ Повишаване на регулирането; ↓ регулиране надолу.
Фукоксантин значително намалява плазмените и чернодробните концентрации на триглицериди, фекални триглицериди, холестерол и холестерол-регулиращи ензимни активности като 3-хидрокси-3-метилглутарил коензим А редуктаза и ацил коензим А [11–15].
Много проучвания предполагат, че фукоксантинът има ефект на затлъстяване, като стимулира експресията на разединяващ протеин 1 (UCP1) в бяла мастна тъкан (WAT). UCP1 обикновено се намира в кафява мастна тъкан (BAT), която не се експресира в WAT без стимулация. Въпреки това, Maeda et al. [22] открива ясни сигнали за UCP1 протеин и иРНК в WAT, когато мишките се хранят с липиди Undaria pinnatifida, съдържащи фукоксантин. Освен това, те също [64] откриват, че 0,2% фукоксантин в диетата значително намалява увеличаването на теглото на WAT при KK-A y мишки с увеличаване на експресията на UCP-1.
Фукоксантин може да стимулира β-окислителната активност и да инхибира фосфатидат фосфохидролазната активност, което води до намаляване на натрупването на чернодробни липидни капчици [12]. Диетата с високо съдържание на мазнини индуцира намаляването на фосфорилирането на AMP-активирана протеин киназа (AMPK) и ацетил-КоА карбоксилаза (ACC). Намаляването може да бъде възстановено от фукоксантин с увеличаване на LKB1 фосфорилирането в зрели 3T3-L1 адипоцити [23].
Фукоксантин може да промени нивото на лептин в плазмата. Секретите на лептин се повишават чрез натрупване на мазнини в адипоцитите. Лептинът може да контролира телесното тегло и мастната мастна тъкан чрез регулиране на енергийните разходи [24]. Парк и др. [12] оцени полезния ефект на етаноловия екстракт от Undaria pinnatifida (UEFx) при мишки C57BL/6J. Те открили, че фукоксантин може значително да намали нивото на лептин в плазмата, което е свързано със значителен спад в теглото на епидидималната мастна тъкан.
Едно проучване, проведено при хора, предполага ефектите на фукоксантин върху загубата на тегло. Комбинацията от 300 mg масло от семена от нар и 300 mg екстракт от кафяви морски водорасли, съдържащи 2,4 mg фукоксантин, значително доведе до намаляване на телесното тегло и съдържанието на чернодробни мазнини при жени със затлъстяване, лекувани в продължение на 16 дни [25].
5.2. Антитуморогенна активност
Химиотерапията е конвенционален начин за намаляване на смъртността от рак. Въпреки това, рецидивът и заболеваемостта от рак не могат да бъдат намалени чрез химиотерапия. Ето защо е от съществено значение да се намери обещаващ подход за контрол на развитието на рака. Фукоксантинът може да бъде ефективен начин за контрол на злокачествените заболявания, като предизвиква спиране на клетъчния цикъл и апоптоза.
5.2.1. Арест на клетъчния цикъл
GADD45 участва в потискането на растежа. PCNA е нормален компонент на комплексите на циклин-зависими кинази (Cdk) и протеин, участващ в репликацията и възстановяването на ДНК. Smith et al. [26] по-рано установи, че когато GADD45 се свърже с PCNA, това ще стимулира възстановяването на ексцизия на ДНК in vitro и ще инхибира влизането на клетките в S фаза. В допълнение, GADD45A подобрява взаимодействието между β-катенин и кавеолин-1, което индуцира транслокация на β-катенин в клетъчната мембрана, което води до адхезия/контактно инхибиране на клетъчните клетки [27]. Йошико и Хойоко [28] установяват, че фукоксантинът значително е индуцирал GADD45A в клетки HepG2 и DU145 при ареста на G1. Индукцията на експресия на GADD45A и арест на G1 от фукоксантин се регулира положително чрез инхибиране на p38 MAPK пътя в HepG2 клетки и отрицателно се регулира чрез инхибиране на SAPK/JNK пътя в клетки DU145 [29]. В допълнение, инхибирането на ERK от фукоксантин само засилва експресията на GADD45A и не оказва влияние върху ареста на G1 в HepG2 клетки. Тези резултати предполагат, че различни модели на участие на MAPK в индукцията на GADD45A и G1 арест от фукоксантин са свързани с клетъчния тип.
Изследването на Kim et al. [30] демонстрира, че фукоксантин намалява пролиферацията на B16F10 клетки, придружен от индукция на спиране на клетъчния цикъл по време на фаза G (0)/G (1). Задържането на клетъчния цикъл по време на фазата G (0)/G (1), индуцирано от фукоксантин, е свързано със значително намаляване на протеиновите експресии на фосфорилиран-Rb (ретинобластомен протеин), циклин D (1 и 2) и циклин-зависим киназа (CDK4) и значително регулиране на нивата на протеин на p15 INK4B и p27 Kip1 [30]. Yu et al. [31] съобщават, че фукоксантин индуцира апоптоза в човешки стомашен аденокарцином MGC-803 клетки и спиране на клетъчния цикъл във фаза G2/M. Фукоксантин значително намалява експресията на CyclinB1, оцелял и STAT3 в MGC-803 клетки по зависим от дозата начин [31]. Те също така откриха, че фукоксантинът може да потисне експресията на CyclinB1 чрез JAK/STAT сигналния път [31]. Механизмът на спиране на клетъчния цикъл, индуциран от фукоксантин, е описан на снимка (Фигура 4).
- EnerGaia - Какво представлява спирулина, хранителни ползи и други въпроси
- Чай от ленено семе - хранителни дизайни
- Може ли патицата да е нова по-добра за вас съставка Food Dive
- Хранителни факти за зелени домати, Хранителна информация за зелен домат
- Билки от царевица (дрян) Ползи за здравето, факти, лечебна употреба на кора и чай от дрян