Кореспонденция на: Хироаки Катаока, д-р, професор, Секция по онкопатология и регенеративна биология, Катедра по патология, Медицински факултет, Университет в Миядзаки, 5200 Кихара, Кийотаке, Миядзаки 889-1692, Япония. pj.ca.u-ikazayim.dem@anijem
Телефон: + 81-985-852809 Факс: + 81-985-856003
Резюме
Основен съвет: Инфекцията от вируса на хепатит С (HCV) причинява хроничен хепатит, чернодробна цироза и хепатоцелуларен карцином. Докато комбинацията от пегилиран α-интерферон и рибавирин се използва за елиминиране на HCV, е необходимо ново анти-HCV лекарство поради лошата ефикасност и сериозните странични ефекти, свързани с тази комбинирана терапия. Търсихме нови анти-HCV агенти от естествени продукти и след това идентифицирахме олигомерен проантоцианидин от листа от боровинки. По-нататъшни изследвания показват, че няколко хетерогенни ядрени рибонуклеопротеини могат да бъдат кандидат протеини, участващи в медиираното от проантоцианидин инхибиране на HCV субгеномна експресия. Олигомерният проантоцианидин, изолиран от листа от боровинки, може да има потенциална полза като анти-HCV съединение.
ВЪВЕДЕНИЕ
Вирусът на хепатит С (HCV) е основна причина за вирусен хепатит и в момента заразява приблизително 170 милиона души по целия свят [1,2]. Инфекцията от HCV причинява високи нива на хроничен хепатит (> 75%) и в крайна сметка прогресира до чернодробна цироза и хепатоцелуларен карцином [3]. Общо 27% и 25% от индивидите, които развиват съответно чернодробна цироза и хепатоцелуларен карцином в световен мащаб, възникват при инфектирани с HCV хора [4]. Световната здравна организация съобщава, че между 350000 и 500000 души умират от заболявания, свързани с HCV всяка година. Понастоящем обаче няма ефективна ваксина срещу HCV инфекция.
В момента комбинацията от пегилиран α-интерферон и широкоспектърно антивирусно лекарство, рибавирин, се използва като стандартна терапия за хронична HCV инфекция [2,5,6]. Въпреки това, опцията му за съжаление е ограничена от ефикасност, поносимост и значителни странични ефекти. Следователно се изискваше да се установи нов терапевтичен метод без сериозни неблагоприятни ефекти. Напоследък клинично са изследвани антивирусни лекарства с пряко действие (DAA), които инхибират специфичните за HCV протеини [7,8]. Например, боцепревир и телапревир са нови DAA, одобрени за първи път от Американската администрация по храните и лекарствата (FDA) през 2011 г. [9]. Очаква се DAA да предоставят нови обещаващи възможности за лечение при пациенти с хепатит С; в момента обаче те се сблъскват с трудности при разпространението в световен мащаб поради високите разходи. Следователно, все още се изискват нови анти-HCV агенти, които са безопасни, икономични и допълват настоящите терапии.
В този преглед представихме общ преглед на функционалните храни и съставки, ефективни при HCV инфекция, химичните структурни характеристики на олигомерния проантоцианидин и неговия механизъм на действие.
HCV ЖИВОТЕН ЦИКЛ И АНАЛИТИЧЕН ИНСТРУМЕНТ
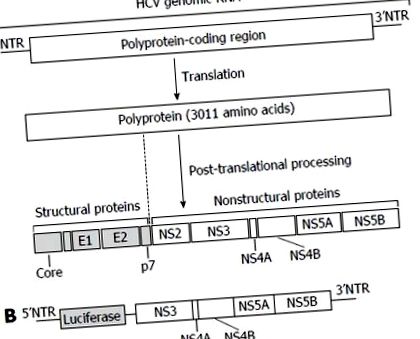
Структура на генома на вируса на хепатит С и клетъчната система за откриване на лекарството срещу вируса на хепатит С. A: HCV геномна РНК и вирусни протеини. Геномната РНК на HCV кодира един полипротеин от 3011 аминокиселини. След като се транслира, полипротеинът се преработва в 4 структурни протеина (Core, E1, E2 и p7) и 6 неструктурни (NS) протеини (NS2, NS3, NS4A, NS4B, NS5A и NS5B). Кодиращият полипротеин регион е фланкиран от 5 ’и 3’NTR. Вирусната РНК също служи като шаблон за репликация на вирусен геном и двете NTR модулират синтеза на вирусен протеин и репликацията на генома; Б: Клетъчната система на HCV репликон. Huh-7 клетки бяха трансфектирани с луциферазния ген, свързан с HCV субгеномна РНК, включително кодиращите области надолу по веригата на NS3. Експресията на HCV субгеномна РНК може да бъде количествено определена чрез луциферазна активност. HCV: Вирус на хепатит С; NTRs: Непреведени региони.
ТЕРАПЕВТИЧНИ ВАРИАНТИ ЗА ХРОНИЧНА HCV ИНФЕКЦИЯ
В момента комбинацията от пегилиран α-интерферон и широкоспектърно антивирусно лекарство, рибавирин, се използва като стандартна терапия за хронична HCV инфекция [2,5,6]. Генотипът на HCV обаче е важен фактор, определящ неговата ефикасност и поносимост. Докато вирусологичният отговор на тази комбинирана терапия е повече от 70% за генотипове 2 и 3, той е по-малко от 50% за генотип 1 [18-20]. Освен това, тази терапия причинява значителни странични ефекти като тромбоцитопения, грипоподобни симптоми, треска, обрив, анорексия и дисфункция на щитовидната жлеза. Депресията и раздразнителността, изразени като невропсихологични разстройства по време на терапията, влошават качеството на живот универсално. Следователно се изискваше да се установи нов терапевтичен метод без сериозни неблагоприятни ефекти.
Напоследък клинично са изследвани DAA, които инхибират специфични за HCV протеини [7,8]. Две DAA, боцепревир и телапревир, за първи път се появиха на пазара на лекарства за HCV и бяха одобрени от FDA през май 2011 г. Боцепревир или телапревир бяха използвани като тройна терапия с пегилиран α-интерферон и рибавирин за пациенти с хепатит С с генотип 1 [9]. Тези DAA са инхибитори срещу HCV NS3/4A серин протеаза и се свързват ковалентно с активното място на ензима [21-23]. Тройната терапия с използване на боцепревир или телапревир значително увеличава степента на траен вирусологичен отговор (SVR) за наивни или преди лекувани пациенти с хепатит С с HCV генотип 1 [24-29]. След това се съобщава, че DAA от следващо поколение, ABT-450/r, симепревир и фалдапревир, които също са NS3/4A протеазни инхибитори, имат предимства от своето удобство и подобрен профил на страничните ефекти [30-32]. Освен това, даклатасвир и софосбувир, които са инхибитор на NS5A репликационен комплекс и нуклеотиден аналог NS5B инхибитор на полимеразата, също повишават скоростта на SVR [33-35]. По-специално, комбинацията от тези DAAs е само високоефективно лечение за пациенти с HCV генотип 1 [36,37] и е възможно лечението на HCV без интерферон и рибавирин.
Докато пациентите с хепатит С могат да бъдат лекувани от гореспоменатите DAAs без значителни странични ефекти, това изисква високи медицински разходи и ограничава достъпа до терапията в чувствителни към разходите страни [38]. От 20-те страни с високо разпространение на HCV, 12 са категоризирани като държави с нисък или по-нисък среден доход [39]. Следователно все още се изискват нови анти-HCV агенти, които са безопасни, икономични и допълват настоящите терапии и ние фокусираме вниманието върху функционалните храни и техните съставки.
ФУНКЦИОНАЛНИ ХРАНИТЕЛНИ СЪСТАВКИ, ЕФЕКТИВНИ ЗА HCV
Развитието на свързана с HCV чернодробна цироза и хепатоцелуларен карцином изисква продължителен период (20-30 години). Следователно, прогресирането на болестта и заразността с HCV може да бъде повлияна от диета, включваща млечни продукти. Известно е, че функционалните храни и техните съставки са способни да модулират различни биологични процеси като апоптоза и привличат интерес като природни ресурси за профилактика и лечение на рак [10,11,40]. Предполага се, че диетичните полифеноли, получени от различни плодове и зеленчуци, са ефективни в превенцията на рака. Въпреки че значението на функционалните хранителни съставки като DAA срещу HCV не е напълно признато, тези открития предполагат, че те допринасят за елиминирането на вируса.
Химическа структура на функционални хранителни съставки с анти-хепатит С вирусни активности. A: Епигалокатехин-3-галат; Б: Куркумин; С: Кверцетин; D: Пуникалагин; Е: Нарингенин; F: Диосгенин; G: (-) - епикатехин.
Клинично се съобщава, че добавянето на витаминна група повишава нивата на SVR при пациенти с хроничен хепатит С, които са били подложени на стандартната терапия с пегилиран α-интерферон и рибавирин [52-54]. По отношение на значителните странични ефекти на стандартната терапия, функционална храна на основата на домати, богата на естествени антиоксиданти, облекчава тежестта на анемията, причинена от рибавирин, и подобрява поносимостта към лекарството [55].
ОЛИГОМЕРНИЯТ ПРОАНТОЦИАНИДИН ОТ ЛИСТОВИТЕ БОРБИ ИМА ПОТРЕБИТЕЛНА АКТИВНОСТ ПРОТИВ РЕПЛИКАЦИЯ НА СУБГЕНОМ НА HCV В VITRO
За да идентифицираме функционални хранителни съставки, ефективни за хепатит С, ние проверихме изчерпателно екстрактите от често погълнати селскостопански продукти (1700 проби от 283 вида), отглеждани в префектура Миядзаки, Япония, използвайки система от клетки на репликон на HCV [13]. Първо бяха избрани проби с висока антиоксидантна активност, независимо от годни за консумация или негодни за консумация части, а след това бяха изследвани инхибиторните дейности срещу HCV субгеномна репликация на РНК с помощта на системата. Установихме, че екстрактите от листа от боровинки значително потискат репликацията. Освен това, чрез сравняване на инхибиторните дейности, използвайки листа от различни видове боровинки, беше установено, че листата на заешко око боровинка (Vaccinium virgatum Aiton) имат най-висока активност [13]. Заешкото боровинка се отглежда в регион с топъл климат, като южните райони на Япония, включително префектура Миядзаки. Съобщава се също, че листата му са добри източници на полифеноли и естествени антиоксиданти [56].
Идентифицирахме олигомерния проантоцианидин като инхибитор на получените от боровинки листа на субгеномна репликация на РНК на HCV [13]. Проантоцианидинът е полифенол и има полимеризирани структури, в които повече от две флаван-3-олови единици като катехин (фигура (фигура 3А) 3А) и епикатехин (фигура (фигура 2G) 2G) са ковалентно свързани. Фигура Фигура ЗВ 3В показва пример за химичната структура на проантоцианидин. Проантоцианидинът притежава две междуфлавани връзки, при които А-типът и В-типът имат две връзки за връзка (C4 → C8 и O7 → C2) и една връзка (C4 → C8 или C4 → C6), съответно [57], и двата типа съществуват едновременно в проантоцианидин от растението боровинки на заешко око [13]. Докато катехинът, епикатехинът, EGCG и димерите като процианидин В2 не проявяват инхибираща активност срещу HCV субгеномна експресия в нашата експериментална система, проантоцианидиновият олигомер със степен на полимеризация от 8 до 9 значително инхибира тази експресия [13]. Това откритие предполага, че инхибиторната активност на HCV на олигомерния проантоцианидин в репликоновия анализ може да изисква олигомеризирана структура.
Химични структури на флаван-3-ол и проантоцианидин. A: (+) - катехин; Б: Пример за процианидин В-тип полимер със (-) - епикатехинова структура.
Съобщава се също, че проантоцианидин притежава антивирусна активност срещу други вируси, херпес симплекс вирус и човешки имунодефицитен вирус тип 1 [61-65]. Доколкото ни е известно, първо съобщихме, че проантоцианидиновият олигомер инхибира експресията на HCV субгеномна РНК [13]. Понастоящем обаче ефектите на олигомерния проантоцианидин върху репликацията на HCV в хепатоцитите in vivo остават неизвестни.
ДЕЙСТВИТЕЛЕН МЕХАНИЗЪМ НА ОЛИГОМЕРЕН ПРОАНТОЦИАНИДИН В РЕПЛИКОННИ КЛЕТКИ НА HCV
Потискането на HCV субгеномната репликация на РНК от олигомерен проантоцианидин привлича все по-голямо внимание. Полифенолните съединения обикновено имат висока антиоксидантна активност [10,11,58]. Следователно, неспецифичната антиоксидантна активност на полифенолите може да допринесе за потискане на HCV субгеномната репликация на РНК от олигомерен проантоцианидин. Въпреки това, ние изследвахме други полифенолни съединения в нашия анализ на HCV репликон и установихме, че конституционалните единици като катехин и епикатехин не проявяват супресивна активност, което изисква олигомеризираната структура на проантоцианидин [13]. Въпреки че понастоящем остава неизвестно дали проантоцианидин олигомерът може да бъде преместен в клетките въпреки структурата, съобщава се, че съставката се абсорбира от храносмилателния тракт [66,67], което предполага интернализация в клетките. Олигомерният проантоцианидин изглежда потиска субгеномната репликация на РНК на HCV чрез специфична асоциация с определени вътреклетъчни молекули.
Протеомичният подход, използващ двуизмерна диференциална гел електрофореза, комбинирана с масспектрометрия, предоставя мощен инструмент за определяне на клетъчния отговор на функционални храни [40]. За да се изясни механизмът на действие на олигомерния проантоцианидин в HCV репликон клетки, ние извършихме протеомен анализ на проантоцианидин-свързващи протеини, пречистени чрез афинитетна хроматография [13]. След това клетъчни протеини от репликонови клетки, имащи по-висок афинитет към проантоцианидин, отколкото катехин, бяха идентифицирани чрез масспектрометричен анализ и дали идентифицираните протеини са свързани с експресия на HCV РНК, беше допълнително изследвано с помощта на анализ на репликон, базиран на siRNA (Фигура 4). 4). Предполага се, че четири хетерогенни ядрени рибонуклеопротеини (hnRNPs), hnRNP A/B, A2/B1, K и L са възможни клетъчно свързващи протеини на олигомерен проантоцианидин. Докато siRNA, насочена към hnRNP A/B, K и L, показва слаба инхибиторна активност, нокдаунът на hnRNP A2/B1 значително потиска субгеномната репликация на HCV [13].
Стратегия за идентифициране на кандидат протеини, участващи в медиираното от проантоцианидин инхибиране на субгеномната експресия на вируса на хепатит С [13]. Общите протеини бяха извлечени от репликоновите клетки на вируса на хепатит С (HCV) и след това проантоцианидин-свързващите и катехин-свързващите протеини бяха пречистени чрез афинитетна хроматография, използвайки сефарозни зърна, съчетани съответно с проантоцианидин и катехин. Пречистените протеини се разделят чрез двумерна електрофореза, последвано от откриване на петна от протеини с по-висок афинитет към проантоцианидин, отколкото катехин (стрелки). Масспектрометричният анализ и по-нататъшният скрининг чрез анализ на репликон, базиран на siRNA, показа, че hnRNP A2/B1, A/B, K и L са кандидат протеини, участващи в олигомерното медиирано от проантоцианидин инхибиране на HCV субгеномна експресия. hnRNP: Хетерогенен ядрен рибонуклеопротеин.
HnRNPs включват семейство РНК-свързващи протеини, които участват в различни РНК-свързани биологични процеси [68]. Те са многофункционални протеини, съставени от основни и второстепенни hnRNP протеини, и hnRNP A/B, A2/B1, K и L, които идентифицирахме, принадлежат към основните hnRNPs [69]. Предишни проучвания демонстрираха, че тези hnRNPs регулират метаболизма на РНК, като например сплайсинг и транскрипция преди mRNA [70-76]. Например беше показано, че hnRNP A2/B1 влияе на алтернативното снаждане на няколко туморни супресори и онкогени в глиобластомни клетки [72]. Освен това няколко проучвания съобщават за взаимодействия и сътрудничество между тези hnRNP [77-79]. Доказано е също, че hnRNP A2 и hnRNP L съществуват като комплекс и регулират експресията на глюкозен транспортер-1 чрез свързване с mRNA 3’NTR [80,81].
В жизнения цикъл на HCV, hnRNPs са свързани с HCV геномна РНК и регулират неговата репликация. Показано е, че hnRNP A1, който показва висока хомология с hnRNP A2/B1, улеснява репликацията на HCV чрез свързване към HCV 5 'и 3'NTR (Фигура (Фигура 1), 1) и репликацията е значително потисната от двойния нокдаун на hnRNP A1 и hnRNP A2 [82]. hnRNP K и hnRNP L също са NTR-свързващи протеини [83-85]. Освен това, всички hnRNP, които идентифицирахме като целеви протеинови кандидати на олигомерен проантоцианидин, бяха включени в HCV 3’NTR-свързващи протеини [86]. Като цяло тези открития предполагат, че комплекс, съставен от hnRNP A2/B1, A/B, K и L, може да служи за репликация на геном на HCV чрез свързване с NTR и олигомерният проантоцианидин е инхибитор на репликационния комплекс. Тази възможност трябва да бъде разгледана в по-нататъшно проучване.
ЗАКЛЮЧЕНИЕ
В момента комбинация от пегилирани рекомбинантни интерферони и рибавирин се използва като стандартна терапия за пациенти с хепатит С. Очаква се наскоро възникналите DAA да предоставят нови обещаващи възможности за лечение при пациенти с хепатит С. Въпреки това високите им медицински разходи могат да затруднят разпространението в световен мащаб. Демонстрирахме, че екстрактите от листа на боровинки потискат репликацията на подгеном на HCV in vitro и тяхната активна съставка е олигомерен проантоцианидин [13]. Изследванията на основния механизъм на действие предполагат, че проантоцианидин може да бъде инхибитор на няколко hnRNPs като hnRNP A2/B1 [13]. От друга страна, понастоящем остава неизвестно дали олигомерната форма на проантоцианидин, която е необходима за инхибиране на репликацията на HCV, може ефективно да се абсорбира от храносмилателния тракт, за да поддържа ефективни плазмени концентрации in vivo. По-нататъшните основни изследвания на механизма на действие на олигомерния проантоцианидин срещу репликацията на HCV могат да отворят начини за разработване на нови анти-HCV лекарства и добавки за пациенти в света по целия свят.
ПРИЗНАВАНИЯ
Посвещаваме тази работа на г-н Fumiaki Mieno (починал, 19 март 2013 г.), който вдъхнови нашата работа в защитата и експлоатацията на интелектуалната собственост. Благодарим на Sachiko Tomiyama, Tokoyo Imai, Toshiro Morishita и Makoto Kodama (Фондация за индустриална подкрепа на префектура Миядзаки) за координирането на нашето проучване.
Бележки под линия
Подкрепено от Сътрудничеството на регионалните организации за напредък в технологичните постижения от Японската агенция за наука и технологии
P- Рецензент: Ampuero J, Chuang WL, Conti B, Hernanda PY, Tijera MFH, Qin JM S- Редактор: Tian YL L- Редактор: A E- Редактор: Liu SQ
- Храни, които подпомагат детоксикацията на черния дроб; Бриджит Данър, треньор по функционално здраве; Detox Expert
- Функционални формули - Органични формули за хранене и заместване на пълнозърнести храни
- Разработване на функционални хранителни продукти, Технологични тенденции, Тестване на ефикасността и Годишен доклад за безопасност
- Диетичен дневник Функционални храни и японски FOSHU - Храни за конкретно здраве Нас Новини за начина на живот, The
- Честите киселини предизвикват мазни храни, алкохол, цитрусови плодове и др