Giles S. H. Yeo
Съвет за медицински изследвания (MRC), Отдел за метаболитни заболявания, Университет в Кеймбридж, лаборатории за метаболизъм, Wellcome Trust-MRC Институт по метаболитни науки, каре 289, болница Addenbrooke’s, Кеймбридж, CB2 0QQ Великобритания
Свързани данни
Резюме
На едно ниво затлъстяването очевидно е проблем на простата физика, резултат от прекалено много ядене и не изразходване на достатъчно енергия. По-сложният въпрос обаче е защо някои хора ядат повече от други? Изследванията на генетиката на хора и мишки през последните две десетилетия разкриха редица пътища в мозъка, които играят ключова роля в контрола на приема на храна. Основен пример е пътят лептин-меланокортин, който сега знаем, че допринася значително за апетитивното поведение на бозайниците. Генетичното нарушение на този път обаче остава рядко и не представлява основната тежест на болестта, която се носи от тези от нас с „общо затлъстяване“. През последните години проучвания за асоцииране в целия геном разкриха повече от 100 различни кандидат-гени, свързани с ИТМ, като повечето (включително много компоненти на пътя на меланокортина) действат в централната нервна система и влияят върху приема на храна. Така че, докато тежкото нарушаване на пътя на меланокортина води до тежко затлъстяване, фините вариации в тези гени влияят на това къде може да седнете в нормалното разпределение на ИТМ. Тъй като сега навлизаме в този „постгеномичен“ свят, може ли тази нова информация да повлияе на нашето лечение и управление на пациенти със затлъстяване?
Електронен допълнителен материал
Онлайн версията на тази статия (doi: 10.1007/s00125-016-4187-x) съдържа шейсет от фигурите за изтегляне, която е достъпна за оторизирани потребители.
Въведение
Затлъстяването е може би най-голямата заплаха за общественото здраве на 21 век. Разпространението му се е увеличило драстично през последните три десетилетия в почти всички развити икономики и се превръща в значителна тежест в много други нововъзникващи икономики. Въпросът е не само затлъстяването, но и съпътстващите го съпътстващи заболявания, като диабет тип 2, сърдечно-съдови заболявания, хипертония и някои видове рак, които служат за усилване и изостряне на проблема. Въпреки че променящият ни се начин на живот и обстановка несъмнено са предизвикали увеличаването на затлъстяването, все още има големи различия в отговора на тази „обезогенна“ среда. Съществува мощен генетичен компонент, който стои в основата на тази вариация, както се разкрива от неговата корелация с ИТМ (тегло в kg/височина в m 2) в проучвания на близнаци и осиновяване. Тези изследвания показват, че наследствеността на мастната маса е между 30% и 70% [1, 2]. В резултат на това генетичните подходи могат да се използват, за да се характеризират основните физиологични и молекулярни механизми, контролиращи приема на храна и телесното тегло, което ни позволява да разберем как те могат да се различават между слабите и затлъстелите индивиди.
През последните 20 години проучванията на генетиката на хора и мишки разкриха редица пътища в мозъка, които играят ключова роля в контрола на приема на храна (прегледано в [3]). От тях най-добре характеризираният механизъм е сигналният път на хипоталамусния лептин-меланокортин, който сега знаем, че допринася значително за апетитивното поведение на бозайниците [4]. По-голямата част от моногенните разстройства, които водят до тежко затлъстяване както при мишките, така и при хората, включват генетично нарушение на този път [3].
Има две „стари кучета“, които движат разказа на този преглед; първият е алегоричен и представлява пътя на меланокортина (фиг. 1), докато вторият се отнася до проучване за генетиката на затлъстяването при действителни кучета. Тук ще начертая накратко историята на пътя на меланокортина в енергийната хомеостаза и след това ще подчертая някои съвременни изследвания, които разкриват „нови трикове“, произтичащи от „старото куче“. След това ще обсъдя как тези редки генетични заболявания, които водят до тежко затлъстяване, са успели да информират по-често срещаните форми на затлъстяване и ще проуча дали тази нова информация може да повлияе на нашето лечение и управление на пациенти със затлъстяване.
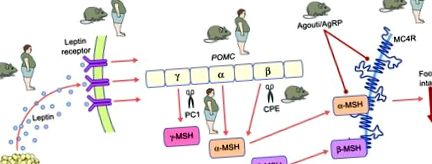
Старото куче. POMC претърпява обширна посттранслационна обработка, за да генерира набор от по-малки биологично активни меланокортинови пептиди. Меланокортиновата сигнализация чрез MCR4 играе ключова роля в енергийната хомеостаза. Нарушаването на пътя лептин-меланокортин води до тежко затлъстяване при хора и мишки. Съществуването на синдром на човешко моногенно затлъстяване или модел на затлъстела мишка е илюстрирано с „затлъстял човек“ или „затлъстела мишка“. Редовете, завършващи в кръг, показват антагонизъм на рецептора. AgRP, свързан с гути пептид; CPE, карбоксипептидаза Е; PC1, прохормона конвертаза 1
Старо куче: пътят лептин-меланокортин
Меланокортиновият път е един от ключовите ефекторни механизми на лептиновата сигнализация в мозъка (фиг. 1). Централният и едноименен компонент на пътя е про-опиомеланокортин (POMC), който претърпява обширна посттранслационна обработка, за да генерира набор от по-малки биологично активни меланокортинови пептиди, както и β-ендорфин и β-липотрофин. Меланокортиновите пептиди са агонисти на пет меланокортинови рецептори, меланокортин 1 рецептор (MC1R) до –MC5R, чрез които те медиират много различни функции (прегледани в [3, 4]); меланокортин пептид сигнализиране чрез MC4R играе ключова роля в енергийната хомеостаза. Всъщност, както Pomc/POMC-дефицитни мишки [10], така и хора [11] развиват хиперфагия и затлъстяване, а генетичното делеция на Mc4r/MC4R при мишки [12] и хора [13, 14] води до тежко хиперфагично затлъстяване. Всъщност и до днес MC4R мутациите остават най-често срещаната моногенна форма на затлъстяване, като патогенни мутации се откриват в до 5% от случаите на тежко детско затлъстяване [15] и до 1% от общата популация с ИТМ> 30 kg/m 2 [16]. По-специално, степента на рецепторна дисфункция (измерена чрез in vitro анализи) може да се използва за предсказване на количеството храна, изядено от пациента, което носи тази конкретна мутация по време на тестово хранене [15].
Нови трикове за POMC
През последните години се появиха нови открития, които дават все по-нюансирана представа за пътя на меланокортина и по-специално за POMC. Някои от тези констатации са очертани на фиг. 2 и обсъдени по-подробно в този раздел.
Нови трикове. Последните открития в биологията на POMC демонстрират, че: (1) частичното заличаване на POMC води до затлъстяване при лабрадор ретривърите поради повишена мотивация за храна [19]; (2) хиперметилирането в POMC локуса и по този начин понижаването на меланокортинергичния тонус е свързано със затлъстяването [22, 23]; и (3) човешкият POMC дефицит може да бъде лекуван със сетмеланотид, MC4R агонист, което води до намален прием на храна [24]
Дебели лабрадори (Флабрадори)
Изследването на хора с POMC мутации, които водят до специфична дисрегулация на β-меланоцит-стимулиращ хормон (MSH) [17, 18], предполага, че β-MSH е важен за контролиране на приема на храна и телесното тегло при човека. Въпреки това, въпреки че много от механистичните подробности относно сигнализирането за меланокортин са изяснени с помощта на модели на гризачи, гризачите нямат проксималното място за двустранно разцепване, необходимо за производството на β-MSH. По този начин, in vivo изследването на ролята на β-MSH в апетитивното поведение доскоро беше доста ограничено. Като алтернатива на моделите на гризачи, кучетата, които носят делеция от 14 bp в POMC, която нарушава само кодиращите последователности на β-MSH и β-ендорфин [19], представляват „чист“ модел на дефицит на β-MSH/β-ендорфин и по този начин предоставя идеална възможност за изучаване на ролята на тези хормони в поведението на хранене.
Всички кучета произлизат от сивия вълк и са опитомени преди около 12 000–20 000 години. Съвременните породи кучета обаче произхождат сравнително наскоро от малък брой животни-основатели. Поради този феномен на „тесни места“ дисекцията на генетичната основа на кучешките черти е по-податлива, отколкото при други по-безпородни видове, като хората [20]. Ние се интересувахме от изучаването на генетиката на затлъстяването при кучета и започнахме с лабрадорските ретривъри, които са по-мотивирани от храните от другите породи [21]. Установихме, че 20% от лабрадорите са хетерозиготни и 2% са хомозиготни за делецията от 14 bp в POMC и че тази мутация е свързана с по-голяма мотивация за храна и повишено телесно тегло [19]. В допълнение към лабрадорите, 38 други породи кучета също са били скринирани за тази мутация, но тя е открита само в тясно свързания плосък ретривър, в който тя е свързана и с повишена мазнина и хранителна мотивация [19] .
Това, което е особено интригуващо, е, че докато 22% от лабрадорите за домашни любимци са носили POMC делецията в нашето проучване, 80% от лабрадорите, които стават кучета водачи, също имат делецията. Тъй като кучетата водачи по същество са отговорни за човешкия живот, те са много добре подбрани за темперамент и тренируемост, а „положителното подсилване“ с хранителни награди играе ключова роля по време на обучението. Установихме, че честотата на алелите в локуса на POMC е значително извън равновесието на Харди-Вайнберг в водещите запаси за разплод на кучета, подкрепяйки нашата хипотеза, че кучета, носещи POMC делеция, може да са по-склонни да бъдат избрани [19]. По този начин, въпреки че започнахме проучването, за да разберем генетиката на затлъстяването и хранителната мотивация, ние също започнахме да разкриваме мъчителни улики за други по-сложни черти, тези на темперамента и тренируемостта.
POMC епигенетика
Друг „нов трик“ се появява от два доклада от групата на Krude, предоставящи доказателства, че рискът от често срещани заболявания може да зависи и от вариации в епигенетичните белези в специфични локуси на гена POMC [22, 23]. В първоначално проучване през 2012 г. Кюнен и колеги идентифицират два CpG острова в локуса на POMC и определят техния статус на метилиране при слаби и затлъстели деца. Те откриха, че има значително увеличение на метилирането на CpGs на границата на интрон 2/екзон 3 на гена POMC при затлъстели деца спрямо слаби деца [22]. Това хиперметилиране при екзон 3 пречи на свързването на р300 транскрипционния усилвател, което води до намалена експресия на POMC. Това беше първият вариант на метилиране на ДНК, свързан с риска от затлъстяване. Във второ проучване същата група показа, че метилирането в променливо метилиран регион (VMR) в POMC, за разлика от отделните CpG, е силно свързано с индивидуалния ИТМ. Те откриха, че множество фактори могат да предизвикат POMC VMR метилиране в ранния ембрион и че ИТМ е пряко свързан с нивото на метилиране като непрекъсната черта [23].
Въпреки че тези констатации са произлезли от същата група и следователно тепърва трябва да бъдат възпроизведени, концептуално, повишените състояния на метилиране и в двата случая най-вероятно представляват по-фино понижаване на меланокортинергичния тонус, поради което го свързват с подходящо едва доловимо увеличение на ИТМ. Тези констатации са в съответствие с гореспоменатата констатация, че величината на дисфункцията на MC4R може да предскаже приема на храна при тестово хранене ad libitum [15], като се подчертава, че меланокортиновата система не действа по двоичен начин на включване/изключване, а като реостат.
Лечение на дефицит на POMC
Успешното използване на сетмеланотид отвори врати за клинични изпитвания за лечение на други моногенни дефицити на пътя лептин-меланокортин, като дефицит на MC4R (който се среща в далеч по-голяма кохорта от дефицита на POMC) и дефицит на лептинов рецептор, страдащите от които, по очевидни причини са устойчиви на лечение с лептин. Понастоящем тези изследвания продължават и ние на място очакваме резултатите с нетърпение. Крайната цел е ясно да се изпробва setmelanotide за лечение на по-често срещани форми на затлъстяване. Преди това да се случи обаче, ще трябва да се дефинират по-подробно неговите механизми на действие, както централни, така и периферни.
Сложна простота
Ами общоприетото полигенно затлъстяване тогава? Изминаха близо 10 години от публикуването на първите проучвания за асоцииране в целия геном на затлъстяването (GWAS) [26], като много други бяха публикувани през междинния период (прегледани в [27]). Заслужаваше ли си инвестицията? По-близо ли сме до разкриването на основната биология на затлъстяването?
След първоначалния шум и свръх очаквания, последван от неизбежния негатив и люлка в обратната посока, прахът вече се е уталожил достатъчно, за да позволи студен и твърд поглед върху информацията за честото затлъстяване, предоставена от GWAS. Докато познанията за действителните механизми все още не са на място, се появи изненадващо убедителен разказ относно генетичната архитектура на често срещаното затлъстяване: (1) гените, които се намират най-близо до единичните нуклеотидни полиморфизми (SNP), свързани със съотношението талия: ханш (т.е. където се отлагат мазнините ви), обикновено се изразяват основно в мазнини [28]; (2) гените, които се намират най-близо до SNPs, свързани с ИТМ (т.е. колко мазнини имате), се изразяват предимно в централната нервна система [29]. Всъщност сега е установено, че SNP в над 100 здрави и добре реплицирани локуса влияят върху ИТМ. От тези SNP може да се генерира оценка на риска от затлъстяване, като всеки SNP има възможен резултат 2 (хомозиготен за алела на риска), 1 (хетерозиготен) или 0 (хомозиготен за нерисковия алел). Когато се начертава срещу достатъчно голяма популация, оценката на риска следва нормално разпределение и нарастващият резултат на риска е пряко свързан с увеличаване на ИТМ [29] (Фиг. 3).
Оценката на риска от затлъстяване е пряко свързана с ИТМ в популацията. Схематична фигура, илюстрираща, че оценката на риска от затлъстяване, изчислена чрез идентифицирани от GWAS SNP, е пряко свързана с ИТМ (в червено). Честотата (в лилаво) на оценката за риск от затлъстяване се увеличава отляво надясно, следвайки нормалното разпределение в популацията
Какво ще кажете за централната ни тема, за нашето „старо куче“? Е, по-внимателният поглед върху идентичността на някои от тези гени разкрива много членове на пътя лептин-меланокортин; сред тях POMC и MC4R [29]. И така, това, което е ясно е, че докато мозъчният път на лептин-меланокортин е от основно значение за контрола върху приема на храна от бозайници с генетични смущения, водещи до екстремно затлъстяване, фините вариации в същите тези гени влияят върху позицията на индивида при нормалното разпределение на ИТМ.
Въпросът за 64 милиона долара
Когато навлизаме сега в този „постгеномичен“ свят, може ли тази нова (и не чак толкова нова) генетична информация, която беше обсъдена тук, да повлияе на лечението и управлението на затлъстели пациенти? По-близо ли сме до „прецизната медицина“ за затлъстяването? Накратко, отговорът в момента е „зависи“. За моногенните форми на затлъстяване отговорът е категорично „да“. Вече можем да използваме геномната медицина, за да идентифицираме и потенциално лекуваме 1% от населението с ИТМ> 30 kg/m 2, които съдържат генетични мутации в рамките на пътя лептин-меланокортин. Използването на прецизни лекарства за информиране на лечението на често срещано полигенно затлъстяване обаче е съвсем друга история, тъй като прогнозната стойност на тези SNP и оценките на риска са все още много лоши за всеки даден индивид. Това е вероятно поради комбинация от малкия размер на ефекта, заедно с неизмеримите досега по-широки генетични и екологични влияния.
Първо, удивително е, че в област, която използва такава модерна технология, способността ни да измерваме точно и точно приема на храна и енергийните разходи в голям мащаб (при десетки до стотици хиляди хора) е все още много примитивна. Ще трябва да решим този проблем, ако наистина искаме да пренесем областта на нутригеномиката от каменната ера до 21 век. Като се има предвид това, това не е попречило на търговските субекти да се намесят и да предложат „нутригеномика“, „геномика на упражненията“, „персонализирани планове за отслабване“ и всякакви други прогнози, базирани на „омика“. Очевидно генетичната технология е достигнала етапа, когато тя вече не е ограничаващ фактор и почти всеки с генетичен анализатор може точно да генерира генетична информация. Проблемът, разбира се, е в интерпретацията и тези шарлатани (това са те) фундаментално не разбират разликата между риска и прогнозата. Въпреки това, джинът вече е излязъл от бутилката и всеки от нас вече може да отскочи до местната ни аптека или да кликне онлайн, да плати 100–200 £/$/€ и да получи генетичния си профил. Това би трябвало да е достатъчна мотивация за научната общност да обедини своите действия и да осигури реална генетична интерпретация за обществеността.
Обобщение
В заключение, фактът, че пътят лептин-меланокортин е ключов контролер на апетитивното поведение на бозайници, сега е „старо куче“ в тази област. И все пак новите изследователски трикове продължават да ни позволяват да постигнем по-задълбочено и по-нюансирано разбиране в тази област. Настоящият фокус на фармакологичните терапии е насочен към лица с дефицити в пътя лептин-меланокортин (виж текстовото поле: резюме). Въпреки това, генетичните нарушения на този път все още остават редки, докато повечето хора страдат от „общо затлъстяване“, което представлява основната заплаха за общественото здраве. Следователно, докато ние постигнахме огромни крачки в нашето разбиране на механизмите, контролиращи приема на храна и телесното тегло, трябва спешно да се направи напредък, за да се даде възможност за оптимално управление и лечение на често срещаното затлъстяване.
- Генетика на затлъстяването Egyptian Journal of Medical Human Genetics
- Генетика на затлъстяването - ScienceDirect
- Изчерпателен преглед на затлъстяването и психологически съображения за лечение Психология, здраве
- Естрадиол и лептин при жени със затлъстяване, наднормено тегло и нормално телесно тегло Fitri Indonesian
- Заключения - Използването на мерки за затлъстяване в детска възраст за прогнозиране на затлъстяването и