Резюме
Заден план
Честото хранене с богати на въглехидрати ястия или непрекъснато ентерално хранене е избраната терапия при заболяване за съхранение на гликоген (гликогеноза) тип III. Последните насоки за диагностика и управление препоръчват често хранене с високо сложни въглехидрати или царевично нишесте, като се избягва гладуването при деца, докато при възрастни се препоръчва диета с ниско съдържание на въглехидрати и високо съдържание на протеини. Въпреки че този режим може да предотврати хипогликемия при деца, той не подобрява функциите на скелета и сърдечния мускул, които са компрометирани при пациенти с гликогеноза IIIa. Прилагането на въглехидрати може да предизвика реактивен хиперинсулинизъм, което води до потискане на липолизата, кетогенезата, глюконеогенезата и активирането на синтеза на гликоген. По този начин сърцето и скелетните мускули са изчерпани от енергийни субстрати. Модифицираната диета на Аткинс води до повишени кръвни нива на кетонни тела и мастни киселини. Предполагаме, че тази здравна намеса подобрява енергийния баланс на мускулите.
Методи
Ние лекувахме 2 момчета с гликогеноза IIIa на възраст 9 и 11 години с модифицирана диета на Аткинс (10 g въглехидрати на ден, протеини и мастни киселини ad libitum) за период от 32 и 26 месеца, съответно.
Резултати
И при двамата пациенти нивата на креатин киназа в кръвта спадат в отговор на диетата на Аткинс. Когато диетата беше оттеглена при един от пациентите, той се оплака от болка в гърдите, намалена физическа сила и нивата на креатин киназа бързо се увеличиха. Това беше обърнато, когато диетата на Аткинс беше въведена отново. Един пациент страда от тежка кардиомиопатия, която значително се подобрява при диета.
Пациентите с гликогеноза IIIa се възползват от подобрено енергийно състояние на сърцето и скелетните мускули чрез въвеждане на диетата на Аткинс както на биохимично, така и на клинично ниво. Освен преходна хипогликемия не са наблюдавани сериозни неблагоприятни ефекти.
Заден план
Заболяване за съхранение на гликоген тип III (GSD III) е наследствено метаболитно заболяване, причинено от дефицит на гликогеновия ензим амило-1,6-глюкозидаза и води до натрупване на абнормен гликоген („граница на декстрин“).
Известни са два клинични типа GSD III:
GSD IIIa с чернодробно и мускулно засягане и GSD IIIb само с чернодробно засягане [1], [2].
При GSD IIIa кардиомиопатията може да доведе до значителна заболеваемост [3] - [5].
Хипогликемията може да бъде предотвратена чрез често хранене с богати на въглехидрати ястия, непрекъснато ентерално хранене или прилагане на неварено царевично нишесте [6] - [8]. Този режим не подобрява функцията на сърдечните и скелетните мускули [9]. Сърдечната дисфункция се лекува симптоматично. Последните проучвания препоръчват богата на протеини диета [10] - [12], която също е допълнена с кетонни тела [9]. Дори се предлага ензимна заместителна терапия при GSD III, подкрепяща неудовлетворената нужда от ефективно лечение [13]. Кришнани и др. публикува насоки за диагностика и управление на GSD III, застъпващи се за предотвратяване на гладно, чести хранения с високо сложни въглехидрати или прилагане на царевично нишесте при деца, докато възрастните могат да бъдат лекувани с диета с ниско съдържание на въглехидрати и високо съдържание на протеини [14].
Докато богата на въглехидрати диета предотвратява хипогликемия на гладно, в повечето случаи това може да доведе до изтощение на енергия на скелетния и сърдечния мускул по следния механизъм: Прилагането на храна с високо съдържание на въглехидрати предизвиква реактивен хиперинсулинизъм с последващо потискане на липолиза, кетогенеза, глюконеогенеза и активиране на синтез на гликоген [15]. По този начин мастните киселини, кетонните тела и глюкозата като гориво за скелетните мускули и сърцето се изчерпват.
Потискането на секрецията на инсулин изглежда желателно при GSD IIIa, но обикновеният хипокалоричен катаболизъм ще доведе до хипогликемия. Евкалоричната кетогенна диета води до повишени кръвни нива на кетонни тела като алтернативни субстрати за мозъка. В същото време повишените нива на кетонни тела и мастни киселини служат като енергиен субстрат за сърцето [16] и скелетните мускули. По този начин се подобрява енергийният баланс на мускулите. Спазването на класическата кетогенна диета често се затруднява от неприемливостта и необходимостта от изчисляване на съотношението между приема на мазнини и протеини и въглехидрати, което трябва да бъде 4 (3): 1. За да подобрим спазването, препоръчваме да използвате модифицирана диета на Аткинс (MAD), при която дневният прием на въглехидрати е ограничен до 10 g, докато е разрешен свободен достъп до протеини и се насърчава приема на мазнини.
Съобщаваме за лечение на 2 момчета с GSD IIIa от MAD.
Методи
Пациент 1
Момчето от добива на Шри Ланка е на 9 години при започване на MAD. Той е диагностициран с GSD III на възраст от 7 месеца поради двигателна изостаналост, миопатия и хепатомегалия.
Първоначално той представи повишени чернодробни ензими (ALT 711 U/l, AST 733 U/l и y-GT 52 U/l) и повишена активност на креатин киназата (CK) в серума (514 U/l). Пациентът претърпява многократни епизоди на хипогликемия с минимални нива на глюкоза в кръвта от 0,1 mmol/l. GSD III беше заподозрян и потвърден от липсата на амилоглюкозидазна активност в кръвните клетки. Повишената концентрация на гликоген в червените кръвни клетки от 20 mg/dl (нормален диапазон 0–10 mg/dl) е в съответствие с тази диагноза. Мутационният анализ показа хомозиготност за мутацията c.4256dupC. Ехокардиографията разкрива лека хипертрофична кардиомиопатия.
Пациентът първоначално е бил лекуван с интравенозна инфузия на глюкоза, впоследствие малтодекстрин е даван чрез непрекъснато ентерално хранене през нощта, за да се предотврати хипогликемия със скорост 7–9 mg/kg на минута. Стабилизирането на кръвната глюкоза най-накрая беше постигнато чрез диетично лечение с неварено царевично нишесте, което не може да се използва преди 6-8-месечна възраст поради незрялост на храносмилателните ензими. През следващите години храненето с богати на въглехидрати и протеини ястия, както и сурово царевично нишесте през нощта продължи.
Тази класическа диета стабилизира нивата на глюкозата в плазмата, но ехокардиографското проследяване показва прогресия на хипертрофия на лявата камера и преградата, както и обструкция на изходния тракт на лявата камера (LVTO) под медикаменти с верапамил. Дебелината на стената на интервентрикуларната преграда се увеличава до 1,4 cm, а градиентът на LVOT нараства до 20 mm Hg. ЕКГ (електрокардиография) разкрива признаци за бивентрикуларна хипертофия и анормална реполяризация с повишаване на ST-сегментите (0,5 mV). Момчето показа нарушена физическа способност с първоначални трудности при изкачване на стълби. Спортните дейности в училище бяха много ограничени; трудно можеше да измине разстояние от 100 метра без прекъсване. Постоянно повишените нива на CK в серума (до 5300 U/l) в продължение на няколко години показват значително мускулно участие.
С бързото развитие на кардиомиопатията опитахме богата на протеини диета с дневна доза протеин от 3 g/kg (19% от общия енергиен прием). Кардиомиопатията обаче продължава да напредва.
Пациент 2
Вторият пациент е момче от ирански произход, което е на 11 години в началото на MAD. В ранното детство се появяват повтарящи се епизоди на хипогликемия. Момчето показа изоставане в растежа и двигателното развитие. На 10-годишна възраст той беше насочен към нашата болница със сериозно засягане на мускулите. Не бяха възможни спортни дейности и момчето дори имаше трудности при изкачване по стълби поради мускулна слабост. Нещо повече, той се оплака от болки в гърдите след физически упражнения и повтарящо се гадене. Концентрацията на гликоген в червените кръвни клетки е повишена (23 mg/dl, нормален диапазон: 0–10 mg/dl), липсата на амилоглюкозидазна активност в червените кръвни клетки потвърждава диагнозата GSD III. Момчето беше хомозиготно за мутацията c.753_756del. Първоначалните сърдечни изследвания разкриха незначителна концентрична хипертрофична кардиомиопатия с удължено QTc-време.
Модифицирана диета на Аткинс
Пациентите са хоспитализирани за започване на модифицираната диета на Аткинс за 7–14 дни. Това позволи внимателно наблюдение както на пациентите, така и цялостно диетично обучение на пациентите и техните семейства. MAD се състои от ястия с ниско съдържание на въглехидрати с общо 10 g въглехидрати на ден. На семействата бяха дадени таблици за обмен за груба оценка на приема на хранителни вещества и беше предложена специална храна с ниско съдържание на въглехидрати. Пациентите бяха насърчавани да ядат храна, богата на мазнини и протеини като месо, риба, яйца, ядки ad libitum. Витамините и минералите бяха допълнени в съответствие с диетичните препоръки. В сравнение с класическата кетогенна диета MAD е по-лесен за прилагане в ежедневието, тъй като приемът на мазнини и протеини не трябва да се изчислява, което улеснява спазването. При кетогенната диета трябва да се спазва съотношение 4: 1 или 3: 1 на мазнини спрямо протеини и въглехидрати, което включва изчисляване на приема на мазнини, протеини и въглехидрати. Докато предлаганите в търговската мрежа кетогенни храни с формула могат да улеснят ежедневието на бебетата през първите няколко месеца от спазването на живота, е по-трудно при по-голямото дете.
Случайна асимптоматична хипогликемия се е появила през първите седмици след въвеждането на MAD, поради което трябва да продължи да се продължава суровото царевично нишесте. При пациент 1 сурово царевично нишесте през нощта може бавно да бъде намалено за период от 5 месеца и след това е прекратено, пациент 2 е получавал сурово царевично нишесте само за два месеца.
И двамата пациенти бяха проследявани в нашите амбулаторни клиники (пациент 1: 32 месеца, пациент 2: 26 месеца след началото на MAD) и бяха наблюдавани на всеки 3–6 месеца.
За оценка на метаболитния статус и спазването на терапията на всеки 3 до 6 месеца се записват следните параметри: кетонни тела в плазмата и урината, нива на СК в серума, чернодробна функция, ацилкарнитин профил, аминокиселини в плазмата, липиди и глюкоза в серума. Сърдечните изследвания чрез ехокардиография и електрокардиография се извършват на всеки 3–6 месеца. У дома родителите наблюдават кетонните тела в урината чрез тестване с пръчка.
Докато семейството на пациент 1 нямаше проблеми да се придържа към MAD, семейството на пациент 2 реши да спре MAD след 3 месеца и премина към традиционното готвене. Пациент 2 и семейството му не отговарят на изискванията поради езикови затруднения и липса на разбиране на заболяването. Имаше много (психо-) социални проблеми, тъй като семейството имаше статут на бежанец. През следващите месеци успяхме да убедим семейството да възобнови MAD.
Резултати
Диетичното лечение с MAD се понася добре, освен преходната хипогликемия. При пациент 1 приемът на въглехидрати е спаднал от 10 g/kg на ден до 0,4 g/kg на ден при MAD, приемът на протеин се е увеличил от 3 g/kg на ден до 7 g/kg на ден, докато приемът на мазнини се е увеличил от 1,6 g/kg на ден ден до 8 g/kg на ден. При пациент 2 приемът на въглехидрати при MAD е 0,5 g/kg на ден, прием на мазнини 6 g/kg на ден и прием на протеини 5 g/kg на ден. Не е направена диетична оценка при този пациент преди въвеждането на MAD. И при двамата пациенти диетичните препоръки съгласно DACH (германско-австрийско-швейцарска асоциация за хранене) са спазени, както се оценява от диетичните протоколи по време на MAD.
Пациент 1
Основните лабораторни и ехокардиографски параметри са обобщени в таблица 1. Плазмените концентрации на кетонни тела варират от 1,7 до 7,8 mmol/l. Активността на CK в кръвта пада значително под MAD. Сърдечната функция се подобрява според оценката на ехокардиографията и ЕКГ. Обструкцията на изходния тракт на лявата камера (LVOT) значително се подобри; градиентът намалява от 20 mm Hg преди започване на MAD до 5 mm Hg след 32 месеца MAD, дебелината на вентрикуларната преграда е намалена от 1,4 cm до 0,8 cm за същия период, докато дебелината на задната стена остава постоянна (Таблица 1). Това подобрение се отразява в нивата на NT-Pro BNP (N-терминален фрагмент за мозъчен натриуретичен пептид), които са били много високи и нормализирани при MAD. Преди MAD, ЕКГ разкрива бивентрикуларна хипертрофия и аномалии при реполяризация със ST-елевация от 0,5 mV. След 32 месеца MAD реполяризацията се нормализира, ST-елевацията изчезва, докато признаците за хипертрофия на лявата камера все още се наблюдават.
Пациентът е показал повишаване на издръжливостта и е в състояние да измине 500 метра без прекъсване. Нарастването и растежа на теглото са съизмерими с възрастта.
Освен преходна асимптоматична хипогликемия не са наблюдавани странични ефекти. Нивата на LDL-холестерол са в референтния диапазон, триглицеридите са леко повишени (Таблица 1).
Пациент 2
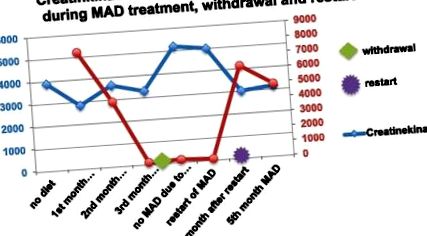
MAD води до повишени кетонни тела в плазмата с максимум 7,8 μmol/l. За период от два месеца е установено намаляване на нивото на CK от 3 895 на 2 846 U/l. Болката в гърдите след физическо натоварване и гаденето изчезнаха. Момчето придоби повече издръжливост. Впоследствие, при несъответствие с диетата и пълно отнемане на MAD, кетозата е загубена. Нивата на СК са се увеличили до 5192 U/l. Болката в гърдите след физическо натоварване се появи отново и се наблюдава намаляване на физическия капацитет. Не може да се извърши сърдечно проследяване поради несъответствие.
Когато MAD беше възобновена, кетозата бързо беше възстановена, нивата на CK спаднаха от 5192 U/l до 3000 U/l в рамките на 4 седмици (Фигура 1). Болката в гърдите и мускулната слабост изчезнаха.
Нива на СК- и кетон в тялото при пациент 2.
Хипертрофичната кардиомиопатия изчезна, ЕКГ се нормализира.
Не са наблюдавани сериозни странични ефекти в резултат на MAD, нивата на LDL-холестерол и триглицериди остават в норма (резултатите не са показани). Увеличаването на теглото и растежа са били подходящи за възрастта.
Дискусия
GSD III е класически лекуван с чести богати на въглехидрати ястия. Въпреки че тази терапевтична опция предотвратява хипогликемия, тя не подобрява мускулната [17] и сърдечната дисфункция [18], [19] включително аритмии [20].
Ние предположихме, че реактивният хиперинсулинизъм в резултат на високо хранене с въглехидрати е отговорен за изчерпването на енергийните субстрати (мастни киселини и кетонни тела) в скелетните и сърдечните мускули, последвано от мускулна дисфункция. Освен това, повишените нива на инсулин активират гликоген синтазата и насърчават съхранението на гликоген в миоцитите [15]. Това може да изостри финия енергиен дефицит, за който се говори, че играе патофизиологична роля при гликогенозите [21], [22].
Нашият терапевтичен подход, използващ MAD, доведе до клинично подобрение/стабилизиране на скелетните мускули и сърдечните прояви и при двамата ни пациенти. Нивата на CK в плазмата като обективен количествен параметър за мускулна дисфункция спадат под MAD. Количествени тестове за мускулна сила не са провеждани. Проведено е (неволно) кръстосано проучване при пациент 2.
Функцията на сърцето се подобрява, както се оценява от ехокардиография и ЕКГ при пациент 1. Pro BNP като маркер за нарушена сърдечна функция, впечатляващо подобрена при MAD. Подробни проучвания на сърдечната функция не са били извършвани при пациент 2, тъй като сърдечната функция не е била сериозно нарушена преди започване на MAD.
Най-вероятно основният патофизиологичен механизъм е превенцията на хиперинсулинизма и неговите последици. Дневната доза въглехидрати е била ниска и при двамата пациенти при 0,4-0,5 g/kg, което е достатъчно за потискане на секрецията на инсулин. Адекватното снабдяване с енергийни субстрати под MAD има положителен ефект върху мускулната функция. Освен това е известно, че кетозата активира митохондриалната сукцинат дехидрогеназа в сърцето, като по този начин подобрява енергийния баланс [23]. Намаляването на активността на гликоген синтазата с последователно намаляване на съхранявания гликоген може да бъде друг полезен фактор. Наблюдавахме преходна хипогликемия в началото на MAD, когато кетонните тела все още не бяха повишени. Потенциални странични ефекти на MAD като стомашно-чревни симптоми, умора и дислипидемия [24] не са наблюдавани при нашите пациенти. Засега не е ясно какво е необходимо по отношение на плазмените концентрации на кетон в тялото, за да се осигури адекватно енергийно снабдяване на сърдечните и скелетните мускули.
Не е ясно защо отговорът на MAD при пациент 2 е по-слабо изразен, както се оценява от нивата на СК. Отговорът може да зависи от специфичната мутация в основата на GSD IIIa, алтернативно спазването на диетата може да е било непълно между посещенията в нашите амбулаторни клиники.
Подобно стабилизиране и обръщане на свързана с GSD IIIa кардиомиопатия и миопатия на дихателните мускули се съобщава при пациенти на високо протеинова диета [10] - [12], което също се предлага в скорошно ръководство [14]. Предполагаме, че основният механизъм на това наблюдение може да бъде и предотвратяването на реактивен хиперинсулинизъм. Valayannopoulos et al. съобщава за случай с подобрение на кардиомиопатията при високо протеинова диета, комбинирана с приложение на D, L-3-хидроксибутират. Доставката на екзогенни кетонни тела е нефизиологична и изисква съответствие с пациента. Придържането към кетогенна диета е по-взискателно от спазването на MAD. По този начин MAD може да бъде по-ефективен и удобен за ежедневието на пациента.
Заключение
В обобщение, докладваме 2 момчета с GSD IIIa, които са се възползвали от MAD. Нивата на CK спаднаха, сърдечната функция се подобри и толерантността към упражненията се увеличи. Освен преходна асимптоматична хипогликемия при започване на MAD не са наблюдавани сериозни неблагоприятни ефекти.
Съгласие
Писмено информирано съгласие е получено от родителите на пациент 1 и майката на пациент 2 за публикуването на този доклад.
- Липиден профил на деца със заболяване за съхранение на гликоген
- ЖУРНАЛ ЗА ДЪЛГИЯ ОСТРОВ; Диета на Аткинс през пътеките или етера - The New York Times
- Човек получава рядко кожно заболяване от диета с нула въглехидрати Здраве - Gulf News
- Здравословните храни са по-важни от вида диета за намаляване на риска от сърдечни заболявания Изследователите сравняват
- Заболяване за съхранение на гликоген (GSD); Симптоми, причини, лечение