Хиперадренокортицизмът причинява загуба на мускулна маса (атрофия) и слабост при кучета и коне с болест на Кушинг и след прилагане на кортикостероиди (Braund et al., 1980a, 1980b;
Свързани термини:
- Новообразувание
- Захарен диабет
- Хипофиза
- Адренокортикотропен хормон
- Хидрокортизон
- Затлъстяване
- Кортикотропин
- Алкална фосфатаза
Изтеглете като PDF
За тази страница
Системни или мултифокални знаци
Майкъл Д. Лоренц BS, DVM, DACVIM,. Марк Кент DVM, BA, DACVIM, в Наръчник по ветеринарна неврология (Пето издание), 2011
Хиперадренокортицизъм
Хиперадренокортицизъм (болест/синдром на Кушинг) се среща при кучета, коне и котки. При кучета и коне аденомите на хипофизата, които хиперсекретен адренокортикотропен хормон (ACTH) са най-честата причина, но функционалните кортизол-секретиращи надбъбречни тумори също произвеждат този синдром при кучета и котки. Клиничните признаци са причинени от метаболитните ефекти на хиперкортизолемията. Генерализираната мускулна слабост в резултат на катаболните ефекти на глюкокортикоидите е често срещана находка. Някои кучета развиват мускулна дегенерация, известна като индуцирана от стероиди миопатия (вж. Глави 7 и 10, глава 7, глава 10). Това състояние води до спонтанни мускулни контракции (псевдомиотония) и скована походка.
Хипофизните аденоми (макроаденоми) могат да създадат неврологични признаци чрез растеж и разширяване в хипоталамуса (вижте Фигура 15-5, А до С). 56 Признаците на макроаденомите на хипофизата обикновено са неясни и включват депресия, объркване, кръгообразуване, атаксия и гърчове. 57 Макроаденомите са по-чести при по-възрастни кучета от големи породи. Хипофизни тумори, причиняващи хиперадренокортицизъм, могат да присъстват, без да причиняват неврологични признаци. 57
Ендокринна система
Хиперадренокортицизъм (синдром или болест на Кушинг)
Хиперадренокортицизмът е относително често срещан при по-възрастните кучета, все по-разпознат при котките и рядък при други домашни животни. Ятрогенният хиперадренокортицизъм е резултат от терапията с глюкокортикоиди, която води до намалена секреция на ACTH и адренокортикална атрофия. Спонтанният синдром на Кушинг, за разлика от него, обикновено е резултат от секреция на ACTH от хиперпластични или неопластични аденохипофизарни (предни части на хипофизната жлеза) кортикотрофи, което причинява двустранна, дифузна или мултифокална адренокортикална хиперплазия, особено в zona fasciculata (вж. Фигури 12-17, A и С, и 12-35). Функционалните адренокортикални аденоми или карциноми (вж. Фиг. 12-37) са по-рядка причина за синдрома на кучешкия кушинг. Базовата плазмена концентрация на кортизол се сравнява с тази след супресия на дексаметазон и ACTH стимулация, за да се определи патогенезата на хиперадренокортицизъм.
Повишената глюконеогенеза, липогенезата и белтъчният катаболизъм обясняват много от клиничните признаци и лезии. Атрофията на скелетните мускули води до висящ корем (виж фиг. 12-36). Хепатомегалията се причинява от увеличени отлагания на липиди и гликоген (стероидна хепатопатия; вж. Фиг. 8-78). Кожните лезии се развиват първоначално над местата на износване (напр. Врата, хълбоците или зад ушите) или костните изпъкналости и след това се разпространяват в двустранно симетричен модел, за да обхванат по-голямата част от телесната повърхност (вж. Фиг. 12-36, 17-74, и 17-75). Кожните лезии на хиперкортизолизъм включват атрофия на епидермиса и пилозабековите единици със загуба на дермален колаген и еластин. При калциноза cutis, характерна лезия при до 30% от кучетата с хиперадренокортицизъм, калциевите кристали се отлагат по дермалните колагенови и еластинови влакна и могат да проникнат в атрофичния епидермис или фоликуларния епител. Това кожно калциране вероятно е свързано с гликонеогенното и протеиново катаболно действие на кортизола, което води до молекулярно пренареждане на колаген и еластин с образуване на матрица, която привлича калций. Калцият може да се отложи и в други тъкани, като белите дробове, скелетните мускули и стомаха.
Функция на скелетните мускули
1 Кортикостероидна миопатия
Хиперадренокортицизмът причинява загуба на мускулна маса (атрофия) и слабост при кучета и коне с болест на Кушинг и след прилагане на кортикостероиди (Braund et al., 1980a, 1980b; Duncan et al., 1977); (Aleman et al., 2006). Изхабяването на мускулите се дължи на доста селективна ангулоидна до ъглова атрофия на миофибри от тип 2; количествените изследвания обаче разкриват и атрофия на влакна от тип 1. Миотонията е променлив съпътстващ признак на това разстройство (Duncan et al., 1977). Изхабяването на мускулите изглежда се дължи на катаболизъм с намален протеинов синтез и повишено разграждане на протеини, медиирано от променена транскрипция в метаболизма на протеините.
Глюкокортикоиди и застаряващият мозък: причина или последица?
Пол Дж. Лукасен, Е. Рон Де Клоет, във Функционална невробиология на стареенето, 2001
1. Функционални промени
Предишни проучвания вече разкриха, че GC действат чрез GR-медииран механизъм, за да увеличат зависимия от напрежението приток на калций в хипокампалните неврони. Хиперкортицизмът предизвиква продължителна и повишена зависимост от калций след хиперполяризации, намалени прагове за предизвикване на възбуждащи постсинаптични потенциали (EPSP), намалени амплитуди на EPSP и общо повишени калциеви токове, всички условия знаят, че пречат на правилното синаптично предаване. Значението на променената регулация на калция в стареенето се подкрепя и от промени, наблюдавани при възрастни животни и свързани с невронална дегенерация, във фактори, участващи в вътреклетъчното калциево буфериране, като калбиндин, калретинин, калмодулин и др. Освен това е установено, че пространственото обучение е свързано към промени в калциево-зависимите протеинкинази (Fordyce и Wehner, 1993a, b; Colombo et al., 1997; Krugers et al., 1997b). По-нататък се оказа, че фармакологичната манипулация на вътреклетъчния калций е ефективна при въздействие върху аспектите на познанието в остарелия мозък (Landfield et al., 1978, 1981; Joëls and de Kloet, 1989; Kerr et al., 1991; Nair et al., 1998; Вехрацки и Тоеску, 1998).
Глюкокортикоидите също влияят на дългосрочното потенциране (LTP), електрофизиологичен модел за формиране на паметта. Интересното е, че това изглежда също следва U-образна връзка доза-отговор, тъй като при хипокампалните резени реакцията на дългосрочно потенциране се нарушава само когато концентрациите на GC са или твърде високи, или твърде ниски (Joëls and De Kloet, 1992; De Kloet et ал., 1999). Невъзможността за генериране на LTP в хипокампуса на възрастни плъхове се дължи на отклонена, висока експозиция на GC при тези животни (Kerr et al., 1991). Подобна връзка доза-реакция на GC съществува за зависими от напрежението йонни проводимости като калциева и серотонинова la-рецепторна медиирана хиперполяризация (Joëls and De Kloet, 1992; Joëls, 1997; De Kloet et al., 1998).
Репродуктивна и ендокринна токсикология
11.13.5.2 Условия на адренокортикалната хиперактивност
Хиперадренокортицизмът, често наричан синдром на Кушинг, е най-често срещаното състояние на адренокортикалния излишък. Това състояние може да бъде независимо от хипофизата, когато надбъбречната жлеза самостоятелно произвежда излишък от глюкокортикоиди или може да зависи от хипофизата, когато хипофизата произвежда излишък от ACTH. Типичните симптоми на „Cushingoid“ на излишъка от глюкокортикоиди включват централно затлъстяване или наддаване на тегло, хипертония, тънка кожа, лошо заздравяване на рани, дислипидемия, остеопения и мускулна слабост (за прегледи вижте Holt and Hanley 2008; Newell-Price et al. 2006). Примерите за фармакотоксикологично индуцирани състояния включват синдром на „псевдо-Кушинг“ от прекомерна консумация на алкохол, което може да доведе до хиперсекреция на кортизол при хора (вж. Holt и Hanley 2008), и както беше споменато по-горе, синдромът на ятрогенния Кушинг е често срещан страничен ефект на дългосрочния глюкокортикоид терапия. Holt и Hanley (2008) обсъждат и други състояния на адренокортикален излишък, включително хипералдостеронизъм (синдром на Conn) и вродена надбъбречна хиперплазия, причинена от инактивиране на CYP21 (което главно причинява излишък на адренокортикална андрогенна продукция, но може да доведе и до глюкокортикоидна недостатъчност при така наречените вирилизиране и сол -пропиляване на форми).
Една точка от общ интерес е, че сега се разработват различни фармакологични съединения, насочени към адренокортикалните ензими, по-специално CYP17 и CYP11B (Hakki и Bernhardt 2006), за да се осигури терапия за определени синдроми на хиперактивност. Това също демонстрира нарастващата значимост на надбъбречната жлеза във фармакологията и токсикологията и че съединенията могат да бъдат синтезирани по специфичен начин, за да повлияят на стероидогенните процеси и следователно се установяват взаимоотношения структура-активност. Литературният анализ на Harvey et al. (2007, 2008) изброява над 70 съединения, за които се съобщава, че влияят на стероидогенезата и молекулните цели, върху които те влияят, и те включват широк спектър от замърсители на околната среда, селскостопански химикали, потребителски химикали (напр. Алкохол) и фармацевтични продукти. Това повдига въпроса дали ниските експозиции на околната среда биха могли да предразположат определени сектори от човешката популация да развият надбъбречни заболявания и това е обсъдено допълнително в следващия раздел.
Адренокортикална функция
Рутинна лабораторна диагностика
Както при хипоадренокортицизма, така и при хиперадренокортицизма има редица необичайни лабораторни находки, които са по-чести, отколкото при други заболявания. Много от тези аномалии могат да бъдат получени от описаното по-горе действие на глюкокортикоидите и минералокортикоидите (раздел II.F). Основното е обобщено тук.
При първичен хипоадренокортицизъм намаленото производство на алдостерон води до хипонатриемия и хиперкалиемия. Свързаната хиповолемия води до уремия в надбъбречната жлеза. При хиперадренокортицизъм класическата хематологична аномалия е еозинопенията, която може да бъде свързана с лимфопения и понякога с левкоцитоза и еритроцитоза. Често срещана биохимична аномалия е повишената плазмена концентрация на алкална фосфатаза (Eckersall и Nash, 1983), която може да възникне заедно с леко повишаване на аланин аминотрансферазата (ALT). Освен това могат да се наблюдават хипергликемия, хиперлипидемия и ниски концентрации на тироксин. Специфичното за урината тегло обикновено е ниско и в 5% до 10% от случаите се открива глюкозурия.
От тези аномалии повишената концентрация на алкална фосфатаза (AP) е най-честата лабораторна аномалия при кучета с кортикостероиден излишък (екзогенен или ендогенен). Това увеличение се дължи на индуцирането на специфичен изоензим, който има по-голяма стабилност при топлина при 65 ° C от другите AP-изоензими (Teske et al., 1986) и следователно лесно се измерва чрез рутинна лабораторна процедура. Ненормално повишената стойност на AP-65 ° C може да сочи към хиперадренокортицизъм, но е неподходяща като диагностичен тест поради ниската си специфичност (Teske et al., 1989). Ниските концентрации на тироксин (Т4) в плазмата, които могат да се наблюдават при хиперадренокортицизъм, изглежда са следствие от променен транспорт, разпределение и метаболизъм на Т4, а не резултат от хипосекреция (Rijnberk, 1996).
Възможно е обаче да има и други състояния, причиняващи тези аномалии, а някои случаи не са с типични рутинни лабораторни характеристики. Следователно подробното разбиране на специфичните лабораторни тестове, които обикновено се използват за изследване на надбъбречната функция, е от съществено значение. В допълнение, спонтанните форми на хиперадренокортицизъм могат да възникнат от свръхпроизводството на ACTH на хипофизата или от автономно хиперсекретиращи адренокортикални тумори. Всеки от тях изисква различен режим на лечение и следователно погледът върху тестовете, използвани при диференциалната диагноза, е от първостепенно значение.
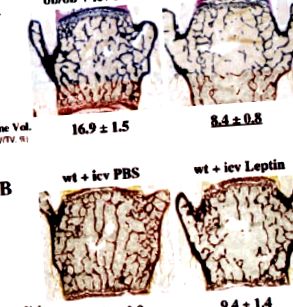
Централният контрол на ремоделирането на костите
Б. Дефицит на лептин и кост при мишки
Патологични биомаркери в токсикологията
Мелитън Н. Новила,. Стюарт Б. Якобсън, в Биомаркери в токсикологията, 2014
Ендокринна алопеция
Ендокринната алопеция може да възникне от ятрогенен хиперадренокортицизъм или хиперестрогенизъм при кучета, съответно от прилагане на глюкокортикоиди или естрогени. Други съобщени причини са двустранна адренокортикална хиперплазия, вторична за тумора на хипофизата, функционален адренокортикален хиперпластичен възел или неоплазма за хиперадренокортицизъм и за хиперестрогенизъм, кисти на яйчниците при жени и функционален тумор на Сертоли на тестисите при мъже (Hargis и Ginn, 2006). Кучетата с хиперадренокортицизъм имат алопеция на труна, щадяща главата и крайниците, разтегнат корем и тънка кожа.
При хипестрогенизъм грубите находки включват симетрична алопеция и хиперпигментация над задния багажник и крайниците (Фигура 54.2). В допълнение, мъжките кучета могат да развият висяща препуция, уголемяване на зърната и простатата, докато женските кучета имат увеличена вулва и необичаен цикъл на еструс. Хистологично епидермисът, дермата и космените фоликули са атрофични с фоликуларна хиперкератоза и калциноза кутис при хиперадренокортицизъм, докато епидермална и фоликуларна хиперкератоза и фоликуларна атрофия се наблюдават при хиперестрогения. Историята на ятрогенно излагане на глюкокортикоиди или естроген заедно с клинични и морфологични находки подкрепя диагностицирането на ендокринна алопеция.
Фигура 54.2. Хиперестрогенизъм, ятрогенен диетилстилбестрол, куче.
(Възпроизведено от Патологична основа на ветеринарната болест, 4-то издание, фиг. 17-69, стр. 1223. Academic Press/Elsevier).
- Бариатрична хирургия - общ преглед на ScienceDirect теми
- Цвекло - общ преглед на ScienceDirect теми
- Антихелминт - общ преглед на ScienceDirect теми
- Anorexia Nervosa - общ преглед на ScienceDirect теми
- Анална фистула - общ преглед на ScienceDirect теми