Каликреините са серинови естерази с широк спектър от биологични функции, включително регулиране на възпалението, апоптоза, редокс баланс и фиброза в бъбреците.
Свързани термини:
- Пептид
- Протеаза
- Тромбин
- Брадикинин
- Фактор XII
- Фосфопротеин
- Кинин
- Прекаликреин
- Вложен ген
- Мутация
Изтеглете като PDF
За тази страница
Молекулярна клетъчна биология
R.A. Bradshaw, R. L. Lundblad, в Encyclopedia of Cell Biology, 2016
Свързани с каликреин пептидази
Семейството KLK се състои от 15 протеина (Harvey et al., 2000; Lundwall et al., 2006; Таблица 1). Повечето от тях имат активност, несвързана с класическото определение на KLK като кининогеназа (Kraut et al., 1930). Свързаните с KLK пептидази функционират като секреторни фактори в извънклетъчното пространство, където имат разнообразни функции, включително обработка на растежни фактори, разцепване на протеини на извънклетъчния матрикс и активиране на други протеази. Те също участват в туморогенезата (Dong et al., 2014).
KLK2 и KLK3 (PSA) са изключителни продукти на простатата и са били използвани за скрининг на рак на простатата (Lövgren et al., 1995; Voigt et al., 2014). Доказано е, че свързаната с KLK пептидаза 2 (KLK2, hK2) има кининогеназна активност (Deperthes et al., 1997; Charlesworth et al., 1999), докато PSA има малка (Andrade et al., 2010) или никаква кининогеназна активност (Deperthes и др., 1997). Както KLK2, така и PSA се считат за първични секреторни продукти на простатата и, както при другите KLK-свързани пептидази, те имат продукти, получени чрез алтернативно сплайсинг (David et al., 2002).
Свързани с KLK пептидази, които включват тъканни каликреин (Таблица 1), са показани, че присъстват в голям брой тъкани и течности чрез анализ на иРНК и силно чувствителни имуноанализи (Shaw and Diamandis, 2007). Наличието на KLK-свързани пептидази 5, 6, 7, 10, 11, 12, 13 и 14 в цитоплазмата на жлезистите епителни клетки и в клетъчния секрет е установено с имунохистоцитохимия (Petraki et al., 2006).
Има няколко забележителни основи на KLK. Протеолизата на инсулиноподобен свързващ протеин на растежен фактор (IGF-BP) от няколко членове на семейство KLK (Фигура 1) води до увеличаване на несвързания свързан с инсулина растежен фактор 1 (IGF-1) в интерстициалното пространство; е известно, че повишеният IGF-1 подобрява туморния растеж (Hekim et al., 2010). Предполага се, че различни други протеини служат като субстрати за няколко KLK-подобни пептидази (Borgono et al., 2007; Debela et al., 2008; Sotiropoulou and Pampalakis, 2010).
Връзката между различни KLK и други протеази предполага, че съществуват функционални каскади (Фигура 1), каквито се наблюдават при протеази на комплемента и коагулацията и че това са важни регулаторни процеси (Blaber et al., 2010). Тези процеси включват не само активиране на зимоген, но и взаимодействия с различни клетки, медиирани от протеазно активирани рецептори (PARs). Тези предполагаеми каскади включват поетапно взаимодействие на протеази, където зимогенната форма на един ензим се превръща в активирана форма чрез ограничена протеолиза. Веднъж активирана, тази протеаза може да активира следващия зимоген. За разлика от коагулационните каскади, където има усилване на сигнала за иницииране, предполага се, че каликреиновите каскади имат регулаторен характер и вероятно осигуряват времеви контрол на събития като ремоделиране на тъкани.
Каликреин
Марти К.С. Wong, в Handbook of Hormones, 2016
Резюме
При бозайниците са известни два основни каликреина. Плазменият каликреин (KLKB1) притежава уникална структура от четири ябълкови домена и трипсинов домен. Тъканният (жлезист) каликреин (KLK) притежава само трипсинов домен. KLKB1 се свързва с кининоген с високо молекулно тегло (KNG) с висок афинитет и за предпочитане освобождава брадикинин (BK). KLKB1 също усвоява плазминогена до плазмин и участва в повърхностно зависимо активиране на кръвосъсирването, фибринолизата и възпалението. Каликреин превръща проренин в ренин, за да активира ренин-ангиотензиновата система. Не е открит KLKB1 при телеости, но е открит подобен на KLKB1 лектин, който може да участва в имунната функция. KLK е силно селективен за освобождаване на [Lys0] -BK както от KNG с високо, така и от ниско молекулно тегло. В допълнение, KLK участва в протеолитични каскади за втечняване на спермата чрез хидролиза на семиногелин и десквамация на кожата чрез разцепване на клетъчни адхезионни протеини. Високата експресия на KLK3 е маркер за рак на простатата.
Свързана с каликреин пептидаза 5
Отличителни черти
Проформата KLK5 притежава 37 остатъчен пропептид, който е най-дългият от всички KLK и може да даде възможност за добре документираното автоматично активиране на KLK5 [9]. Сред свързаните с каликреин пептидази най-тясно свързани са KLK4, KLK14 и KLK6, последвани от всички други известни KLK и трипсин [32]. Аминокиселинната идентичност на зрели KLK5 с други KLK протеази варира между 40% (KLK10) и 52% (KLK4), трипсинът споделя 47% идентични аминокиселини с KLK5 [59]. Наличните в търговската мрежа антитела срещу KLK5 включват моноклонални от мишка (R&D Systems, Abnova) и поликлонални от мишка, коза или заек (R&D System, Abnova, LifeSpan BioSciences, Sigma-Aldrich).
Човешки каликреин 1, тъкан каликреин
Име и история
Каликреин е открит като вещество в човешката урина, проявяващо хипотензивни свойства [1,2]. Подобно вещество е открито в панкреаса и му е дадено името каликреин (гр. Kallikreas, панкреас) [3]. Този ензим е наречен също жлезист каликреин, истински тъкан каликреин, каликреин на панкреаса, каликреин в бъбреците и каликреин в урината. Символът на гена на каликреин в човешката тъкан е KLK1 [4]. Други гени на каликреин на човешката тъкан включват KLK2 (човешки жлезист каликреин-1) и KLK3 (специфичен за простатата антиген или семеногелаза). Изграждането на по-подробна геномна карта на човешкия тъкан каликреин локус показа, че 15 гена имат значителни структурни прилики [5,6] .
Свързана с каликреин пептидаза 7
Кристофър Дж. Фаради,. Фабрис А. Колб, в Наръчник на протеолитичните ензими (трето издание), 2013
Име и история
Свързана с каликреин пептидаза 7 (KLK7) първоначално е изолиран от тъкан на роговия слой като серинова протеаза с активност, подобна на химотрипсин, която участва в регулираната десквамация на крайно диференцирани кератиноцити [1,2]. Първоначално име рогови слой химотриптичен ензим (SCCE), местоположението на човешкия ген в локуса 19q13.3-13.4 върху човешката хромозома 19 сред купчина гени на каликреин и високата степен на хомология на последователността с други гени от семейството на каликреин, доведоха до преименуването на гена. KLK7 се изразява предимно в кожата, но се открива и при относително високи нива в хранопровода, сърцето, черния дроб, централната нервна система, бъбреците, панкреаса, млечните и слюнчените жлези [3,4]. Голяма част от сегашното разбиране за биологичните роли на KLK7 идва от изследвания върху епидермалната хомеостаза при хора и мишки, където KLK7 е част от каликада, подобна на каликреин, пептидаза, отговорна за поддържане целостта на кожната бариера.
Свързана с каликреин пептидаза 13
Даниела Крету, Елефтериос П. Диамандис, в Наръчник на протеолитичните ензими (трето издание), 2013 г.
Име и история
Човешките каликреини са подгрупа от семейството на сериновите протеазни ензими (S1A), за които до 1999 г. се смята, че включват само трите класически каликреина: KLK1 (панкреатичен/бъбречен каликреин), KLK2 (човешки жлезист каликреин) и KLK3 (простата специфичен антиген). Генът, кодиращ човешка каликреин-свързана пептидаза 13 (KLK13), известна преди като каликреин-подобен ген 4 (KLK-L4) [1], се определя като каликреин-подобен ген въз основа на структурна хомология, както и хромозомна локализация и първоначално е изолиран, използвайки позиционния кандидат генен подход [2]. Приета е рационална номенклатура за членовете на разширеното семейство каликреин, при което генът е изобразен като KLK13, а съответният протеин като KLK13, както се препоръчва от Комитета за генна номенклатура HUGO (HGNC) [3] .
Хиалуронан в дихателните пътища
РОЗАННА ФОРТЕЗА,. ГРЕГОРИ Е. КОНЪР, по химия и биология на хиалуронан, 2004 г.
IV. Тъкани каликреин и хиалуронан: взаимодействие и инхибиране на ензимите
Фактът, че хиалуронанът се свързва с ТЗ, инхибира неговата ензимна активност, предполага специфично взаимодействие между тези две молекули. Въпреки че няма конкретни аминокиселинни последователности, показани категорично да свързват "мотиви" за хиалуронан като цяло, много хиалуронан-свързващи протеини съдържат "модули за връзка", които са домейни на приблизително 100 аминокиселини с четири цистеинови дисулфидни връзки и други силно запазени остатъци (36). TK обаче не съдържа такъв модул за връзка. От друга страна, нараства броят на хиалуронан-свързващите протеини, които не са свързани помежду си и нямат свързващ модул. Всъщност кристалната структура на ТК (37) разкрива повърхностни клъстери на основни аминокиселини в близост до каталитичното място. Тези аминокиселини са добри кандидати за свързване с хиалуронан. В момента проучваме дали тези аминокиселини всъщност са отговорни за специфичното взаимодействие между ТЗ и хиалуронан.
Пептидомика на ензимни продукти, получени от рак
Джия Фен,. Тони Й. Ху, в The Enzymes, 2017
1.2.3 Каликреини
Хормони на бъбреците
Антъни У. Норман, Джералд Литвак, в Хормони, 1987
IV КАЛИКРЕЙНИ И КИНИНИ
Въведение
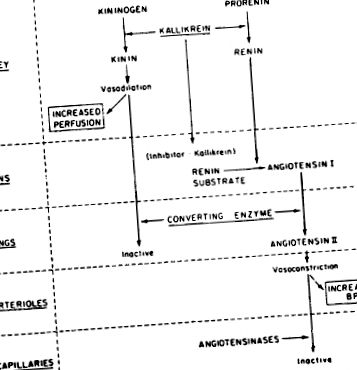
Каликреините са група серинови протеази, които действат върху плазмените α 2-глобулини, известни като кининогени, за да освободят кинини като брадикинин. Брадикининът е най-мощното известно съдоразширяващо вещество. Има все повече доказателства за интегрирано взаимодействие на каликреин-кининовата система и простагландина със системата ренин-ангиотензин, за да окаже влияние върху системното артериално налягане и бъбречния кръвоток. Фигура 15-14 обобщава възможните взаимовръзки между системата каликреин-ренин.
Фигура 15-14. Предложени взаимодействия каликреин-ренин за поддържане на системно артериално налягане и бъбречен кръвоток.
Б Биохимия и физиология
Идентифицирани са два класа каликреини: (1) тези, които присъстват в органите, предимно в бъбреците, но също така и в слюнчената жлеза и панкреаса, и (2) тези, които се намират в плазмата. Плазмените каликреини имат молекулно тегло 107 000, докато жлезистите каликреини са по-малки, с молекулно тегло 27 000–43 000. Всички каликреини са серинови протеази. Плазменият каликреин обикновено се намира като проензим, наречен прекаликреин. Prekallikrein се активира до каликреин от един от факторите на кръвосъсирването, фактор XII или фактор Hageman. На свой ред, фактор Hageman се активира от плазмения каликреин. Бъбречният каликреин е локализиран чрез имунохистохимични техники, за да присъства в дисталната извита тубула. Тук се смята, че играе роля за увеличаване на бъбречния кръвен поток и евентуално за посредничество при превръщането на проренин в ренин.
Каликреините използват протеазната си активност, за да освободят пептидни кинини от техните предшественици субстратни форми. Има два класа каликреинов субстрат: (1) тези с високо молекулно тегло, присъстващи в плазмата и които освобождават неапептида брадикинин, и (2) тези с ниско молекулно тегло, присъстващи в тъканите, които освобождават декапептида калидин. Калидин или лизил-брадикинин има допълнителен лизин в аминокрая на брадикинин.
Има поне три взаимовръзки между системата каликреин-кинин, системата ренин-ангиотензин-алдостерон и бъбречните простагландини: (1) ензимът каликреин изглежда участва в превръщането на проренин в ренин; (2) ензимната активност на кининаза II и ангиотензин I-конвертиращият ензим са свойства на един и същ протеин; и (3) производството (и бъбречната екскреция) на простагландини се увеличава чрез производството на бъбречни кинини, докато каликреин намалява производството на простагландини.
Всички кинини имат много сходни биологични действия; те са мощни стимулатори на бъбречния кръвоток, медиират хипотонията и увеличават потока на урината и екскрецията на натрий. Доказано е, че брадикининът стимулира синтеза на простагландин PGA2, вероятно чрез превръщане на неактивна фосфолипаза в активна фосфолипаза, която освобождава арахидоновата киселина, необходима за синтеза на простагландини от мембранните фосфолипиди.
Каликреинът на човешката тъкан и свързаното с каликреин семейство пептидази
Име и история
Фигура 606.1. Местоположение на KLK локуса в хромозома 19q13.4. Схематично представяне на интервала между D19S425 и D193418. Локусът на KLK се намира близо до D19S418. Позицията на 15 гена, кодиращи каликреин, върху локуса KLK са маркирани. KLK1, KLK15, KLKP1 до KLK14 се транскрибират теломери в центромери, докато KLK2 и KLK3 се транскрибират в обратна посока.
Номенклатурата за това семейство също се е развила с течение на времето; настоящите символи и други обозначения или съкращения, често използвани, са описани в таблица 606.1 [14]. Освен това, KLK1 или тъканният каликреин е доста различен от плазмения каликреин (KLKB1, глава 638) по последователност и структура, въпреки че те имат подобна субстратна специфичност. Тази глава описва конкретно общите атрибути на човешкото семейство KLK на серинови пептидази, както и конкретно споменаване на KLK9 и KLK12. Атрибутите на другите KLK ензими (KLK1-8, KLK10, KLK11 и KLK13–15) са описани в отделни глави тук (Глави 607–614 Глава 607 Глава 608 Глава 609 Глава 610 Глава 611 Глава 612 Глава 613 Глава 614).
Таблица 606.1. Символ и обозначения на човешки каликреинови гени
- Левотироксин - общ преглед на ScienceDirect теми
- Липстатин - общ преглед на ScienceDirect теми
- Липолиза - общ преглед на ScienceDirect теми
- Indole-3-Carbinol - общ преглед на ScienceDirect теми
- Кефир - общ преглед на ScienceDirect теми