1 Катедра по биомедицински науки, Университет в Падуа, Via Marzolo 3, 35031 Падуа, Италия
2 Изследователски отдел за спорт и упражнения, Университет в Палермо, Via Eleonora Duse 2, 90146 Палермо, Италия
Резюме
Все повече данни показват ползата от кетогенните диети при различни метаболитни заболявания като затлъстяване, метаболитен синдром и диабет. По отношение на неврологичните разстройства, кетогенната диета е призната за ефективно лечение на фармакорезистентна епилепсия, но новопоявяващите се данни показват, че кетогенната диета може да бъде полезна и при амиотрофна странична склероза, Алцхаймер, болестта на Паркинсон и някои митохондриопатии. Въпреки че тези заболявания имат различна патогенеза и характеристики, има някои общи механизми, които биха могли да обяснят ефектите от кетогенните диети. Тези механизми трябва да осигурят ефективен източник на енергия за лечение на някои видове невродегенеративни заболявания, характеризиращи се с фокален мозъчен хипометаболизъм; за намаляване на окислителните щети, свързани с различни видове метаболитен стрес; за увеличаване на пътищата на митохондриалната биогенеза; и да се възползват от способността на кетоните да заобикалят дефекта в комплекс I активност, замесен в някои неврологични заболявания. Тези механизми ще бъдат обсъдени в този преглед.
1. Въведение
Известно е, че единичните хранителни вещества могат да окажат положително въздействие върху здравето на скелетните мускули и освен това комбинация от хранителни вещества може да отслаби признаците и симптомите на някои нервно-мускулни заболявания. От друга страна също е известно, че ефектите от диетата върху здравето са свързани с общото съотношение на различните макро- и микроелементи, а не с всеки отделен компонент. От тази гледна точка през последните години се предизвика голям интерес към кетогенната диета (KD).
От третото десетилетие на XX век KD се използва за лечение на пациенти с фармакологична резистентност към епилепсия [1–3]. В по-нови периоди се твърди, че KD е полезен и при други напълно различни заболявания като затлъстяване [4], СПКЯ [5], рак [1, 6, 7], диабет [8] или други патологични състояния [9– 11]. Въпреки че много проучвания посочват потенциално положителните ефекти на KD върху много неврологични и нервно-мускулни заболявания, само малко изследвания са изследвали механизмите на този обещаващ хранителен подход [12]. Целта на нашия преглед е да се обсъди ролята на KD при избрани заболявания, които засягат нервната система с последици за мускулната функция.
2. Вътре в кетогенната диета
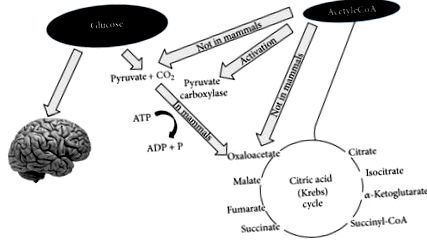
След няколко дни на гладно или драстично намаляване на въглехидратите от диетата (под 20 g на ден), глюкозните резерви стават недостатъчни както (1) за нормално окисляване на мазнините чрез доставката на оксалоацетат в цикъла на Кребс, така и (2) за доставка на глюкоза към ЦНС (централна нервна система) [13, 14] (Фигура 1).
По отношение на точка (1) оксалоацетатът е относително нестабилен при телесна температура и не може да се натрупва в митохондриалната матрица; по този начин, в това състояние на „лишаване от глюкоза“ е необходимо да се достави оксалоацетат за ефективно функциониране на цикъла на трикарбоксилната киселина. Оксалоацетатът се доставя чрез анаплеротичния цикъл, който го синтезира от глюкоза чрез АТФ зависимо карбоксилиране на пировиноградна киселина от пируват карбоксилаза [15].
По отношение на точка (2), тъй като ЦНС не може да използва мастни киселини (FFA) като енергиен източник (FFA не може да премине кръвно-мозъчната бариера), тя обикновено използва глюкоза. След 3-4 дни без никакъв прием на въглехидрати, ЦНС трябва да намери алтернативни източници на енергия, както е показано от класическите експерименти на Felig et al. [13, 14, 16, 17]. Този алтернативен източник на енергия са кетонните тела (KBs): ацетоацетат (AcAc), 3-хидроксибутират (3HB) и ацетон [18], получени от свръхпроизводството на ацетил-CoA без съпътстващо производство на достатъчно количество оксалоцетна киселина. Този процес се нарича кетогенеза и основно се случва в митохондриалната матрица в черния дроб [19]. Важно е да се подчертае, че черният дроб произвежда KB, но също така не може да ги използва поради липсата на ензима сукцинил-CoA: 3-CoA трансфераза (SCOT), необходим за превръщане на ацетоацетат в ацетоацетил-CoA [18].
Основното кетонно тяло, произведено в черния дроб, е ацетоацетат, но основният циркулиращ кетон е 3-хидроксибутират. При нормални условия производството на свободна ацетооцетна киселина е незначително и може да се метаболизира от различни тъкани като скелетни мускули и сърце. В условията на свръхпроизводство на ацетооцетна киселина това се натрупва над нормалните нива и част се превръща в другите две кетонни тела. Високото ниво на KBs в кръвта и тяхното елиминиране чрез урина причиняват кетонемия и кетонурия. При нормални условия концентрацията на KBs обикновено е много ниска (Фигура 2
Друг момент, който трябва да се подчертае, е, както е показано в таблица 1, че гликемията, макар и намалена, остава в рамките на физиологичните нива [26, 27], поради основните два източника: (1) глюкогенни аминокиселини и (2) глицерол, освободен чрез лизис от триглицериди [28, 29]. По време на физиологична кетоза (бърза или много нискокалорична KD) кетонемията достига максимални нива от 7/8 mmol/L без промени в рН, докато при неконтролирана диабетна кетоацидоза това може да надвишава 20 mmol/L при едновременно понижаване на рН на кръвта [16, 30 ] (Маса 1). Нивата на KB в кръвта при здрави хора не надвишават 8 mmol/L, тъй като централната нервна система (ЦНС) ефективно използва тези молекули като енергийно снабдяване вместо глюкоза [16].
8 mmol/L KBs) кетоза на глад или KD от „патологичната кетоацидоза“ на метаболитно дисбалансиран диабет [31].
4. Кетогенна диета и амиотрофична странична склероза
Амиотрофичната латерална склероза (ALS) е прогресиращо невродегенеративно разстройство, което засяга гръбначните и кортикалните двигателни неврони, което води до прогресивна слабост и загуба на скелетни мускули. Засегнатите субекти умират в рамките на 2 до 5 години от появата на симптомите. Смъртта обикновено настъпва от дихателна парализа. В момента няма ефективно лечение за ALS и единствената одобрена от FDA фармакологична терапия е ограничена до рилузол, който причинява само умерено намаляване на прогресията на заболяването и увеличава преживяемостта само с 2 до 3 месеца [41]. Причините за ALS са сложни и многофакторни, обхващащи генетични и екологични фактори: прекомерното окислително увреждане, натрупване на неврофиламенти, екситотоксичност и дисфункция на митохондриалната мембрана са някои от предполагаемите причини [42–44].
Поради многофакторния му произход все още не са идентифицирани специфични цели на лечението и за съжаление все още липсва ефективна терапия. Подобно на други невродегенеративни нарушения, вероятното участие на митохондриите прави KD обещаващ синергичен инструмент за лечение на ALS [45]. При около 10% от пациентите с ALS това е наследствено заболяване (фамилна амиотрофична склероза FALS) и при 20% от тези пациенти има мутация в гена, кодиращ ензима Cu/Zn супероксид дисмутаза 1 (SOD1) [46]. Тази мутация е свързана с митохондриална активност; всъщност е мутантът SOD1, който е локализиран в свързващия митохондрии bcl2 (клетъчен антиапоптотичен протеин) [47]. Освен това намалената активност на митохондриален комплекс I е измерена в скелетните мускули и гръбначния мозък на пациенти с ALS [48]. Резултатите показват, че KB може да действа върху митохондриалната функция, като възстановява, например, комплекс I функция, след фармакологично блокиране. Освен това, в култивирани неврони, третирани с фармакологични агенти, блокиращи комплекс I, добавяне на KB възстановява функцията на комплекса [49].
5. Митохондриални нарушения и кетогенна диета
В предишния параграф сме обсъждали ролята на митохондриите при неврологично заболяване като ALS. Има все повече доказателства, че KD може да подобри функционирането на митохондриите и да стимулира митохондриогенезата [57–60]. Както заяви Уолъс и колеги, „По ирония на съдбата един от най-старите терапевтични подходи - гладуването и кетогенната диета - остава най-обещаващото лечение за митохондриални дефекти“ [61]. Всъщност, въпреки че KD като терапевтично средство е известно от 20-те години на XX век, неговите ефекти върху митохондриите са сравнително скорошно откритие. Някои митохондриални дефекти могат да причинят гърчове с различни епилептични фенотипове [62]. Има някои обнадеждаващи данни за ефектите на KD в митохондриопатиите. Kang et al. [63] показа, че KD може да бъде безопасна и ефективна терапия, която намалява гърчовете при деца с неразрешима епилепсия и различни дефекти на дихателния комплекс (комплекс I, II, IV или комбиниран).
Ahola-Erkkilä и сътр. [64] са лекували миши модел за митохондриална миопатия с късно начало, за която е известно, че причинява при хората автозомно доминираща прогресивна външна офталмоплегия, с генерализирана мускулна слабост, натрупване на генерализирани делеции на mtDNA и отрицателни на цитохром с оксидаза мускулни влакна с KD. KD намалява количеството на отрицателните на цитохром с оксидаза мускулни влакна и предотвратява образуването на митохондриални ултраструктурни аномалии в мускула. Диетата излекува повечето метаболитни и липидомични аномалии не чрез действие върху mtDNA, а чрез индуциране на митохондриална биогенеза. Независимо от това, ние трябва да вземем предвид двете страни на една и съща монета: въпреки че KD може да бъде терапевтичен инструмент при много митохондриални заболявания, той е противопоказан при няколко метаболитни нарушения. Пациентите с нарушение на метаболизма на мазнините могат да претърпят тежка катаболна криза.
Вродени грешки в ензимите, участващи в метаболизма на липидите: от митохондриалния мембранен механизъм за транспортиране на дълговерижни мастни киселини до бета-окисление и цикълът на Krebs може да бъде потенциално фатален по време на гладуване или KD. По този начин, дефицит на карнитин, карнитин палмитоилтрансфераза (CPT) I или II, дефицит на карнитин транслоказа, дефекти на b-окислението или дефицит на пируват карбоксилаза трябва да бъдат изследвани преди започване на лечението с KD. Освен това, KD може да изостри острата интермитентна порфирия при засегнатите субекти [65].
6. Болест на Алцхаймер и кетогенна диета
И накрая, въпреки че няма преки или силни доказателства за полезността на KD при хората, този хранителен подход изглежда обещаващ и затова заслужава допълнителни клинични обширни проучвания.
7. Болест на Паркинсон и кетогенна диета
8. Гликогенози и кетогенна диета
9. Заключения
Особеното метаболитно състояние, индуцирано от KD, е широко изследвано през последните години. Увеличаването на концентрацията на KBs, намаляването на кръвната глюкоза заедно с участието на много важни пътища (напр. IGF-1/AKT/mTor, AMPK/PGC1α) се оказа потенциално терапевтично оръжие срещу много неврологични и нервно-мускулни заболявания.
Въпреки че тези проучвания предоставят теоретична основа за ефекта на KD върху редица нервно-мускулни заболявания, остават няколко важни препятствия, преди тези констатации да могат да се приложат широко в клиничната практика или усилията за обществено здраве. Първо, малко се знае за точния механизъм на действие на KD върху нервно-мускулните заболявания и, второ, дългосрочните ефекти от този вид диета трябва да бъдат изследвани при тези пациенти.
Въпреки факта, че разполагаме само с предварителни доказателства, базирани предимно на животински модели, повечето налични набори от данни показват, че предполагаемият механизъм на KD при някои неврологични и нервно-мускулни заболявания може да бъде както следва. (1) Осигурете ефективен източник на енергия за лечение на някои видове невродегенеративни заболявания, характеризиращи се с фокален мозъчен хипометаболизъм като болестта на Паркинсон и Алцхаймер. Невроналните клетки са способни да метаболизират KBs дори при наличие на дефицит на глюкоза. Кетоните могат да увеличат
на АТФ хидролиза и осигуряват източник на цитоплазмен ацетил-КоА, който може да притъпи понижаването на ацетилхолина, характерно за мозъка на Алцхаймер. (2) Намаляване на окислителните щети, свързани с различни видове метаболитен стрес. В сравнение с метаболизма на глюкозата, кетоните генерират по-ниски нива на оксидативен стрес в мозъка, заедно с по-голяма клетъчна енергия и антиоксидантен капацитет. Освен това кетозата може да увеличи глутатион пероксидазата в хипокампалните клетки и като цяло намалява производството на ROS на митохондриите. (3) Увеличете пътищата на митохондриалната биогенеза (чрез активиране на AMPK и PGC 1 α пътека). Подобряването на митохондриалните пътища може да помогне за подобряване на мозъчния и невроналния метаболизъм. (4) Позволете на кетоните да заобиколят дефекта в активността на митохондриален комплекс I, основан в скелетните мускули и гръбначния мозък на ALS. В култивирани неврони, третирани с фармакологични агенти, блокиращи комплекс I, добавяне на KB възстановява функцията на комплекса. (5) Намалете количеството на отрицателните на цитохром-с оксидаза мускулни влакна при някои митохондриални миопатии и предотвратете образуването на митохондриални ултраструктурни аномалии в мускула.
В заключение, ние вярваме, че KD трябва да се проучи по-задълбочено за неговата насърчителна перспектива като терапия за много нервно-мускулни и невродегенеративни заболявания.
Конфликт на интереси
Авторите декларират, че няма конфликт на интереси по отношение на публикуването на тази статия.
Препратки
- Как кетогенната диета може да повлияе на кожата ви
- Билки - чудесна подкрепа за кетогенна диета
- Ето един лесен обяснител за кетогенната диета HuffPost Life
- IJMS Безплатни пълнотекстови митохондриални дисфункции Червена нишка при невродегенеративни заболявания
- Значение на кръвен тест преди започване на протеинова кетогенна диета