Резюме
Заден план
Стомашно-чревна дисфункция и нарушения на чревния микробен състав са широко докладвани при разстройство от аутистичния спектър (ASD). Това проучване изследва дали нарушенията на чревния микробиом присъстват в BTBR T + tf/j (BTBR) миши модел на ASD и дали кетогенната диета, диета, показана по-рано, която предизвиква терапевтична полза в този модел на мишка, може да промени профила.
Констатации
Непълнолетни мъжки мишки C57BL/6 (B6) и BTBR са хранени със стандартна чау (CH, 13% kcal мазнина) или кетогенна диета (KD, 75% kcal мазнини) в продължение на 10-14 дни. След диети, фекални и цекални проби бяха събрани за анализ. Основните констатации са, както следва: (1) чревната микробиотна композиция от цекални и фекални проби са променени в BTBR в сравнение с контролните мишки, което показва, че този модел може да бъде полезен при разбирането на взаимодействията между червата и мозъка при ASD; (2) Консумацията на KD предизвиква антимикробно-подобен ефект чрез значително намаляване на общото изобилие на бактериите гостоприемници в цекалните и фекалните вещества; (3) специфично за BTBR животни, KD противодейства на общия ASD фенотип на ниско съотношение Firmicutes към Bacteroidetes и при двата типа проби; и (4) KD се обърна повишено Akkermansia muciniphila съдържание в цекулната и фекалната материя на BTBR животни.
Заключения
Резултатите показват, че консумацията на KD вероятно предизвиква намаляване на общия брой на микробните клетки в червата и ремоделиране на състава в мишката BTBR. Тези открития могат да обяснят отчасти способността на KD да смекчава някои от неврологичните симптоми, свързани с ASD в животински модел.
Въведение
Разстройството от аутистичния спектър (ASD) обхваща няколко нарушения на невроразвитието, при които пристъпите и стомашно-чревната (GI) дисфункция съществуват като симптоми [1, 2]. Намиращ се в стомашно-чревния тракт, чревният микробиом е изключително разнообразна екосистема, състояща се от трилиони бактерии и други микроорганизми [3]. Давайки метаболитен капацитет от
100 пъти по-големи от човешкия черен дроб, тези бактерии са замесени в промяната на метаболизма на гостоприемника и имунната функция [3, 4]. Последните изследвания също така показват промени в микробния профил както на животински модел на ASD, изложен на валпроева киселина [5], така и на пациенти с ASD в сравнение с контролите [1, 2].
Мишката BTBR T + tf/j (BTBR) имитира поведенческия фенотип, свързан с ASD, въпреки че липсва спонтанна припадъчна активност [6, 7]. Кетогенната диета (KD), която се прилага като лечение на фармакологично резистентна епилепсия от началото на ХХ век [6], е показала, че подобрява основните симптоми на ASD при животни с BTBR [6]. Тази работа представлява първото успешно използване на диетична терапия за противодействие на комуникационни дефекти, повтарящо се поведение и увреждания в общителността в миши модел на ASD. Съдържащ висок дял на мазнини, адекватни протеини и ниско съдържание на въглехидрати, KD предизвиква драстична промяна в метаболизма на гостоприемника, като имитира състоянието на гладно и насърчава производството и използването на кетонни организми. Въпреки че KD въздейства основно на нервната тъкан [8], въздействието на такива радикални метаболитни промени върху чревния микробиом все още не е изследвано.
Изследвания, изследващи както мозъчната, така и чревната функция, показват, че и двете тъкани имат различна степен на участие в прогресията на ASD [5, 9]. Скорошна обединяваща теория, наречена „ос на червата и мозъка“, очертава взаимодействията между мозъка и микробиома, което предполага възможна връзка при ASD [9, 10]. Това изследване предполага, че нарушаването на състава или разнообразието на чревната микробиота може да модулира поведението и невронната биохимия. Следователно целта на това проучване е да се изследва въздействието на KD върху чревната микробиота на миши модел на ASD.
Методи
Животни и диетични интервенции
Всички експериментални протоколи бяха в съответствие с етичните стандарти, одобрени от Комитета по грижа и употреба на животните в Университета в Калгари. Непълнолетни мъжки мишки C57BL/6 (B6) и BTBR T + tf/j (н = 21 и 25, съответно) са съответствали на възрастта до 5-седмична възраст, преди да бъдат избрани на случаен принцип за прилагане на стандартна чау (CH, 13% kcal мазнина) или кетогенна диета (KD, 75% kcal мазнини; Bio-Serv F3666, Frenchtown, САЩ) за 10–14 дни. Времевата точка от 7-седмична възраст както за мишки B6, така и за BTBR е установена, за да се гарантира, че и двете кохорти са в пост-пубертетно развитие [11]. Преди жертвоприношението животните бяха настанени в стая с контролирана влажност с 12-часов цикъл светло/тъмно цайтгебер и бяха хранени ad libitum. След 10-14 дни диетична интервенция, мишките бяха умъртвени чрез цервикална дислокация. По време на жертвоприношението животните са били на 7-седмична възраст.
Поведенчески анализ
По-рано публикувана работа върху мишката BTBR изследва въздействието на KD върху няколко поведенчески мерки на сходна възраст като мишките в настоящото проучване [12]. Накратко, самонасочващото се повтарящо се поведение (самоподдържане) беше количествено определено в трикамерния тест за общителност и комуникацията беше оценена чрез социално предаване на предпочитание към храната [6]. Тези данни са докладвани повторно и е показано, че осигуряват референтна рамка за настоящата работа върху чревния микробиом във връзка с диетата.
ДНК екстракция и qRT-PCR анализ
Пресни фекални проби бяха събрани преди жертвоприношение, а цекалното съдържание бе събрано посмъртно. Всички проби се съхраняват при -80 ° C до анализ. Използвайки
250 mg фекални/цекални вещества, обща ДНК бяха извлечени и количествено определени, както беше описано по-рано [13]. Микробното профилиране е проведено с помощта на iCycler (BioRad, Hercules, USA), както беше съобщено по-рано [13]. Стандартните криви бяха нормализирани спрямо броя на копията на гените на 16S рибозомна РНК (rRNA), като се използва референтен размер на генома на щама и стойностите на броя на копията на 16S rRNA ген, получени от следната справка [14]. Данните се изразяват като 16S рРНК генни копия/mg цекална или фекална материя. Групово специфичните грундове са показани в Допълнителен файл 1: Таблица S1 и са посочени в по-рано публикувана работа [13]. Всички изходни данни за животни и трансформирана чревна микробиота са публикувани преди това [15] и те са включени тук, за да осигурят референтна рамка за свързаните с аутизма данни. Преди публикувана работа изследва математическата връзка между специфични чревни микроби и серумна метаболомика, а не ASD.
Статистически анализ
Статистическият анализ беше извършен с помощта на IBM SPSS Statistics за Windows, версия 20.0. Данните са изразени като средна стойност ± SEM. Разликите между генотипа и диетата се определят чрез дисперсионен анализ (ANOVA), последван от post hoc тест на Tukey, където стр
Констатации
BTBR мишката показва много поведенчески фенотипове, свързани с ASD, включително нарушени вокализации и социални взаимодействия [12, 16]. Предишна работа, изследваща въздействието на KD върху BTBR, демонстрира диетата за подобряване на общителността и комуникацията на предпочитанията към храната, като същевременно намалява самонасочващото се повтарящо се поведение [6]. Понастоящем механизмът (механизмите), медииращ тези ползи, е неизвестен, но много от тях включват комуникация с чревната микробиота. Целта на настоящото проучване е да се изследва въздействието на KD върху чревната микробиота на миши модел на ASD.
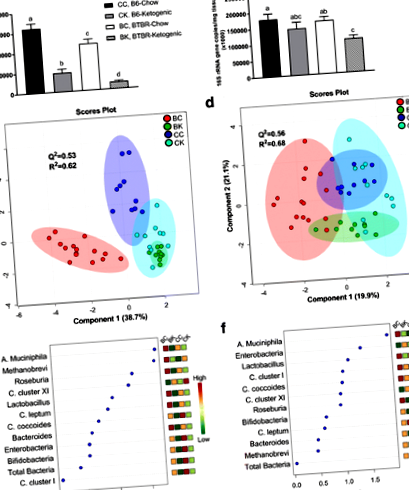
Основните констатации от това проучване са както следва: (1) съставът на чревната микробиота на цекулни и фекални проби е променен в BTBR в сравнение с контролните мишки, което показва, че този модел може да бъде полезен при разбирането на взаимодействията между червата и мозъка при ASD; (2) Консумацията на KD причинява „антимикробен“ подобен ефект чрез значително намаляване на общото количество бактерии в гостоприемника в цекалните и фекалните вещества; (3) специфично за BTBR животни, KD противодейства на общия ASD фенотип на ниско съотношение Firmicutes към Bacteroidetes както в цекалната, така и във фекалната материя; и (4) KD обърна повишеното Akkermansia muciniphila съдържание в цекулната и фекалната материя на BTBR животни.
Нашите резултати установиха отчетливи разлики в масата на животните между контролните и BTBR животните (Таблица 1). Допълнителни разлики между генотипа бяха забелязани след 16S rRNA микробно профилиране на цекални и фекални проби. Изследването на данните, използващи многовариатен анализ, установи, че нашите контролни (B6) и BTBR мишки имат различни цекални и фекални микробни профили (Фиг. 1a-d и Таблица 2). Включени са първите три метаболита, отговорни за стимулирането на разделянето на групите A. muciniphila, Метанобревибактер spp., и Roseburia spp. в цекалните проби и A. muciniphila, Enterobacteriaceae и Лактобацилус във фекалните проби.
Целулозните и фекалните тъкани бяха оценени в настоящото проучване, тъй като изследванията показват, че изобилието и разнообразието на микробите са пряко свързани с физиологичната роля на всеки сегмент на стомашно-чревния тракт [17]. В подкрепа на предишна работа, нашите данни показват увеличение на общото микробно съдържание по-надолу по стомашно-чревния тракт и увеличаване на задължителните анаероби Bacteroidetes (Бактероиди/Превотела spp.) във фекалните тъкани [17]. Въпреки това, с изключение на Enterobacteriaceae, промените в посоката, възникващи с KD, обикновено се запазват между тези две места за вземане на проби.
Изследването на нашите данни показва няколко промени в микробиотата на фекалните черва на BTBR мишки, които се наблюдават при пациенти с ASD, включително повишени Клостридий клъстер XI [18], намалени Firmicutes (Clostridium coccoides, Clostridium leptum, Клостридий клъстери XI и I, Roseburia spp., и Лактобацилус spp.) [2] и повишени Bacteroidetes [1]. Взети заедно, нашите резултати показват, че моделът на мишка BTBR може да даде представа за ролята на чревно-мозъчните взаимодействия при ASD и че може да бъде полезен при тестване на въздействието на интервенции като пред- и пробиотично приложение върху заболяването.
Резултатите както от цекалния, така и от фекалния анализ показват значителен спад в общото бактериално съдържание при прилагането на KD и при двата животински генотипа (Фиг. 1а, б). Интересното е, че KD намалява общите цекални и фекални микроби при BTBR животни със средно съответно 78 и 28%. Те се обясняват с основната отговорност на чревната микробиота да разгражда неусвоените въглехидрати, които са значително намалени в KD [19]. В съответствие с това се съобщава, че краткосрочното приложение на ванкомицин, широкоспектърен перорален антибиотик, подобрява поведенческите симптоми на ASD при млади момчета [20]. Тъй като ванкомицин не може да се абсорбира и няма взаимодействие с централната нервна система, се смята, че получените подобрения в поведението включват чревни микробиом-лекарствени взаимодействия [21].
В обобщение, това проучване показва, че консумацията на KD предизвиква ремоделиране на чревната микробиота в животински модел на ASD. Тези открития могат да предоставят представа за терапевтичния потенциал на манипулацията на KD чрез въздействие върху чревния микробен състав. Поради оскъдността на изследванията, изследващи ролята на микробиома в KD терапията, предлагаме по-нататъшни изследвания на сложното взаимодействие между чревния микробиом и мозъка, свързани с ASD и други неврологични нарушения.
- Кетогенна диета за аутизъм - Vital Kids Medicine
- Кетогенна диета и аутизъм Как преминаването на кето може да помогне
- Как кетогенната диета може да повлияе на кожата ви
- Билки - чудесна подкрепа за кетогенна диета
- Ето един лесен обяснител за кетогенната диета HuffPost Life