Свързани термини:
- Полизахарид
- Полизахариди
- Глюкан
- Ензимна хидролиза
- Желиране
- Зърнена закуска
- Овес
- Ечемик
- Cetraria islandica
Изтеглете като PDF
За тази страница
Химия на β-глюканите
1.H.4.a Лишей (1,3; 1,4) -β-глюкани
(1,3; 1,4) -β-глюкан лихенинът може да се извлече с гореща вода от листата на исландския мъх (Cetraria islandica). Глюканът е разположен в клетъчните стени на микобионта (Honegger and Haisch, 2001). В сравнение с аналозите на зърнените култури лихенинът има много по-високо съотношение на три-/тетра-захаридни строителни единици (вж. Таблица 2), въпреки че съдържанието на тези два олигозахарида е само 75% в сравнение с> 90% за зърнените глюкани; целоолигозахаридите DP 5–14 представляват 22% от молекулата.
Подобни на лихенин полизахариди са съобщени от редица други лишеи (Stone and Clarke, 1992; Carbonero et al., 2001, 2002, 2005, 2006).
Разпределение, фина структура и функция на (1,3; 1,4) -β-глюкани в тревите и други такси
Лишеи и гъби
Въпреки широкото им разпространение в лишеите, (1,3; 1,4) -β-глюкани са докладвани в клетъчните стени само на една нелишейна гъба, аскомицета Aspergillus fumigatus, където те се срещат като част от много сложен, неразтворим в алкали хетерополизахарид (Fontaine et al., 2000).
Взаимодействия между протеини и (1,3) -β-глюкани и сродни полизахариди
I.D.c CBM 11
CBM11 е малко семейство с докладвани само осем членове - всички те са модули в ендо-1,4-β-глюканази (Coutinho и Henrissat, 1999). Понастоящем е налична една структура за CBM11 от C. thermocellum Lic26A-CelE (CtCBM11, PDB ID: 1V0A) (Malburg et al., 1997). Този ензим съдържа както фамилен 5, така и 26 каталитичен домейн, който има диференциална активност съответно върху (1,3) -β-глюкан и (1,3; 1,4) -β-глюкани. Дали самотният CBM в този контекст показва преференциално свързване за някой от тези предсказани субстрати или взаимодейства размило с двата, е важен биологичен въпрос за нашето разбиране на CBM филогенията и разпознаването на β-глюкан.
За да се изследва профилът на свързване на CtCBM11, модулът беше тестван срещу библиотека от различни сложни полизахариди (Carvalho et al., 2004). Използвайки афинитетна гел електрофореза, беше показано, че Ct CBM11 свързва (1,3; 1,4) -β-глюкани, овесени β-глюкани и лихенин с най-висок афинитет; демонстрира по-слабо свързване с хидроксилетил целулоза, глюкоманан и ксилан от овесена спелта; и не взаимодейства с чисти (1,3) -β-глюкани. Това наблюдение беше подкрепено с използване на изотермична титруваща калориметрия, която определи, че (1,3; 1,4) -β-глюкани, включително лихенин, овесени β-глюкани и (1,3; 1,4) -β-глюкотетразахариди, свързани с ∼5 пъти по-голям афинитет от (1,4) -β-олигоглюкозиди (Carvalho et al., 2004). Преференциалните взаимодействия с (1,3; 1,4) -β-глюкани и (1,4) -β-глюкани успоредно действат на приложеното семейство GH 5 и 26 каталитични модула и показват, че CtCBM11 е пригоден за набиране на двете гликозидази с различни специфики на подлежащи целеви субстрати. Остава да се установи дали ензимните дейности надолу по веригата са съпътстващи (GH5A и GH26 активни едновременно) или последователни (един ензим изостава от другия в зависимост от концентрацията на субстрата).
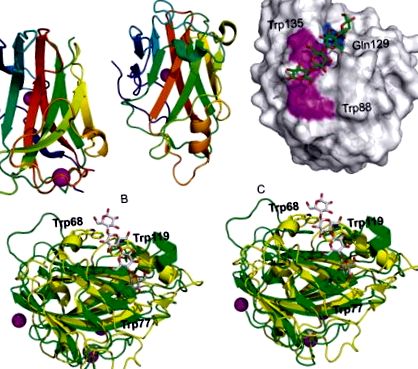
Структурата на CtCBM11 е β-сандвич с топология на желирано валцуване, съдържащ два структурни калциеви атома (Фиг. 5А) (Malburg et al., 1997). Първият калций се намира в изпъкналия β-лист, а вторият е координиран в зоните на контура в близост до N- и C-краищата, което осигурява стабилност на този регион, който няма значителна вторична структура. Мястото на свързване се картографира към вдлъбнатия β-лист чрез насочена към сайта мутагенеза, което демонстрира важността на три ароматни остатъка в образуването на комплекс: Y22, Y53 и Y129. Дисекцията и изясняването на молекулните детерминанти на разпознаването на β-глюкан очакват доклада за протеиновите комплекси, съдържащи (1,3; 1,4) - и (1,4) -β-олигоглюкозиди.
Фиг. 5:. (А) Карикатурно представяне на CtCBM11 в комплекс с два калциеви атома, показани като сфери (PDB ID: 1V0A). (B) Карикатурно представяне на CcCBM17 в комплекс с калциев атом, показан като сфера (PDB ID: 1J83). (C) Модел на повърхност, достъпна за разтворител на CcCBM17 в комплекс с целотетраоза (PDB ID: 1J84). Плитката свързваща цепка е облицована с два повърхностни ароматни остатъка, Trp88 и Trp135, и Gln129. (D) Стеновиден стерео изглед на Bsp CBM28 (PDB ID: 1UWW), покрит с Ct CBM17 (жълт, PDB ID: 1V0A). Показват се ароматните остатъци, замесени в свързването за Bsp CBM28 (Trp68, Trp77 и Trp119). Показан е целотетраозният лиганд от CtCBM17. Спецификациите на цветовете се отнасят до цветовете в панелите.
Физикохимия на (1,3) -β-глюкани
II.C.3 Желиране на зърнени (1,3; 1,4) -β-глюкани
Фигура 22:. Верижни взаимодействия в (1,3; 1,4) -β-глюкан, водещи до желиране. (А) Поредици от последователни (1,4) -β-връзки се свързват. (B) Асоциация на последователни целотриозни единици, съединени от (1,3) -β-връзки, която образува спираловидна структура.
От Бьом и Кулике (1999) .
Таблица 3:. Модул на компресия (E), истински стрес (τ tr) и истинско напрежение (ε tr) при повреда за (1,3; 1,4) -β-глюкан гелове при концентрация 8% (w/v)
| Овес200 | 2.1 | 36.6 | 4.5 | 0,22 |
| Ечемик200 | 3.0 | 36.7 | 6.3 | 0,38 |
| Пшеница200 | 3.1 | 44.6 | 18.5 | 0,5 |
| Овес100 | 2.1 | 39.7 | 2.5 | 0,08 |
| Ечемик 100 | 2.8 | 55.7 | 4.6 | 0,16 |
| Лихенин 100 | 24.5 | 91.1 | 24.3 | 0,27 |
200 и 100 представляват приблизителната моларна маса × 10 −3. Гел втвърдяване и температура на измерване 25 ° C. От Lazaridou et al. (2004).
Еволюционни аспекти на (1,3) -β-глюкани и сродни полизахариди
4.7.3 Поява на (1,3; 1,4) -β-глюкани
Фиг. 2:. Появата на (1,3; 1,4) -β-глюкани в редици от глаукофитите, червените водорасли и зелените водорасли до комелинида Poales: a. червеното водорасло Kappapheus съдържа сулфатирана форма; б. глюканът в хлорофитните водорасли Ulva съдържа ксилоза; ° С. в десмида Micrasterias (харофитна водорасло); д. глюканът в черния дроб Locopholea (бриофит) съдържа арабиноза; д. в род монилофит Equisetum (хвощ); е. в Poaceae и свързаните с тях семейства „основни Poales“ в Poales sensu lato.
Триходерма ензими за текстилната промишленост
Терхи Пуранен,. Jari Vehmaanperä, в Биотехнологиите и биологията на Trichoderma, 2014
Ензимни класове въз основа на каталитична активност
Индустриалните ензими традиционно се класифицират в съответствие с IUB ензимната номенклатура, която се основава както на типа реакция, така и на специфичността на субстрата (Bairoch, 2000). Например, целулазите принадлежат към хидролазите и към нейния подклас гликозил хидролази, т.е. ензими, хидролизиращи O- и S-гликозилни съединения (EC 3.2.1. ×). Триходерма целулазите са разделени на ендодействащи ензими, хидролизиращи се в средата на полимерната верига, и екзодействащи хидролази, обработващи се от редуциращия или нередуциращия край. Триходерма ендоглюканазите принадлежат към клас ЕС 3.2.1.4 и те хидролизират (1 → 4) -β- d -глюкозидните връзки в целулоза, лихенин и зърнени β- d -глюкан. Целобиохидролазата I (EC 3.2.1.176) освобождава целобиоза от редуциращия край на веригата, докато целобиохидролазата II (EC 3.2.1.91) действа в нередуциращия край на целулозата. При пълна хидролиза на целулоза се смята, че ендоглюканазите атакуват аморфните области на целулозата и произвеждат краища на веригите, които служат като субстрат за екзоглюканазите (целобиохидролази), които също могат да действат върху кристалната област. Тези последни ензими произвеждат дизахарид целобиоза, която се хидролизира до два глюкозни мономера от β-глюкозидаза (Zhang and Lynd, 2004; Sticklen, 2008).
Класификацията на IUB не отразява структурните характеристики на ензимите, така че е приет друг подход за класификация на ензимите (Henrissat, 1991). Той се основава на сходство между гънките или последователностите между ензимите и е значително улеснен от натрупването на данни за пептидни последователности и триизмерни протеинови структури. Базата данни CAZy (за въглехидратно-активни ензими) се поддържа на адрес http://www.cazy.org и понастоящем изброява повече от 130 семейства гликозид хидролаза. Основните ендоглюканази на Trichoderma принадлежат към GH семейство 5 (ендоглюканаза II или EGII), GH семейство 7 (ендоглюканаза I или EGI) и GH семейство 12 (ендоглюканаза III или EGIII). Целобиохидролазите I и II са разпределени съответно на GH семейства 7 и 6. Trichoderma reesei също има ендоглюканаза EGV, която принадлежи към семейството на гликозид хидролазата 45. GH семейство 45 е важен ензимен клас, тъй като много от членовете на семейството, като тези, получени от родовете Humicola, Thielavia или Melanocarpus, се използват в текстилни приложения (Schülein, 2000; Haakana et al., 2004). Характеристиките на Trichoderma EGV обаче се различават значително от тези на GH45 целулазите, предлагани на пазара на текстил. По този начин Trichoderma EGV не е комерсиализиран (Karlsson et al., 2002).
Класификацията CAZy също отразява генната и протеинова номенклатура: предлага се гените да бъдат обозначени според тяхното семейство GH, с буквени кодове в азбучен ред за множество гени, кодиращи ензими от едно и също семейство (Henrissat et al., 1998 ). По този начин гените на Trichoderma cellulases целобиохидролаза I и ендоглюканаза I, принадлежащи към едно и също семейство - GH7 - биха имали съкращенията cel7A и cel7B съответно, в съответствие с реда на докладваните протеинови последователности. Докато системата опростява сравнението на различни хидролази от различни организми, тя има недостатъка, че ензимите с различни начини на действие имат сходни съкращения, като един пример е екзодействащата целобиохидролаза I (Cel7A) и ендо-действащата ендоглюканаза I (Cel7B) . Освен това, тъй като буквеният код отразява поредността на откритието, а не структурата или аминокиселинната последователност, подобно действащите или хомологични ензими в различните организми ще имат различни буквени кодове.
За целите на яснотата използваме двойни съкращения в този преглед: например, ендоглюканазата II има код EGII/Cel5A.
- Непряка калориметрия - общ преглед на ScienceDirect теми
- Интеркостален нерв - общ преглед на ScienceDirect теми
- Умишлено отравяне - общ преглед на ScienceDirect теми
- Триглицерид със средна верига - общ преглед на ScienceDirect теми
- Ламинин - общ преглед на ScienceDirect теми