Субекти
Резюме
Заден план
Функционална популация от адипоцитни предшественици, наречени строени/стволови клетки (ASC), получени от мастна тъкан, е от решаващо значение за правилното разширяване на мастната тъкан (AT), обработка на липиди и предотвратяване на липотоксичност в отговор на хроничен положителен енергиен баланс. По-рано показахме, че хората със затлъстяване съдържат дисфункционален набор от ASC. Изясняването на механизмите, лежащи в основата на анормалната функция на ASC, може да доведе до терапевтични интервенции за предотвратяване на липотоксичност чрез подобряване на адипогенния капацитет на ASC.
Методи
Използвайки проучвания за асоцииране в целия епигеном, ние изследвахме въздействието на затлъстяването върху метилиращия признак на човешките ASC и техните диференцирани аналози. Извършено е митохондриално фенотипиране на слаби и затлъстели ASC. TBX15 Проведени са експерименти със загуба и печалба на функцията и са проведени проучвания на Уестърн блотинг и електронна микроскопия на митохондрии при бели AT биопсии от слаби и затлъстели индивиди.
Резултати
Открихме, че метилирането на ДНК в предшествениците на адипоцити е значително модифицирано от затлъстялата среда и адипогенезата, възпалението и имуносупресията са най-засегнатите пътища. Също така идентифицирахме TBX15 като един от най-диференциално хипометилираните гени при затлъстели ASC и генетичните експерименти разкриха това TBX15 е регулатор на митохондриалната маса в затлъстелите адипоцити. Съответно, морфологичният анализ на AT от затлъстели пациенти показва промяна в митохондриалната мрежа, с промени в формата и броя на митохондриите.
Заключения
Идентифицирахме ДНК метилиращ подпис в адипоцитни предшественици, свързани със затлъстяването, което има значително влияние върху метаболитния фенотип на зрелите адипоцити.
Въведение
Затлъстяването се превърна в основна грижа за общественото здраве, тъй като е рисков фактор за няколко заболявания, включително диабет тип 2 (T2D), сърдечно-съдови заболявания и някои форми на рак. Понастоящем се признава, че затлъстяването, което традиционно се счита за произтичащо преди всичко от дисбаланс между енергийния прием и разходите, благоприятстващи съхранението на мазнини, е резултат от взаимодействието между факторите на околната среда и генетичните фактори. В действителност, все по-голям брой доказателства подкрепят епигенетиката като ключов механистичен медиатор на взаимодействията между гените и околната среда, залегнали в основата на затлъстяването и съпътстващите го заболявания [1].
Бялата мастна тъкан (WAT) е вероятно най-пластичният орган в тялото. В отговор на хроничен положителен енергиен баланс, WAT се разширява чрез увеличаване на обема на съществуващите адипоцити (хипертрофия) и чрез генериране на нови адипоцити (хиперплазия) чрез набиране на адипоцитни предшественици, наречени строени/стволови клетки, получени от мастна тъкан (ASC), които се намират при периваскуларна WAT строма. ASC се подлагат на адипогенеза и се диференцират в зрели адипоцити, за да поддържат оборота на адипоцитите в нормално метаболитно състояние [2]. Наличната информация предполага, че хомеостазата на WAT е нарушена в обезогенен контекст поради нерегулирана адипогенеза [3], подкрепяща концепцията, че ASC са важни играчи в WAT ремоделирането по време на затлъстяване [4].
Ние и други демонстрирахме, че подкожната мастна тъкан (SAT) от затлъстели субекти съдържа дисфункционален пул от човешки ASC (hASC). Съответно, има доказателства за връзка между затлъстяването и загубата на hASC мултипотентност [5], повишена пролиферация на hASC [6], устойчивост на апоптоза [7] и намален адипогенен потенциал [6, 8]. Освен това, скорошно проучване от нашата група показа, че метаболитният фенотип на донора компрометира имуномодулиращите свойства на hASCs [9].
Материали и методи
Учебни предмети
За епигенетични проучвания за асоцииране (EWAS), hASCs са получени от SAT на здрави жени донори, подложени на елективна липосукция (кохорта I): н = 6 постно, ИТМ 22,4 ± 12 kg/m 2, възраст 44,3 ± 9,2 години; н = 6 затлъстели, BMI 32,6 ± 2,2 kg/m 2, възраст 34,3 ± 7,4 години (LaCell LLC, Ню Орлиънс). Донорите бяха класифицирани като слаби или затлъстели въз основа на ИТМ следвайки критериите на Световната здравна организация. Всички участници дадоха своето информирано съгласие и проучването беше прегледано и одобрено от Western Institutional Review Board (Puyallup, WA, САЩ; протокол № 201304490).
За други молекулярни анализи, hASCs бяха изолирани от SAT на донори, съвпадащи с възрастта и пола, подложени на неостри хирургични интервенции, като херния или холецистектомия, при планирана рутинна операция (кохорта II): н = 4 постно, BMI 23,7 ± 1,1 kg/m 2, възраст 52,8 ± 11,5 години; н = 4 затлъстели, ИТМ 32,4 ± 3 kg/m 2, възраст 52 ± 10,5 години. Всички участници дадоха своето информирано съгласие и проучването беше прегледано и одобрено от комисията по етика и изследвания на Университетската болница Joan XXIII, Тарагона, Испания.
Профилиране на ДНК метилиране с помощта на универсален набор от зърна
Геномна ДНК се екстрахира от клетки с помощта на NucleoSpin® Tissue Kit (Macherery-Nagal GmbH). Профилите на ДНК метилиране са генерирани на Infinium Human-Methylation450K BeadChip (Illumina). BeadChip е разработен, за да анализира повече от 480 000 CpG сайтове и паралелно подбира CpG локуси. Данните за метилиране на ДНК бяха обработени с помощта на софтуера GenomeStudio (Illumina) чрез прилагане на настройките по подразбиране. Данните за метилиране са в базата данни на ГЕО с кода за присъединяване GSE111632.
Анализ на данните за метилиране
Всички изчисления и статистически анализи бяха извършени с помощта на R 3.0.2 и Bioconductor 2.13. Анализът на beadchip беше извършен с помощта на пакета BiSeq 1.8.0 [18], който включваше следните етапи: създаване на обект от клас Bssraw (контейнер на суровите данни), идентификация на CpG клъстер, изглаждане на метилиране на съотношение във всеки идентифициран CpG клъстер, тест и ефект на групови модели за всяко CpG място вътре в CpG клъстери, тестване на CpG клъстери за диференциално метилиране и идентифициране на диференциално метилирани сайтове (DMS) [19]. Критериите за изглаждане бяха извършени с използване на 90% квантили и CpG клъстерите, разглеждани за DMS идентификация, бяха филтрирани с помощта на метод на фалшиво откриване ΔΔCt. Ендогенната 18s РНК се използва за нормализиране на нивата на генна експресия и изчисляване на стойностите на ΔCt. Стойностите се изразяват като средна стойност ± SEM. Данните бяха анализирани с помощта на софтуер Excel и GraphPad Prism 5. Разликите бяха счетени за статистически значими, ако стр стойност беше
Резултати
Влияние на затлъстяването върху глобалните модели на метилиране на ДНК в hASC и диференцирани адипоцити
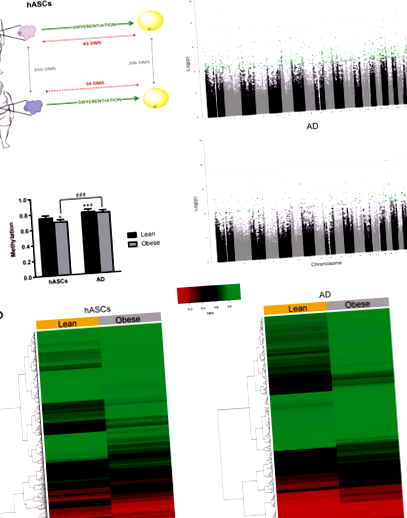
Като първа стъпка за изследване на потенциалния принос на затлъстяването към метилирането на ДНК и диференциацията на адипоцитите, hASCs бяха изолирани от SAT отделението на слаби и затлъстели лица (н = 6; както е описано в Материали и методи). Изолирането и диференцирането на hASCs към зрели адипоцити се извършва, както е описано [6, 9]. Екстрахирахме геномна ДНК от клетки преди и след диференциацията и извършихме EWAS на платформата Illumina, използвайки масива Infinium Human-Methylation450K BeadChip (Фиг. 1а). Установихме праг на двукратна промяна в дневника с a стр стойност Фиг. 1
След това сегментирахме четирите метиломи в три класа: напълно метилирани региони (FMR;> 50% метилирани CpGs), ниско метилирани региони (LMR; шелф> бряг> открито море) е изобразен на фиг. 2б, десни панели. И в двете настройки 67% от значителните промени са открити в най-отдалечените райони от остров CpG (брег и открито море).
Като цяло горните данни показват, че hASCs са обусловени от затлъстяване чрез натрупване на епигенетични модификации, поне на нивото на метилиране на ДНК, което може да е в основата на променената пластичност на hASCs, получени от затлъстяване, както беше съобщено по-рано от нас [6, 9] и други [8, 25]. В опит да разберем кои молекулярни пътища могат да повлияят нишата на hASC в затлъстела среда, ние извършихме функционален анализ чрез обогатяване с GO, използвайки базата данни Ingenuity за всички гени, съдържащи DMS. Тъй като се интересувахме специално от функционалността на адипоцитните прекурсори като ключови детерминанти на разширяването на мастната тъкан, ние се фокусирахме върху промените в hASC отделението. Както се очаква, GO анализът идентифицира генни функции, свързани с адипогенезата (фиг. 2в). Други открити диференциално обогатени биологични пътища включват възпаление (LPS/IL-1) и имуносупресия/възстановяване (TFG-β). Тези открития са в съгласие с нашите по-ранни проучвания, показващи, че hASC от пациенти със затлъстяване имат повишен възпалителен профил и намалени имуносупресивни свойства [6, 9] и са в съответствие с резултатите от други независими проучвания [26, 27].
Влияние на епигенетичния подпис върху генната експресия в hASCs
Хипометилиране на мезодермален ген за развитие TBX15 при затлъстелите hASCs се свързва с митохондриалната функция в зрелите адипоцити
Митохондриален фенотип на човешка подкожна мастна тъкан при затлъстяване
Дискусия
ДНК метилирането е един от най-добре проучените епигенетични механизми, регулиращи генната транскрипция и кодиращи генетични и екологични ефекти като стабилни химически модификации на ДНК. По-доброто разбиране на епигенетиката на hASCs може да помогне при разработването на нови стратегии, предназначени за борба със затлъстяването и/или насърчаване на „здравословното“ разширяване на WAT. В настоящото проучване ние показваме, че диференциацията на hASCs в зрели адипоцити се отразява в дискретен брой промени в метилирането на ДНК. За разлика от това, подписът на метилиране на затлъстели и слаби hASCs е много различен, представяйки безпрецедентен епигенетичен модел за общото късо съединение в мрежата на стволови затлъстели hASCs [5]. Съответно, затлъстялата среда може да отпечата специфичен епигенетичен подпис върху адипоцитните предшественици, така че те да станат нефункционални адипоцити. На този фон предишно проучване от нашата група разкрива, че свързаната със затлъстяването хипоксия на мастната тъкан е необходима, но не е достатъчна, за да се организират значителни функционални промени в зрелите адипоцити [6].
Нашият подход за целия геном ни позволи да дефинираме нови регулаторни региони, които са диференциално метилирани в hASCs и които са свързани с контрола на критичните гени за адипогенна диференциация. Много от DMS, идентифицирани в настоящото проучване, са разположени извън проксималния промотор на ген или остров CpG. Обикновено метилирането на промотори блокира транскрипцията, докато метилирането в генното тяло не блокира и дори може да стимулира транскрипцията [31]. Въпреки че функционалните роли на метилирането на ДНК на генното тяло все още са предмет на дебат [32], нашите резултати показват, че метилирането на генното тяло има пряко въздействие върху генната експресия.
Други изследвания са изследвали епигенетичното състояние на hASCs във връзка с техния потенциал за диференциация, като се стига до заключението, че метилирането на ДНК не отразява нито транскрипционен статус, нито потенциал за генна експресия при диференциация [12, 33]. Тези проучвания обаче са проведени върху тесен набор от адипогенни гени (LEP, PPARG, FABP4, LPL) и въпреки констатацията, че нивата на метилиране са сходни сред клонингите, нивата на иРНК и hASC диференциационният потенциал за зрелите адипоцити са хетерогенни [12]. Освен това не са разгледани други видове стимули, които биха могли епигенетично да приложат мастни клетки-предшественици, като метаболитен статус на донора или затлъстяване, което може да обясни някои от разликите, наблюдавани между клонингите. В съответствие с нашите резултати, Moskaug и колеги [34] показаха, че излагането на hASCs на възпалителни гени с високо ниво на глюкоза и променя метилирането на хистон H3 по начин, предполагащ транскрипционна де-репресия. Ясно е, че са необходими допълнителни проучвания, за да се характеризират напълно факторите, свързани със затлъстяването, в основата на епигенетичния подпис на hASCs, както и потенциалната обратимост на процеса.
Мастната тъкан от затлъстели индивиди и пациенти с T2D съдържа дисфункционален пул от hASCs [8, 9]. Доколкото ни е известно, настоящото изследване е първото, което установява, че патологичната адаптация на hASCs в контекст на затлъстяване се регулира, поне отчасти, на епигенетично ниво. В подкрепа на това схващане Ollikainen и колеги [27] извършиха обширно изследване на метилирането на ДНК в целия геном в SAT от монозиготни близнаци с несъответстващ ИТМ, като установиха регулиране на възпалението и гени за ремоделиране на извънклетъчната матрица, придружени от понижаване на регулацията на адипогенните гени. Въпреки че малко се знае за молекулярните механизми, които се заблуждават при затлъстяване, е ясно, че те могат да бъдат епигенетично регулирани преди развитието на заболяването. Промените в SAT обикновено са свързани с развитието на нездравословно затлъстяване и нашето проучване предоставя доказателства за hASC епигенетична дисфункция като потенциално ключово регулаторно събитие при затлъстяване, което води до нарушено съзряване на адипоцитите.
От 650 CpGs, диференциално метилирани между слаби и затлъстели hASC, 13 са свързани с транскрипционния фактор TBX15. Известно е, че този ген играе основна роля в мезодермалното развитие при всички гръбначни животни [15]; ролята му в WAT обаче е противоречива. Съответно е описано, че затлъстяването може както да се увеличи [30], така и да намалее [35] TBX15 експресия на иРНК. Освен това са приписани противоположни функции TBX15 по отношение на адипогенезата и митохондриалната активност [15, 17].
Важно е да се спомене, че ние изследвахме ефекта на лекото затлъстяване (среден ИТМ от 30 kg/m 2) върху митохондриалната функция, при която може да възникне компенсаторен отговор на мастната клетка. По този начин, лекото затлъстяване може да увреди митохондриалната функция, но адипоцитът може да противодейства на това, като увеличи броя на митохондриите. Известно е, че митохондриите могат да се адаптират към ендокринни или метаболитни предизвикателства (наричани митохондриална пластичност), за да отговорят на техните биоенергийни изисквания. Удължаването на митохондриите е резултат от повишен синтез или намалена активност на делене, типично за състояния на повишена енергийна ефективност (например глад или стареене). По този начин и в съгласие с нашите резултати, скъсяването на митохондриите е резултат от намалена активност на синтез или повишена активност на делене, което е типично за състояния с намалена биоенергийна ефективност като състояние на свръхпредлагане като затлъстяване [41]. Всъщност, тъй като затлъстяването предизвиква преминаване от глюкоза към липидно окисление, по-малко ефективен процес по отношение на производството на АТФ, не е неразумно да се счита, че в началните етапи на затлъстяването мастните клетки се опитват да компенсират това чрез увеличаване на броя на митохондрии.
В заключение показваме, че метилиращият статус на предшествениците на адипоцити е значително модифициран от затлъстяла среда и може да определи митохондриалната функция на мастната тъкан, поддържайки hASC дисфункцията като ключово регулаторно събитие при затлъстяването. Като цяло, нашите данни категорично предполагат, че въпреки че моделите на метилиране на ДНК по същество се запазват по време на ангажираността на линията на мастната тъкан, затлъстяването обуславя hASCs с динамична загуба на метилиране на ДНК в избрани региони, което в крайна сметка може да причини дисфункция на WAT и развитие на метаболитни синдроми при затлъстяване.
Препратки
van Dijk SJ, Tellam RL, Morrison JL, Muhlhausler BS, Molloy PL. Последни разработки относно ролята на епигенетиката при затлъстяването и метаболитните заболявания. Clin Epigenetics. 2015; 7: 66.
Yu G, Floyd ZE, Wu X, Hebert T, Halvorsen YD, Buehrer BM, et al. Адипогенна диференциация на стволови клетки, получени от мастна тъкан. Методи Mol Biol. 2011; 702: 193–200.
- Анатомични местоположения на диабет на кафява мастна тъкан при хора
- Смърт на адипоцитите, ремоделиране на мастните тъкани и усложнения при затлъстяване Диабет
- ДНК на аденовирус 36 в мастна тъкан на пациент с необичайно висцерално затлъстяване - том 16, номер
- Кафява мастна тъкан и студената война срещу диабета със затлъстяване
- Да бъдеш пътуващ в автомобил със затлъстяване, свързано с 32% повишен риск от ранна смърт - ScienceDaily