Джуд Т. Дийни
§ Асистент по медицина, Медицински факултет на Университета в Бостън, 650 Albany Street, 617-638-7088
Джералд В. Денис
† Доцент, директор, Основен център за поточна цитометрия, Център за изследване на хранителното затлъстяване и Център за изследване на рака, Катедра по фармакология и експериментална терапия, Медицинско училище в Бостън, 72 East Concord Street, K520, Бостън, Масачузетс 02118, 617-414-1371 офис, 617-414-1372 лаборатория, 617-638-5673 факс
Резюме
Нарушеният енергиен баланс на тялото може да доведе до затлъстяване и заболявания, задвижвани от затлъстяване, като диабет тип 2, които са достигнали епидемично ниво. Доказателствата сочат, че предизвиканото от затлъстяването възпаление е основна причина за инсулинова резистентност и диабет тип 2. Факторите на околната среда, като хранителни вещества, оказват влияние върху енергийния баланс на тялото чрез епигенетични или базирани на хроматин механизми. Като регулатор на транскрипцията на семейството на бромодомейн и външен домен, Brd2 регулира експресията на много гени чрез интерпретация на хроматиновите кодове и участва в регулирането на енергийния баланс на тялото и имунната функция. В тежко затлъстяване нокдаунът на Brd2 при мишки предотвратява възпалителните реакции, предизвикани от затлъстяването, предпазва животните от диабет тип 2 и по този начин откачва затлъстяването от диабет. Brd2 предоставя важен модел за изследване на функцията на регулаторите на транскрипцията и развитието на затлъстяване и диабет; той също така предоставя възможна цел за лечение на затлъстяване и диабет чрез модулация на функцията на четец на хроматинов код.
I. ВЪВЕДЕНИЕ: ПРОБЛЕМЪТ СЪС ЗАТЪЛВАНЕТО И НЕЙНИТЕ УСЛОВИЯ
Уместно е обаче някои индивиди със затлъстяване да са „метаболитно здрави“ и да се радват на намален риск от сърдечно-съдови заболявания и диабет тип 2 (Sims, 2001; Succurro et al., 2008; Wildman et al., 2008; Klöting et al., 2010 ). „Метаболитно здрави“ затлъстели възрастни са определени като коремно затлъстяване (ИТМ ≥ 30), но липсва метаболитен синдром (Meigs et al., 2006). Такива индивиди обхващат около 25% от възрастното затлъстело население в САЩ, но това разпространение зависи от критериите за включване, с някои съобщени несъгласия в разпространението, от минимум 11% от затлъстелите лица в италианско проучване (Calori et al., 2011) до 47,9% от затлъстелите субекти в корейско проучване (Lee, 2009). „Метаболитно здравият“ затлъстял фенотип е най-добре концептуализиран като непрекъснато разпределение на запазената инсулинова чувствителност като функция от увеличаване на ИТМ (Blüher, 2010). Някои от тези индивиди показват защитни, повишени нива на адипонектин (Aguilar-Salinas et al., 2008) и поддържат нормален глюкозен толеранс въпреки поразително висок ИТМ.
Факторите, които свързват затлъстяването с инсулиновата резистентност и метаболитния синдром, представляват голям медицински интерес, тъй като те са в основата на етиологията на диабет тип 2, задвижван от затлъстяване. По този начин, „метаболитно здравият“ индивид със затлъстяване вероятно ще предостави златна мина за информация. Проучването на тази популация за гени и пътища, които свързват затлъстяването с инсулинова резистентност, има потенциал да идентифицира нови, „подлежащи на лекарство“ цели, за да помогне на нездравословните пациенти със затлъстяване да избегнат най-лошите съпътстващи заболявания в тяхното състояние. Показателно е, че „метаболитно здравият“ затлъстял фенотип е свързан с намален възпалителен профил (Romano et al., 2003; Karelis et al., 2005). По този начин е вероятно възпалителните функции на вродената и адаптивната имунна система да са от съществено значение за свързването на затлъстяването с инсулиновата резистентност, кардиометаболитния риск и диабет тип 2. Необходими са спешни подробности относно подвидовете имунни клетки, техните профили на производство на цитокини и кинетиката на мобилизация при инсулинорезистентния затлъстял субект и как те се различават по критични начини, образувайки „метаболитно здравия“ затлъстял субект.
V. ДРУГИ ЖИВОТИНСКИ МОДЕЛИ НА „МЕТАБОЛНО ЗДРАВО“ ЗАТЪЛВАНЕ
Допълнително механистично разбиране за това как тази популация от хора е защитена от съпътстваща заболеваемост от затлъстяване ще бъде постигнато чрез изграждане на хипотези и тестване на животински модели. Освен примера на мишки brd2 lo, има и други, фундаментално различни видове животински модели, някои от които са предимно имунологични, докато други са насочени към мастната тъкан. Тези различни молекулярни и клетъчни смущения или недостатъци ще позволят по-прецизно механистично изследване на съответните пътища, които свързват затлъстяването с инсулиновата резистентност.
1. Нисковъзпалителните модели включват
Интерлевкин-1 рецептор 1 нокаут. Намаленият възпалителен профил, особено по-ниските нива на TNF и интерлевкин-6, изглежда предпазва тези животни от инсулинова резистентност и глюкозна непоносимост, предизвикана от високо съдържание на мазнини (McGillicuddy et al., 2011).
Индуцируем нокаут на азотен оксид синтаза (iNOS): Дефицитната поляризация на макрофагите в резултат на нокаут Nos2 предпазва от индуцирана от затлъстяване инсулинова резистентност на скелетните мускули и това е свързано с подобрена активност на фосфоинозитид 3-киназа/Akt (Perreault and Marette, 2001)
Аблация на TNF: Антителата срещу TNF подобряват инсулиновата резистентност при затлъстяване (Hotamisligil et al., 1993), а мишките с дефицит на TNF сигнализация са защитени от инсулинова резистентност при затлъстяване (Uysal et al., 1997).
TWEAK нокаут: Свързаният с TNF слаб индуктор на апоптоза (TWEAK), цитокин от суперсемейството на TNF, е важен за ремоделирането на тъканите след нараняване (Burkly et al., 2007), но също и за ремоделирането на мастната тъкан, за да се приспособи увеличеното съхранение при затлъстяване ( Li et al., 2009). Пътят TWEAK се активира при пациенти със затлъстяване от диабет тип 2 (Chacón et al., 2006). Дефицитът на TWEAK (Campbell, 2006) измества поляризацията на макрофагите към алтернативно активирания „нисковъзпалителен“ фенотип, увеличава оборота на колаген и намалява JNK активирането в мастната тъкан на гонадите, осигурявайки метаболитна защита при затлъстяване (MS Obin, Медицински факултет на Университета Туфтс, личен комуникация).
IκBα суперрепресор: Експресията в черния дроб на репресора на NF-κB сигнализиране предпазва от индуцирана с високо съдържание на мазнини диета и ниско ниво на NF-κB-индуцирана инсулинова резистентност (Cai et al., 2005).
2. Моделите на мастната тъкан включват
Нокаут за колаген 6: Повишената способност на мастните депа да реконструират и приемат увеличено съхранение при затлъстяване намалява адипоцитния стрес и апоптозата (Khan et al., 2009). Този увеличен капацитет зависи от загубата на колаген 6 и подобрява глюкозата на гладно и толерантността към глюкозата, може би чрез отпускане на физически, стерични ограничения върху мастните депа.
Трансгенен адипонектин: Тежкото затлъстяване с инсулинова резистентност на фона на ob/ob (липса на лептин) може да бъде подобрено драматично чрез трансгенна експресия на адипонектин (Kim et al., 2007), фактор, който сенсибилизира клетките към инсулиновата сигнализация.
Такива модели на мишки ще бъдат полезни за разкриване на различни видове метаболитна защита и как кръстосаните препратки могат също така да предпазват системите на органи от съпътстващи заболявания (Денис, 2010).
VI. ДЕРЕПРЕСИЯ НА ИНСУЛИНОВАТА ТРАНСКРИПЦИЯ В ОКОЛНАТА СРЕДА „BRD2 LO“
По-задълбоченото разбиране на механизмите, които контролират предаването на майката и плода на повишен риск от диабет тип 2, е от решаващо значение на този етап от епидемията от затлъстяване. Съществуват значителни доказателства, получени първоначално от проучвания на индианците от Пима, че майките с диабет тип 2 могат да предоставят повишен риск от диабет на потомството (Dabelea et al., 2000; Dabelea and Pettitt, 2001; Dabelea 2007; Dabelea et al., 2008 ). Развитието на диабет тип 2 зависи както от постепенно намаляващото метаболитно здраве на индивида със затлъстяване, тъй като инсулиновата резистентност и възпаление се увеличава, така и от напрежението върху производството на β-клетки на инсулин, което в крайна сметка води до β-клетъчна недостатъчност. Въпросът за това как епигенетичните механизми влияят на отделните, но свързани рискове за намаляване на действието на инсулина и производството на инсулин не е добре проучен.
Повишената пролиферация и диференциация на β-клетките, както и повишената транскрипция и освобождаване на инсулин от β-клетките на панкреаса in vivo, несъмнено предпазват затлъстелите brd2 lo животни от прогресия до глюкозна непоносимост и β-клетъчна недостатъчност. Островчетата нямат признаци на апоптоза или стрес, но се разширяват от ранна възраст, вероятно като ранно смущение до хомеостазата на островчета, което се дължи пряко на намаляването на Brd2, а не на инсулиновата резистентност в периферията (Wang et al., 2009).
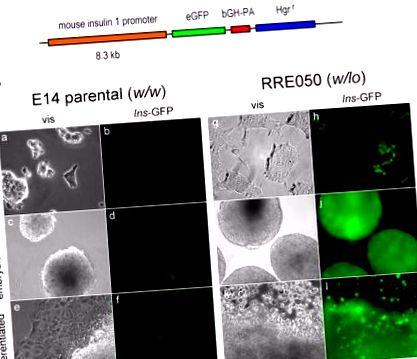
Проучихме потенциалното значение на намалената експресия на Brd2 по време на разработката. Искахме да знаем дали намалената експресия на Brd2 в ембрионалните стволови клетки с произход RRE050 или RRT234 (Wang et al., 2009) е променила биологията, свързана с енергийния метаболизъм. Въз основа на публикувани резултати от повишена транскрипция на инсулин 1 в β-клетъчни линии, ние предположихме, че транскрипцията на инсулин ще бъде потенцирана в клетките RRE050 или RRT234. Съответно, ние трансфектирахме ембрионални стволови клетки RRE050 с eGFP репортерна конструкция за промотора Ins1, получена като щедър подарък от д-р Manami Hara, след което избрахме клетките под хигромицин, както е показано на фигура 1 .
(A) Схема на миши промотор на инсулин 1, който стимулира експресията на eGFP (eGFP). Показани са и промоторни елементи: говежди растежен хормон поли А последователност (bGH-PA) и устойчивост на хигромицин (Hgr r). (Б.) Визуални (vis) и флуоресцентни (Ins-GFP) микрографии на ES клетки, трансфектирани с конструкцията в (A) и разрешени да преминат през диференциация. Недиференцираните клетки се култивират върху покрита с желатин пластмаса за тъканна култура в присъствието на левкемичен инхибиторен фактор (LIF) (недиференциран), след което LIF се изтегля, за да позволи образуването на ембриоидни тела в продължение на две седмици (ембриоидни тела) и културата продължава за допълнителни две седмици, за да се позволи допълнителна диференциация (диференцирана). Увеличаването е показано в десния край на фигурата. Родителските ES клетки (E14 родителски; w/w) бяха сравнени с Brd2 KO ES клетки (RRE050; w/lo), както е описано в Wang et al 2009, на същия етап на диференциация.
Забележително е, че този резултат показва, че намалените нива на Brd2 усилват транскрипцията на инсулиновия ген изключително рано в развитието на мишките, дори преди ембрионалните стволови клетки да загубят тотипотентни характеристики по време на дивидентификацията in vitro. Едно потенциално значение на тези данни е, че целенасоченото инхибиране на Brd2 или генетична модификация на ембрионални стволови клетки може да осигури терапевтична стратегия за β-клетъчна недостатъчност чрез регенерация на β-клетъчна маса или за генна терапия за диабет тип 1. Следователно епигенетично базирана терапия за метаболитна дисфункция е осъществима, въпреки че очевидно сега са необходими подробни механистични изследвания.
VII. ТРАНСЛАЦИОННИ ОТРАЖЕНИЯ НА ЕПИГЕНЕТИЧНОТО ПРЕГРАМИРАНЕ: ЗАКЛЮЧЕНИЯ
Освен предаването на повишен кардиометаболитен риск от майката и плода в случая на глада през зимата, други процеси с потенциален епигенетичен компонент вероятно работят при затлъстяване. Например, възстановяването на теглото след бариатрична хирургия се очертава като обезпокоителен проблем за клиницистите (Magro et al., 2008). В дългосрочен план значителна част от бариатричните пациенти (20,4% за пациенти със затлъстяване и 34,9% за пациенти със затлъстяване в едно проучване) (Christou et al., 2006) възвръщат значително тегло. За част от пациентите, при които възстановяването не е свързано с хирургическа недостатъчност, е възможно епигенетичните фактори да играят роля в затруднението при поддържане на здравословно тегло през десетгодишния период, следващ операцията. По същия начин, модификацията на диетата и начина на живот за по-малко болезнено затлъстяване също показва само смесен успех.
Благодарности
Благодарим на д-р Минами Хара от Чикагския университет за щедрия подарък от репортерска конструкция на миши инсулин-eGFP. Благодарим също на Caroline Apovian, Barbara Corkey, Barbara Nikolajczyk и Martin Obin за полезни дискусии и ценни предложения. GVD се поддържа от Националните здравни институти (R56 DK090455), Института за клинични и транслационни науки на Университета в Бостън (UL1-TR000157) и два центъра, поддържани от NIH: Центърът за изследване на диабета и ендокринологията в Бостън (P30 DK057521; PI: Джоузеф Аврух) ) и изследователския център за хранително затлъстяване в Бостън (P30 DK046200; PI: Сюзън К. Фрид). Понастоящем GVD е председател на секцията по фундаментални науки на Обществото за затлъстяване и благодари на Обществото за неговата подкрепа и насърчаване на научните взаимодействия и сътрудничества.
- BPA и затлъстяването Как тази пластмаса причинява увеличаване на теглото Хранене Здравословно хранене
- Несъвършен инструмент Спорът за това дали ИТМ е най-доброто измерване на затлъстяването - здравословен дебат
- Полиморфизмът в гена, кодиращ CART, не е свързан със затлъстяването при индианците Пима
- Можете ли да бъдете здрави и да имате затлъстяване Не наистина, казва голямо проучване
- Асоциация на два полиморфизма в и в близост до гена SOCS3 със затлъстяване при три националности в