Национален институт по сертификация - Дезволтаре за Stiinte Biologice, Букурещ, Румъния
Université des Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, UMR USTL/CNRS 8576, 59655 Villeneuve d'Ascq Cedex, Франция Търсене на още статии от този автор
Institutul de Biologie al Academiei Române, Букурещ, Румъния
Universitatea Al. I. Cuza, Facultatea de Biologie, Яш, Румъния
Институт Пастьор, Unité de Physiopathologie des Infections Lentivirales, Париж, Франция
Université des Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, Villeneuve d'Ascq, Франция
Национален институт по сертификация - Дезволтаре за Stiinte Biologice, Букурещ, Румъния
Université des Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, UMR USTL/CNRS 8576, 59655 Villeneuve d'Ascq Cedex, Франция Търсене на още статии от този автор
Institutul de Biologie al Academiei Române, Букурещ, Румъния
Universitatea Al. I. Cuza, Facultatea de Biologie, Яш, Румъния
Институт Пастьор, Unité de Physiopathologie des Infections Lentivirales, Париж, Франция
Université des Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, Villeneuve d'Ascq, Франция
Резюме
Заден план
Съобщава се за силно чувствителен, бърз и прост цитометричен анализ за оценка на жизнеността и стареенето на червените кръвни клетки (RBC).
Методи
Анализът, описан в този доклад, се основава на използването на ацетоксиметилов естер на калцеин (калцеин-AM), флуоресцеиново производно и нефлуоресцентно жизнено багрило, което пасивно преминава през клетъчната мембрана на жизнеспособни клетки и се превръща от цитозолни естерази в зелен флуоресцентен калцеин, който се задържа от клетки с непокътнати мембрани и неактивен многолекарствен резистентен протеин. Загубата на калцеин може лесно да бъде определена чрез поточна цитометрия, а цитозолната локализация на естеразите е демонстрирана чрез спектрофлуорометрични анализи.
Резултати
Открихме, че червените кръвни клетки се инкубират с Ca 2+, което предизвиква бърза и модулирана самосмърт, която споделя няколко характеристики с апоптоза (Bratosin et al., Cell Death Differ 2001; 8: 1143–1156), външен фосфатидилсерин и изгубен калцеин оцветяване и съдържание на цитозолен аденозин трифосфат. Двойното етикетиране с помощта на белязан с фикоеритрин анексин-V и калцеин-АМ показа, че намаляването на активността на естеразата е ранно събитие, което предшества екстернализирането на остатъците от фосфатидилсерин. В допълнение, този анализ ни позволи да разграничим млади и възрастни еритроцити, изолирани чрез ултрацентрифугиране в самообразуващ се градиент на Percoll и може да се счита за надежден маркер за стареене на еритроцитите.
Заключения
Пионер в ранните трудове на Brunning et al. (1) са описани многобройни методи, използващи флуоресцентни багрила за измерване на клетъчната жизнеспособност и цитотоксичност и броят на тези сонди непрекъснато се увеличава (2). Сред използваните от нас багрила ацетоксиметилдиацетилестерът на калцеина (калцеин-AM), производно на флуоресцеина, се откроява като първият показател за жизнеспособност на клетките и клетъчна цитотоксичност поради превъзходното си запазване на клетките и относителната нечувствителност на флуоресценцията му към рН в физиологичен обхват (2, 3). Калцеин-АМ е силно липофилно жизнено багрило, което бързо навлиза в жизнеспособни клетки, преобразува се от вътреклетъчни естерази в калцеин, който произвежда интензивен зелен (530 nm) сигнал (3) и се задържа от клетки с непокътната плазмена мембрана. От умиращи или повредени клетки с нарушена цялост на мембраната или от клетки, експресиращи протеин с много лекарствена устойчивост (MRP) (4, 5), нехидролизираните субстрати и техните флуоресцентни продукти бързо се екструдират от клетките. През последното десетилетие анализът с калцеин-AM замени конвенционалния метод за освобождаване на 51 Cr за оценка на жизнеспособността на клетките (6-12) и цитотоксичността (13-18) и се прилага за количествено определяне на апоптозата (19-24).
Появата на MRP в мембраната на човешките червени кръвни клетки (RBC), демонстрирана от Pulaski et al. (25) прави тази клетка потенциално полезна при изучаване на функцията на MRP и ефективността на потенциалните MRP инхибитори. За проследяване на изтичащата активност на MRP човешки еритроцити многобройни изследователи са използвали флуоресцентни сонди, сред които флуоресцеинови производни като 2, ′ 7 ′ ′ -бис- (карбоксипропил) ‐5/6 карбоксифлуоресцеин, ацетоксиметилов естер (26), 2 ′, 7 ′ ′ бис- (карбоксиетил) ‐5/6 ‐ карбоксифлуоресцеин или калцеин-AM (27). Доколкото ни е известно, анализът на калцеин-AM не е докладван за оценка на жизнеспособността на червените кръвни клетки.
Наскоро ние и други (28-30) съобщихме, че зрелите човешки еритроцити могат да претърпят бърз процес на самоунищожение, който споделя няколко характеристики на апоптозата, включително свиване на клетките, везикулизация на плазмената мембрана, екстернализация на фосфатидилсерин, възможно разпадане на червените кръвни клетки или в присъствието на макрофаги, фагоцитоза на тези умиращи еритроцити. Тъй като тази регулирана форма на програмирана клетъчна смърт може да бъде предизвикана и модулирана от приток на Са 2+, ние изследвахме дали анализът на калцеин-AM може да се използва за определяне на жизнеспособността на червените кръвни клетки.
В настоящата статия ние описваме бърз и чувствителен анализ на калцеин-AM за поточно цитометрично определяне на жизнеспособността на човешките червени кръвни клетки.
МАТЕРИАЛИ И МЕТОДИ
Химикали
Флуорогенното багрило калцеин-AM, човешки серумен албумин, фенилметилсулфонил флуорид, натриев азид, сапонин и аденозин 5 ′ -трифосфатен комплект са закупени от Sigma-Aldrich (Сейнт Луис, МО, САЩ), конюгирано приложение на фикоеритрин-V (PE ‐Annexin-V) и буфер HEPES са получени от Pharmingen (Сан Диего, Калифорния, САЩ), йонофор A 23187 от Streptomyces chartreusis е получена от Calbiochem (La Jolla, CA, USA) и Percoll от Pharmacia-Biotech AB (Uppsala, Швеция).
Кръвни проби
Еритроцитите на човешката кръвна група O Rh +, събрани в хепарин, са любезно доставени от Etablissement Régional de Transfusion Sanguine de Lille, Франция. След центрофугиране на кръвта (2000ж при 4 ° С в продължение на 5 минути), плазмата, тромбоцитите и левкоцитите се отстраняват чрез пипетиране и еритроцитите се промиват три пъти в буфериран солен разтвор на Dulbecco с фосфатен буфер (PBS; pH 7.4; 137 mM NaCl, 2.7 mM KCl, 8.1 mM Na2HPO4, и 1.5 mM KH2PO4). Еритроцитите бяха ресуспендирани (10 7 клетки/ml) в HEPES буфер (10 mM HEPES и 140 mM NaCl), рН 7.4, допълнени с 0.1% човешки серумен албумин при отсъствие или присъствие на Ca 2+ (2.5 mM CaCl2) и йонофор А 23187 (0,5 μM), както е описано по-рано (28), и се инкубира при 37 ° C в продължение на 3 и 20 h под 5% атмосфера на CO2. Млади и стари еритроцити се разделят чрез ултрацентрифугиране на кръв в самообразуващ се градиент на Percoll съгласно процедурата на Lutz et al. (31) модифициран, както е описано по-рано (32). И двете фракции се измиват три пъти с PBS буфер, рН 7,4, съдържащ 0,2 М фенилметилсулфонил хлорид и наскоро се концентрират в същия градиент на Percoll.
Поточен цитометричен анализ
Проточни цитометрични анализи бяха извършени на FACScalibur цитометър (Becton Dickinson, Сан Хосе, Калифорния, САЩ), като се използва софтуер CellQuest за придобиване и анализ. Каналите за разсейване на светлината са настроени на линейни коефициенти на усилване, а флуоресцентните канали са зададени в логаритмична скала, като при всяко условие се анализират минимум 10 000 клетки.
Поточен цитометричен анализ на субпопулациите на червените кръвни клетки с помощта на измервания на разсейване на светлината
Вариациите на размера и плътността на еритроцитите се оценяват, като се използват разсейки напред и странично ъгъл (FSC срещу SSC) в изотоничен PBS буфер, рН 7,4, осмоларност 320 до 330 mosmol/kg, според Bratosin et al. (32).
Поточен цитометричен анализ на жизнеспособността на клетките с помощта на Calcein-AM
PE-Анексин-V и Калцеин-АМ с двойно маркиране на поточен цитометричен анализ
Еритроцитите първо се инкубират (37 ° С в продължение на 45 минути) с калцеин-AM (0.5 μM), както е описано по-горе. След това клетките бяха изолирани чрез центрофугиране (2000ж при 4 ° C в продължение на 5 минути), ресуспендира се в 100 μl HEPES свързващ буфер, рН 7,4, съдържащ 2,5 mM калциев хлорид и се инкубира с 10 μl PE-анексин-V за 15 минути при стайна температура на тъмно. След добавяне на 400 μl свързващ буфер, клетките бяха анализирани за бипараметрични хистограми FL1 (калцеин) срещу FL2 (PE-анексин-V). Експериментите бяха проведени в три екземпляра.
Флуорометрично измерване на активността на цитозолната естераза
Извършени са два вида измервания на активността на цитозолната естераза. При първия тип еритроцитите бяха предварително обработени (37 ° С в продължение на 45 минути) с калцеин-AM (крайна концентрация: 5 μM), както е описано по-горе, и суспензия от 10 6 еритроцити беше хемолизирана с 300 μl студена вода чрез разбъркване с Vortex за няколко минути. След отстраняване на клетъчните мембрани чрез ултрацентрифугиране (10 000ж при 4 ° C в продължение на 20 минути) интензитетът на флуоресценция на цитозола се определя с помощта на Microplate Fluorescence Reader FL × 800 (Bio-Tek Instruments, Winooski, VT, USA) с програма KC Junior при следните условия: 485 nm възбуждане, 528 nm излъчване, 20 честотна лента и 100% чувствителност. Резултатите бяха изразени като „средно ниво на флуоресцентни единици“. Заготовките бяха изследвани при същите условия при липса на калцеин-AM.
При втория вид измерване цитозолната фракция се приготвя чрез разбъркване на 500 μl еритроцити в 1 ml студена вода и клетъчните мембрани се отстраняват от лизата чрез ултрацентрифугиране (10 000ж при 4 ° С за 20 минути). Към 250 μl супернатант се добавят 15 μl от работния разтвор на 100 μM калцеин-AM в 96-ямкови пластмасови черни микротитърни плаки (Nunc, Naperville, IL, USA) и сместа се поддържа при 37 ° C за различни времеви точки (0 до 50 минути на интервали от 5 минути). Заготовките бяха изследвани при същите условия в отсъствието на калцеин-AM и интензитетът на флуоресценцията беше определен с помощта на Microplate Fluorescence Reader FL × 800, както е описано по-горе. Всички експерименти бяха проведени най-малко три пъти с по три повторения всеки път.
Определяне на нивото на аденозин трифосфат в червените кръвни клетки
Нивото на аденозин трифосфат (АТФ) беше определено с помощта на комплект аденозин 5 ′ ′ трифосфат на Sigma-Aldrich и изразено в микромоли на АТФ на децилитър кръв. Експериментите бяха проведени в три екземпляра.
РЕЗУЛТАТИ
Влияние на времето за инкубация върху ефективността на етикетирането с помощта на Calcein-AM
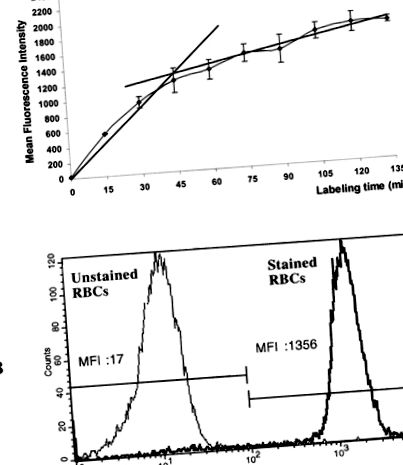
Както е показано на Фигура 1А, белязаните с калцеин-АМ еритроцити и скоростта на хидролиза на калцеин-АМ от естеризи на RBC бързо се увеличават в рамките на 45 минути след инкубацията. След това средната интензивност на флуоресценция не се е увеличила значително, може би поради съпътстващото спонтанно освобождаване на калцеин в резултат на проникването на клетъчната мембрана по време на дълги периоди на инкубация. Въз основа на наклона на оцветяване с калцеин-AM, ние приехме време за инкубация от 45 минути. Фигура 1В показва, че при тези експериментални условия областите на неоцветени и оцветени еритроцити са ясно определени.
Поточен цитометричен анализ на RBC естеразната активност. A: Ефект на времето на инкубация върху цитозолната активност на червените кръвни клетки спрямо калцеин-AM. Прясно изолираните еритроцити се инкубират при 37 ° C в присъствието на 5 μM калцеин-АМ и се извършва поточен цитометричен анализ в различни моменти от време. Данните са изразени като средна интензивност на флуоресценция ± стандартно отклонение от три независими експеримента. Б: Наслагване (единичен параметър) на поточен цитометричен анализ на клетъчната естеразна активност на човешките еритроцити, инкубирани в присъствието на 5 μM калцеин-AM за 0 минути (неоцветени еритроцити) и 45 минути (оцветени еритроцити). Средните стойности на флуоресценцията са изразени като MFI. Абциси: интензивност на зелена флуоресценция в мащаб (FL1). Ординати: относителен номер на клетката. Брой преброени клетки: 10 000. Представените резултати са от един представителен експеримент от три извършени.
Анализът на Calcein-AM е специфичен за естеразната активност на RBC Cytosol
За да се демонстрира, че анализът на калцеин-АМ е специфичен за цитозола, а не за мембранните естерази като ацетилхолинестераза, извънклетъчен ензим от човешки еритроцити, чиято активност значително намалява със стареенето на еритроцитите (34), калцеин-АМ е добавен към цитозолната фракция на еритроцитите, лишени от на плазмените мембрани. Както е показано на фигура 2А, спектрофлуорометричният анализ, използвайки флуоресцентен четец на Microplate, демонстрира недвусмислено, че RBC цитозолът съдържа активни естерази и че платото се достига за по-малко от 30 минути поради липсата на мембранната бариера.
Флуорометрично измерване на естеразната активност в цитозолната фракция на човешките еритроцити с помощта на микроплатфлуоресцентен четец. A: Кинетика на активността на естеразата: прясно изолирани човешки еритроцити се хемолизират и след отстраняване на мембраните чрез ултрацентрифугиране цитозолната фракция се инкубира при 37 ° C в присъствието на 5 μM калцеин-AM и нейната флуоресценция се определя в различни времеви точки, както е описано в Материали и методи. Данните представляват средно ± стандартно отклонение на три независими експеримента. Б: Интензивност на флуоресценция на цитозола на човешките еритроцити, които са били предварително инкубирани (37 ° C в продължение на 45 минути) с калцеин-AM преди лизиране. Получената цитозолна фракция от три различни донора беше анализирана и данните представляват средно ± стандартно отклонение на три независими експеримента.
Този резултат се потвърждава от интензивността на флуоресценцията, измерена с флуоресцентен четец на Microplate върху цитозолните фракции на еритроцитите, предварително инкубирани (37 ° C за 45 минути) с калцеин-AM (5 μM) преди лизиране. Както е показано на Фигура 2В, три отделни експеримента, проведени всеки в три екземпляра с еритроцити от три различни донора, показват интензивна флуоресценция, която варира при отделните индивиди.
Изследване на Calcein-AM за човешка еритроцитна мембранна цялост
За да се оцени дали анализът на калцеин-АМ би бил подходящ за тестване на мембранна пермеабилизация като контрол на клетъчната смърт, ние лекувахме червените кръвни клетки в отсъствие или присъствие на сапонин. Фигура 3 показва загуба на флуоресценция на калцеин в третирани с сапонин еритроцити (средна интензивност на флуоресценция [MFI]: 25) в сравнение с нелекувани еритроцити (MFI: 1418). Този резултат ни позволи да заключим, че неоцветената област на хистограмата представлява мъртвите или умиращите клетки с повредени мембрани, като по този начин обяснява освобождаването на калцеинова флуоресценция.
Проточен цитометричен анализ на човешки еритроцити, третирани със сапонин. Наслагване (единичен параметър) на поточен цитометричен анализ на оцветяване с калцеин-AM на нетретирани и третирани със сапонин човешки еритроцити. MFI: флуоресцентни средни стойности, изразени като средна интензивност на флуоресценция. Абсциси: интензитет на зелената флуоресценция в мащаб (FL1). Ординати: относителен номер на клетката. Брой преброени клетки: 10 000. Резултатите са от един представителен експеримент от трима извършени.
Calcein-AM като маркер за жизнеспособност на човешките червени кръвни клетки
Анализ на Calcein-AM като маркер за стареене на човешките червени кръвни клетки
След това оценихме дали този анализ може да се използва за разграничаване на млади от стари червени кръвни клетки, изолирани чрез ултрацентрифугиране на прясно събрана човешка кръв в самообразуващ се градиент на Percoll (31). Този метод осигурява високо обогатени популации от млади и стари еритроцити с малко замърсителни клетки. Процентът на изолирани клетки се оценява на 1,0 ± 0,2% и за двете популации. Тези стойности са подобни на тези, получени от Sorette et al. (38) и Bratosin et al. (32).
Както е показано на Фигура 5А, флуоресценцията на калцеин в старите еритроцити е по-ниска от тази при младите еритроцити поради намалената естеразна активност. По същия начин наблюдавахме добра корелация със съдържанието на АТФ, което беше по-ниско при старите еритроцити, отколкото при младите (фиг. 5В). Както е показано на Фигура 4В, намалената интензивност на флуоресценция на калцеин на старите еритроцити не е свързана с оцветяване с анексин-V (данните не са показани), което предполага, че намалената активност на естеразата предшества излагането на фосфатидилсерин. Както се съобщава от Bratosin et al. (35), само застарелите еритроцити, които са фагоцитирани от макрофаги, реагират с анексин-V. Това откритие показва, както по-рано беше съобщено от Gatti et al. (20) като се използват прилепнали клетъчни линии PC12 и NIH3T3, че анексин-V може да е по-малко чувствителен от калцеин-АМ за ранно откриване на апоптоза. Тези резултати ни карат да предположим, че анализът на калцеин-AM може да се използва като маркер за стареене на човешките червени кръвни клетки.
A: Наслояване (единичен параметър) на поточен цитометричен анализ на клетъчната естеразна активност на млади (Y) и стари (O) човешки еритроцити, изолирани чрез ултрацентрифугиране в Percoll самообразуващ се градиент, съгласно метода на Lutz et al. (31), изменен от Bratosin et al. (32). Числата представляват средни стойности на флуоресценция (MFI). Абсциси: интензитет на зелената флуоресценция в мащаб (FL1). Ординати: относителен номер на клетката. Брой преброени клетки: 10 000. Представените резултати са от един представителен експеримент от четири проведени. Б: Еволюция на съдържанието на АТФ в млади (Y) и стари (O) еритроцити. Данните представляват средно ± стандартно отклонение на три независими експеримента.
ДИСКУСИЯ
Безопасният и чувствителен анализ на калцеин-АМ, който разработихме, може да представлява ценен тест за стареене и жизнеспособност на червените кръвни клетки, съхранявани в кръвни банки. В това отношение е интересно да се обърнем към статия, публикувана от Beutler (40), озаглавена „Назад към бъдещето в опазването на червените кръвни клетки“, която е посветена на страхотния проблем с удължаването на времето, през което червените кръвни клетки могат да се съхраняват в течно състояние. Бойтлер пише: „Напредъкът е бавен по редица причини. На първо място, фундаменталният характер на лезията за съхранение остава неизвестен. Второ, никога не е открит добър заместващ тест за извършване на проучвания за жизнеспособност при доброволци. " Анализът на калцеин-AM, който описахме, може да допринесе за решаването на втория проблем, предизвикан от Beutler.
Благодарности
Даниела Братосин и Лора Митрофан са стипендианти на MacoPharma Co. (Tourcoing, Франция), а Carmen Palii е член на френското посолство в Румъния и на MacoPharma Co. Авторите са благодарни на д-р Жан-Жак Хуарт (директор на регионалния регион Etablissement de Transfusion Sanguine de Lille), Франсис Гудалиес (директор на MacoPharma Co.) и Hervé Dubly (председател на MacoPharma Co.), които предоставиха любезен интерес и финансова подкрепа за този проект. Дължим на съдиите за техните коментари и критики, които ни помогнаха да подобрим доклада.
- Некротизиращо намаляване на ентероколита с помощта на ексклузивна диета с човешко мляко и пробиотик
- Новото лекарство Amooranin индуцира апоптоза чрез активност на каспаза в клетката на карцинома на човешката гърда
- Палео актуализация; Преглед на документалния филм „Перфектната човешка диета“ от Стефани Шимердла Medium
- Нов специфичен за пола индекс на висцерална затлъстяване за мексиканското педиатрично население - ScienceDirect
- Нов подход за перфорация на пептична язва - Ahmadinejad - 2020 - Доклади за клинични случаи -