Тереза Ермер
1 Катедра по нефрология и хипертония, Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Erlangen, Германия
Кай-Уве Еккард
1 Катедра по нефрология и хипертония, Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Erlangen, Германия
Питър С. Аронсън
2 Катедра по вътрешни болести, Медицински факултет на Йейлския университет, Ню Хейвън, Кънектикът, САЩ
Феликс Кнауф
1 Катедра по нефрология и хипертония, Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Erlangen, Германия
2 Катедра по вътрешни болести, Медицински факултет на Йейлския университет, Ню Хейвън, Кънектикът, САЩ
Резюме
Цел на прегледа
Оксалатът е краен продукт на метаболизма, екскретиран през бъбреците. Излишъкът на оксалат в урината, независимо дали е от първична или ентерична хипероксалурия, може да доведе до отлагане на оксалат в бъбреците. Оксалатните кристали са свързани с бъбречно възпаление, фиброза и прогресираща бъбречна недостатъчност. Отдавна е известно, че тъй като скоростта на гломерулна филтрация (GFR) намалява при хронично бъбречно заболяване (ХБН), има поразително повишаване на плазмения оксалат. Взети заедно, тези открития повишават възможността повишаването на плазмения оксалат при ХБН да стимулира бъбречно възпаление и по-бързо прогресиране на ХБН независимо от първичната етиология.
Последни открития
Наскоро бе установено, че инфламазомата играе критична роля при индуцираното от оксалатите бъбречно възпаление. Доказано е, че оксалатните кристали активират свързващия нуклеотид домейн, богат на левцин повторен инфламазома 3 (известен също като NALP3, NLRP3 или криопирин), което води до освобождаване на Интерлевкин-1β и инфилтрация на макрофаги. Делецията на инфламазомни протеини при мишки предпазва от индуцирано от оксалати бъбречно възпаление и прогресираща бъбречна недостатъчност.
Обобщение
Констатациите, разгледани в тази статия, разширяват нашето разбиране за значението на повишените нива на плазмен оксалат, водещи до активиране на инфламазома. Предлагаме, че инхибирането на индуцираното от оксалат активиране на инфламазома или понижаването на плазмения оксалат може да предотврати или смекчи прогресиращо бъбречно увреждане при ХБН и гарантира клинични изпитвания.
Въведение
Оксаловата киселина е потенциално токсична дикарбоксилна киселина, която не се метаболизира допълнително от бозайници [1, 2, 3, 4, 5]. В своята йонизирана форма - оксалат - той образува силно неразтворими комплекси с калций [1, 2]. Когато оксалатната хомеостаза е нарушена, оксалатът се натрупва в различни телесни тъкани и уврежда предимно бъбрека, който служи като основен отделителен орган. Това от своя страна води до допълнителни повишения на плазмените нива на оксалат. Последните проучвания насочват вниманието към оксалата като активатор на възпалителните пътища. По този начин, този преглед има за цел да даде импулс за по-нататъшно изследване на важната роля на оксалат в активирането на възпалителния мозък и прогресията на бъбречното заболяване.
Оксалат - ендогенно производство
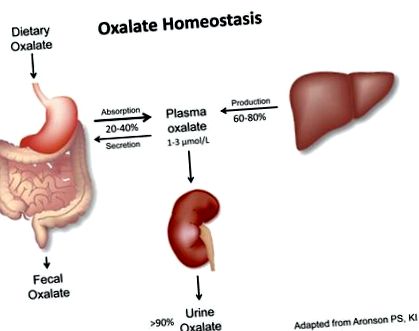
О: Оксалатна хомеостаза се определя от приноса на диетата (20–40%) и ендогенния оксалат (60–80%) към плазмената концентрация на оксалат (норма: 1–3 μmol/L), която се поддържа ниска с> 90% от плазмения оксалат, екскретиран от бъбрек (нормално: 0,1–0,45 mmol/d). Б: Хипероксалурия се дефинира чрез екскреция на оксалат в урината> 0,45–0,5 mmol/d и може да възникне в резултат на ендогенно свръхпродукция (първично) или екзогенно свръхпредлагане (вторично). C: Оксалатна хомеостаза при ХБН е нарушен вследствие на намален бъбречен клирънс на оксалат, което води до повишени нива на плазмен оксалат.
Оксалат - екзогенно снабдяване
Хипероксалурия - нарушена оксалатна хомеостаза
Оксалатът се екскретира главно чрез бъбреците [3, 50]. Няколко проучвания демонстрират почти пълно възстановяване на радиоактивно белязан оксалат в урината след инфузия на здрави индивиди или като хранителен товар [3, 28]. В допълнение към гломерулната филтрация, има нетна тубулна секреция на оксалат [51, 52, 53], главно в проксималния канал, въпреки че има доказателства и за транспортиране на оксалати в събиране на канал и папиларни клетки [54, 55]. Общата дневна екскреция на оксалат през бъбреците се оценява на 10-40 mg на 24 часа (0,1–0,45 mmol на 24 часа) при здрави деца и възрастни, като средната екскреция е малко по-висока при мъжете, отколкото при жените [34, 37, 56, 57, 58]. Само малка част се елиминира през стомашно-чревния тракт [6]. Marengo et al. съобщава за екскреция на фекален оксалат, за да представлява само 5-7% от оксалата, прилаган при плъхове, лекувани с подкожно имплантирани минипомпи [37].
Индуцирано от оксалат възпалително активиране
Два различни сигнала (сигнал 1 и сигнал 2) са необходими за активиране на инфламазома и каспаза-1: Сигнал 1, първоначален сигнал, се осигурява главно от TLR лиганди, като LPS. Сигнал 2 е активиращ сигнал. Разнообразие от стимулиращи PAMPs или DAMPs, които вероятно се освобождават вторично спрямо оксалатните кристали, могат да предизвикат сигнал 2 по един от трите механизма: 1) йонен поток: калий, калций или протони 2) генериране на ROS [3) лизозомна руптура, предизвикана от поглъщане на кристални агрегирани материали (не е показано). Активирането на NLRP3 с възпаление води до обработка и освобождаване на IL-1β и IL-18, които комуникират главно с възпалителни клетки (съседна клетка) чрез IL-1 рецептора. Разработени са няколко фармакологични подхода, насочени към Сигнал 1, Сигнал 2, възпалителен възел, цитокини и съответните им рецептори, както е описано подробно в основната част на текста. * Точната цел не е идентифицирана. Глибуридът действа надолу по веригата на Р2Х7 АТР рецептора и след криопирина.
Оксалат и ХБН
При първичните хипероксалурии неограниченото свръхпроизводство на оксалати причинява чисто пренасищане на CaOx в плазмата чрез превишаване на границата на оксалоза> 30 μmol/L (βCaOx> 1) [109, 110, 111] и екстремна екскреция в урината между 1–2 mmol/1,73 m 2 за 24 часа [112]. При ентеричната хипероксалурия високата абсорбция на оксалати често се свързва с изчерпване на обема, предизвикано от диария, метаболитна ацидоза и хипоцитратурия, осигурявайки благоприятни условия за натрупване на оксалати и утаяване в бъбречната тъкан [5, 7, 65]. Пациентите с PH обикновено бързо преминават към ХБН: средната възраст при появата на ESRD при пациенти с PH1 е 24–27 години. 70% от възрастните и 29% от децата са в бъбречна недостатъчност още по време на диагностицирането [62, 112]. При вторична хипероксалурия прогресията до остро или хронично бъбречно заболяване се съобщава по-рядко - вероятно отчасти, защото е недостатъчно призната. Glew et al. наскоро предостави обширен преглед на нефропатията, произтичаща от ентерична хипероксалурия [5]. Следователно, както първичната, така и вторичната хипероксалурия предоставят „принципно доказателство“, че повишеният плазмен оксалат може да доведе до прогресивна ХБН при хората.
Заключение
Прогресираща бъбречна недостатъчност и ранна смъртност поради неблагоприятни сърдечно-съдови резултати правят ХБН много сериозно заболяване. Оксалатът участва силно в възпалителните пътища, което го прави основен кандидат да допринесе за прогресирането на ХБН и системното възпаление. В животински модели членовете на нашата и други изследователски групи са разкрили част от сложното взаимодействие между оксалат, активиране на инфламазома и прогресиране на бъбречно заболяване. Съответно, инхибирането на индуцираното от оксалат активиране на възпалението или понижаването на плазмения оксалат може да предотврати или смекчи прогресиращото бъбречно увреждане при ХБН, а също така да намали заболеваемостта и смъртността поради системно възпаление. Възможно е някои от новите противовъзпалителни лекарства, представени в този преглед, да предоставят нови терапевтични възможности утре за пациенти с първична или вторична хипероксалурия или ХБН като цяло.
Ключови точки
Оксалатът може да се натрупва в резултат на ендогенно свръхпродукция (първична хипероксалурия), екзогенно свръхпредлагане (вторична хипероксалурия) или намаляване на бъбречния клирънс (намаляващ GFR при ХБН).
Първичната хипероксалурия доказва принципа, че излишъкът от плазмен оксалат може да доведе до ХБН.
Оксалатът е мощен активатор на NLRP3-инфламазома, който медиира възпалението при миши модели на индуцирана от оксалат ХБН.
NLRP3-нокаутите са защитени от индуцирано от оксалати прогресивно бъбречно заболяване.
Новите NLRP3- и IL-1-инхибитори могат да бъдат обещаващи терапевтични възможности за утре за първична или вторична хипероксалурия или ХБН като цяло, за да се предотврати прогресивна загуба на бъбречна функция и системни възпалителни усложнения на ХБН.
- Провъзпалителна диета, свързана с по-висок риск от прогресия на бъбречните заболявания
- Забавяне на прогресията на бъбречната болест - DaVita
- Значение на диетата при хронично бъбречно заболяване
- Оптимално хранене при бъбречнокаменна болест - ScienceDirect
- Бременност и бъбречни заболявания - Американски бъбречен фонд (AKF)