Резюме
Въведение
Наскоро цинкът е признат за важен фактор, необходим за завършване на мейозата и активирането на яйцеклетката in vitro (Bernhardt et al., 2011; Kim et al., 2010; Kong et al., 2012; Suzuki et al., 2010b; Tian and Diaz, 2012) и за руптура на фоликула и завършване на мейозата in vivo (Tian and Diaz, 2012). Многобройни проучвания показват, че недостигът на цинк по време на бременност причинява ненормално развитие на ембриона и плода и лошо здраве на потомството (Apgar, 1985; Keen et al., 2003; Uriu-Adams and Keen, 2010). В други тъкани дефицитът на цинк намалява хистоновото и ДНК метилиране (Breksa III и Garrow, 2002; Wallwork и Duerre, 1985). Обаче последиците от изчерпването на цинка през последния период на оогенеза върху метилирането на хроматин, оплождането и развитието преди имплантацията не са изследвани. По този начин, като се има предвид, че: 1) дефицитът на цинк намалява метилирането на хроматина в други тъкани и 2) метилирането на хроматина се увеличава в ооцита по време на антралното фоликуларно развитие, ние предполагаме, че недостигът на цинк в предубеждението ще намали метилирането и увреждането на хроматина (ДНК и хистон) торене и предимплантационно развитие. Констатациите предоставят доказателства в подкрепа на тази хипотеза и установяват периода на окончателен растеж на ооцитите като критичен преход в епигенетичното програмиране на ооцитите, който е чувствителен към смущения в хомеостазата на цинка в цялото тяло.
Материали и методи
Животински модел на недостиг на цинк
Женски мишки CD1 (Mus musculus) са получени от изследователската колония на изследователите. За да се изследват ефектите на острия in vivo дефицит на цинк преди овулацията върху епигенетичното програмиране на яйчниците и ембрионалното развитие, новоотгледаните 18-дневни мишки бяха настанени на решетъчни дънни стелажи в поликарбонатни клетки и им беше дадена контролна диета (29 mg цинк/kg) на база AIN76 (MP Biomedicals, Solon, OH) или диета с недостиг на цинк (ZDD), която е същата диета като контрола с цинк, пропуснат от минералната смес (6/ml), събрана от опашката на епидидима на фертилен мъж. Използваната среда беше MEM с 3 mg/ml BSA, както е описано по-рано (O'Brien et al., 2003). Комплексите се инкубират в продължение на 5 часа, измиват се от излишните сперматозоиди и се култивират още 20 часа (общо 24 часа). В края на културата делът на 2-клетъчните ембриони се определя като мярка за оплождане. Пронуклеарни стадии на ембриони са събрани 8 часа след оплождането in vitro. Животните се отглеждат в съответствие с Ръководството за грижа и употреба на лабораторни животни (Институт за обучение и изследвания на животните). Цялата употреба на животни е била прегледана и одобрена от комитета на IACUC към държавния университет в Пенсилвания.
Имунофлуоресценция
Изолиране на обща РНК и qPCR
Общата РНК е изолирана от 40-50 ооцити и 10 бластоцисти, като се използват съответно РНК-микро или мини комплекти (Qiagen, Валенсия, Калифорния). Общата РНК се транскрибира обратно в cDNA, както е описано по-рано (Diaz et al., 2006), използвайки Quantitek cDNA комплект за синтез (Qiagen, Валенсия, Калифорния). Количественото определяне на Gdf9, Bmp15, Figla, Zp3, Nobox, Igf2, H19, Ddx4, Nr4a1 и Pou5f1 mRNAs беше проведено с използване на генно специфични праймери (Таблица 1) и Rpl19 mRNA като нормализатор, както е описано по-горе (Livak and Schmittgen, 2001; Tian и Диас, 2012). Само един продукт с подходящ размер е идентифициран за всеки набор от праймери и всички продукти на амплификация са секвенирани, за да се потвърди специфичността. Праймерите за повтарящи се елементи (Iap, Line1, Sneb1, Sineb2 и Mt) бяха валидирани по-рано (Su et al., 2012). Експериментите бяха повторени 3-5 пъти и показаните стойности са средната стойност ± SEM.
маса 1
Последователности на грундове, използвани за qPCR.
| Igf2 | AGGGGAGCTTGTTGACACG | GGGTATCTGGGGAAGTCGTC |
| Н19 | CATGTCTGGGCCTTTGAA | TTGGCTCCAGGATGATGT |
| Ddx4 | CCCATTGTATTAGCAGGACGA | GCGACTGGCAGTTATTCCAT |
| Nr4a1 | CACAGCTTGGGTGTTGATGT | GCTCCTTCAGACAGCTAGCAA |
| Gdf9 | CTACAATACCGTCCGGCTCT | CAAGTGTTCCATGGCAGTCA |
| Bmp15 | ACACAGTAAGGCCTCCCAGA | GATGAAGTTGATGGCGGTAAA |
| Фигла | ACAGAGCAGGAAGCCCGTA | GTCAGAGGGTCTGCCACTGT |
| Nobox | AGGGACGTTCCTGGCAGT | GCTGCTTGCTTGGTAGTCCT |
| Iap | ACAAGAAAAGAAGCCCGTGA | GCCAGAACATGTGTCAATGG |
| Линия1 | GAGACATAACAACAGATCCTGA | AACTTTGGTACCTGGTATCTG |
| Sineb1 | GTGGCGCACGCCTTTAATC | GACAGGGTTTCTCTGTGTAG |
| Sineb2 | GAGATGGCTCAGTGGTTAAG | CTGTCTTCAGACACTCCAG |
| Mt | TGTTAAGAGCTCTGTCGGATGTTG | ACTGATTCTTCAGTCCCAGCTAAC |
| Rpl19 | TTCAAAAACAAGCGCATCCT | CTTTCGTGCTTCCTTGGTCT |
Статистически анализ
Резултатите от скоростта на овулация, броя на 2-клетъчните стадии на ембриони, бластоцистите и qPCR бяха анализирани или чрез t-тест на студент, или от двупосочен ANOVA, последван от post hoc тест на Tukey's HSD, ако беше открит положителен F тест. Пропорционалните данни бяха трансформирани (арксинус) преди анализ. За анализи са използвани софтуерът за статистически анализ JMP 7.1 (SAS, Cary, NC) и Microsoft Excel.
Резултати
Недостигът на цинк причинява епигенетични дефекти в ооцитите
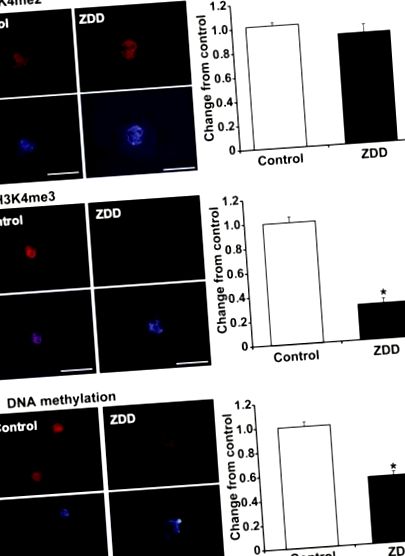
За да установим, че епигенетичното програмиране на яйцеклетките се променя в оцитите с дефицит на цинк, използвахме оцветяване с имунофлуоресценция и измервания на интензивността на ядрената флуоресценция в ооцити от GV-етап от контролни животни и животни с дефицит на цинк, за да измерим разликите в метилирането на хроматин. Диметилирането на H3K4 не се променя при 5-дневно лечение с диета с дефицит на цинк (Фигура 1А). Въпреки това, се наблюдава малко или никакво оцветяване за триметилиран хистон H3K4 в оцити с дефицит на цинк (Фигура 1В). За да се определи дали ДНК метилирането може да бъде повлияно и от недостиг на цинк, антитяло срещу 5-метилцитозин (5-MeC) е използвано за откриване на глобално ДНК метилиране. Изненадващо, метилирането на ДНК също беше драстично намалено в ооцитите с дефицит на цинк в сравнение с контролните ооцити (Фигура 1С).
Представителни изображения и интензивност на ядрената флуоресценция на хистон H3K4 диметилиране (H3K4me2) (A), хистон H3K4 триметилиране (H3K4me3) (B) и ДНК метилиране (C) в GV стадийни ооцити от животни, получаващи контрол или диета с дефицит на цинк (ZDD) за 5 дни. Червено = метилиран хистон или 5-метилцитозин, синьо = ДНК (DAPI). * P Фигура 2А) в ооцити с дефицит на цинк. Концентрацията на Bmp15 и Nobox mRNA не се променя поради недостиг на цинк в ооцитите. За разлика от това имаше значително увеличение на концентрациите на стенограмите за различни повтарящи се елементи. Iap транскриптите се увеличиха повече от 20 пъти, докато Line1, Sineb1 и Sineb2 транскриптите се увеличиха 2-3 пъти в оцитите с дефицит на цинк. За разлика от това, Mt транскриптите не се различават в оцитите с дефицит на цинк в сравнение с контролите (Фигура 2Б).
А. Относителна (гъвкава промяна) концентрация на специфични за ооцитите транскрипти (Gdf9, Bmp15, Zp3, Figla и Nobox) в контролните и ZDD ооцитите. (B) Относителна (кратна промяна) концентрация на повтарящи се елементи (Iap, Line1, Sineb1, Sineb2 и MT) (B) в контролни и ZDD ооцити. * P Фигура 3А). Скоростта на оплождане (делът на зрелите яйцеклетки, които преминават към 2-клетъчния стадий) е драстично намалена в групата на ZDD от 70% на 52% в групата с 3-дневно лечение и от 83% на 8% в групата с 5-дневно лечение (Фигура 3B-D). Драматичният срив в скоростта на оплождане след 5-дневно лечение с дефицит на цинк в оплодени яйца е причинен от невъзможност за достигане до метафаза II (без полярно тяло, 79%) или от неуспех на сливането на пронуклеуса (налични пронуклеуси, 21%) (Фигура 3Е -F).
Представителни изображения на флуоресцентно имунооцветяване за триметилиране на хистон H3K4 8 часа след ин витро оплождане на овулирани яйцеклетки от животни, получаващи контролна или цинководефицитна диета (ZDD) в продължение на 5 дни. (N = 3, 10–20 ооцити/реплика). Червено = триметилиран хистон, синьо = ДНК (DAPI), зелено = актин. Мащабна лента = 50 µm.
In vivo оплождането и развитието на бластоцисти се нарушават от недостиг на цинков дефицит
Пропорция на 2-клетъчни ембриони (A), представителни изображения (B) на ембриони, възстановени на ден 1,5 от бременността от животни, получаващи контролна диета или дефицит на цинк в продължение на 5 дни. Пропорция на бластоцистните ембриони (C) и представителни изображения (D) на 2-клетъчни ембриони в панел А, култивирани в продължение на 3 дни в среда на KSOM. * Значително от t-теста на студента, P -ddct метод. * Значителна разлика от t-теста на ученика, P Фигура 8). Ооцитите с дефицит на цинк, култивирани със SAM, имат нива на H3K4me3, подобни на контролните ооцити (Фигура 8). За да се провери дали SAM може да увеличи дела на оцитите с дефицит на цинк, преминаващи към 2-клетъчен стадий, COC се събират от грундирани с eCG животни, хранени с контролна или недостиг на цинк диета в продължение на 5 дни и отлежават in vitro. Контролните ембриони имат висока степен на оплождане от 95%, която е намалена до 19% в ооцитите с дефицит на цинк (Фигура 9). Ооцитите с недостиг на цинк, узрели в присъствието на SAM, са имали 45% степен на оплождане (Фигура 9).
А. Имунооцветяване за хистон H3K4me3 в GV ооцити от животни, получаващи контролна или цинководефицитна диета (ZDD) и култивирани само в среда (Control и ZDD) или среда, съдържаща 100 µM SAM (ZDD + SAM) за 24 часа. * Значителна разлика от ANOVA, последвана от HSD тест на Tukey, P фигура 10 и показва, че недостигът на цинк при майката по време на много тесен прозорец непосредствено преди овулацията нарушава епигенетичното програмиране на ооцитите, включително намаляване на ДНК и метилиране на хистон и свързано с това увеличаване на експресията на повтарящи се елементи. Тези епигенетични дефекти заедно с показаните по-рано мейотични дефекти (Tian and Diaz, 2012) сериозно компрометират оплождането и предимплантационното ембрионално развитие. Не е известно обаче дали дефицитът на цинк действа директно върху яйцеклетката или индиректно чрез други механизми за намаляване на метилирането на хроматин в яйцеклетката. In vitro добавки с s-аденозилметионин, донор на метил, възстановява метилирането на хистона и подобрява скоростта на оплождане на яйцеклеточни дефицити. Нашето предизвикателство сега е да разкрием напълно точните пътища и протеини, засегнати от недостиг на цинк, които водят до намален потенциал за развитие на ооцитите. Разбирането на тези цинково-медиирани механизми ще даде нови прозрения в регулирането на качеството и плодовитостта на яйцеклетките.
Диетични лечения се прилагат върху растящи ооцити, които едва навлизат в антралния етап на развитие около 18-дневна възраст. Леченията бяха прекратени 48 часа след края на eCG, който обхваща периода на антрален фоликуларен растеж. Определени са ефекти върху зреенето, оплождането и развитието на предимплантацията. Предишни изследвания показват, че лечението с TPEN нарушава завършването на мейоза I, но ефектите на in vivo дефицит на цинк върху оплождането и развитието преди имплантацията не са докладвани.
Констатациите подкрепят хипотезата, че недостигът на хранителен дефицит на цинк намалява потенциала за развитие на ооцитите, но механизмът, отговорен за този ефект, е неизвестен. Намаляването на ооцитите H3K4me3 може да обясни много от дефектите, наблюдавани в ооцитите с дефицит на цинк. Наскоро бе показано, че лизин метилтрансферазният протеин, смесена родова левкемия 2 (MLL2), катализира триметилирането на H3K4 в ооцитите (Andreu-Vieyra et al., 2010). Делецията на MLL2 в ооцитите премахва както три-, така и диметилирането, но не и монометилирането на H3K4. Тези епигенетични промени са свързани с неуспех на овулацията, липса на транскрипционно заглушаване, повишена експресия на повтарящи се елементи и безплодие. Този фенотип е изключително подобен на нашия диетичен модел на дефицит на цинк, където има неуспех на овулацията (Tian and Diaz, 2012), намаляване на триметилирането на H3K4 и увеличаване на експресията на повтарящи се елементи (настоящото проучване). MLL2 е свързващ цинка протеин (Bach et al., 2008) и може да бъде пряко засегнат от липсата на цинк в ооцита. Тази хипотеза обаче остава да бъде проверена директно.
Дефицитът на цинк е често срещан в много части на света (Wuehler et al., 2005) и в малцинствените и бедни популации в САЩ (Schneider et al., 2007). Нарушената чернодробна функция или увреждането на черния дроб, причинено от алкохолизъм, също води до системен дефицит на цинк (Flynn et al., 1981; Sullivan and Lankford, 1965). Нашите открития показват, че острият диетичен дефицит на цинк преди овулацията драстично намалява качеството на ооцитите и потенциала за развитие и е свързан с дефекти в епигенетичното програмиране, вероятно причинени от локално или системно изчерпване на SAM. Тези наблюдения и показаните преди това ефекти на дефицита на цинк върху мейотичния клетъчен цикъл (Bernhardt et al., 2012b; Kim et al., 2011; Kim et al., 2010; Kong et al., 2012; Tian and Diaz, 2012) може да доведе до подобрени методи за асистирани репродуктивни процедури чрез модулиране на наличността на цинк и/или SAM по време на узряването и оплождането на яйцеклетките. Настоящите открития добавят допълнителни доказателства, че дори преходните хранителни дефицити могат да повлияят на плодовитостта. Бъдещите изследвания ще изследват как недостигът на цинк води до намаляване на биосинтеза на SAM и дали са засегнати други метаболитни пътища. И накрая, ще бъде много интересно да се определи въздействието на недостига на цинков дефицит върху постимплантационното развитие и здравето след раждането.
Акценти
Остър дефицит на цинк преди овулацията причинява намалено метилиране на хроматин
Оплождането и развитието на предимплантацията е нарушено при ооцитите с дефицит на цинк
Недостигът на цинк увеличава експресията на повтарящи се елементи в ооцитите
- Остър панкреатит, приписван на хранителната несъобразителност при женски кучета от смесени породи
- 8 Симптоми и признаци за недостиг на цинк
- 7 здравословни храни с витамин D, които трябва да ядете, за да избегнете недостиг на витамин D - NDTV Food
- 7 идеи за влак за хранене за всеки с диетични ограничения Грот мрежа
- Айран - Въглехидрати, GI, Цинк, Витамини и др