Неконтролиран захарен диабет се появява, когато нивата на циркулиращия инсулин са недостатъчни за по-ниски повишени концентрации на глюкоза в кръвта. Това състояние включва спектър от метаболитни аномалии, които варират от ефектите на лека инсулинова недостатъчност (т.е. хипергликемия) до ефектите на изразена и продължителна инсулинопения (т.е. кетоацидоза и изчерпване на течности и електролити). Диабетната кетоацидоза, която е най-тежката остра проява на дефицит на инсулин, е почти изцяло ограничена до пациенти с диабет тип 1 или пациенти с тежко заболяване на панкреаса с друга етиология. При хора без абсолютен инсулинов дефицит, въпреки че комбинацията от значителна инсулинова резистентност и относително ниски нива на инсулин може да доведе до значителна хипергликемия, производството на кетон в тялото, достатъчно за да предизвика кетоза и метаболитна ацидоза, не се наблюдава. Дори ниските нива на инсулин, каквито обикновено присъстват при диабет тип 2, са достатъчни, за да ограничат липолизата и да ограничат наличието на предшественици на свободни мастни киселини за образуване на кетонно тяло. В противен случай много от нарушенията, наблюдавани при неконтролиран диабет, са общи за всички форми на диабет.
Патофизиологичните събития, които влияят на нивата на кръвната глюкоза при състояния на лек до умерен дефицит на инсулин, се класифицират в две широки категории. Първо, нормалните пътища за изчистване на глюкозата след хранене са неефективни; второ, запасите от гориво в тялото се разграждат с отделяне на други субстрати, които водят до неподходящ синтез на повече глюкоза. Тези събития се дължат на инсулинопения и често се допринасят допълнително от относителното изобилие на контрарегулаторните хормони, глюкагон, катехоламини и в по-малка степен кортизол и хормон на растежа. В допълнение, хипергликемията допълнително инхибира секрецията на инсулин на панкреаса 0 клетки, усложнявайки проблема („глюкозна токсичност“).
След поглъщане на хранене, значителна част от глюкозата, абсорбирана в порталната циркулация, се отстранява от черния дроб, където се съхранява като гликоген, превръща се в липид или се консумира по пътища, генериращи енергия. Всеки от тези процеси се намалява поради дефицит на инсулин, което води до повишено навлизане на абсорбираната глюкоза в системната циркулация. Скелетните мускули представляват основното място на тъканите за отстраняване на циркулиращата кръвна захар след хранене. При диабет дефицитът на инсулин води до значително намаляване на активността на транспортера на глюкоза Glut-4 до голяма степен като следствие от намалена локализация на Glut-4, стимулирана от инсулин в повърхностните мембрани. Това намалява нормалния поток на глюкоза след хранене в скелетните мускули. Освен това глюкозата, която навлиза в мускулите, се метаболизира неефективно при липса на инсулин. Други чувствителни към инсулин тъкани, като мастна тъкан и миокард, са засегнати по подобен начин, с последващо намаляване както на усвояването на глюкозата, така и на метаболизма, въпреки че техният принос за глюкозния клирънс е количествено по-малък от този на мускулите.
В състояния след абсорбция или на гладно хипергликемията при неконтролиран диабет не се разрешава и често се влошава (Фигура 2). Ненормално ниските концентрации на инсулин водят до преувеличение на метаболитните реакции, които обикновено служат за защита срещу развитието на хипогликемия по време на гладуване. Тези реакции на нисък инсулин и повишени контрарегулаторни хормони включват, първоначално, превръщането на съхранявания гликоген в глюкоза. Едновременно с това се активират чернодробните ензими, участващи в глюконеогенезата, което води до производство на глюкоза от такива въглеродни източници като лактат и пируват (странични продукти от мускулната гликолиза), аминокиселини (от разграждането на мускулните протеини) и глицерол (получен от запасите на адипоцитни триглицериди ). При постоянен дефицит на инсулин запасите от гликоген се изчерпват и чернодробната глюконеогенеза става най-важният фактор за нарастващата хипергликемия. Междувременно телесните запаси от протеини и мазнини се изчерпват в безсмисления синтез на нова глюкоза, която не може да се използва ефективно и служи за влошаване на съществуващата хипергликемия.
Прекомерното натрупване на глюкоза в циркулацията и в извънклетъчното пространство води до движение на водата извън клетките, за да се поддържа осмотичен баланс, причинявайки вътреклетъчна дехидратация. Високият филтриран товар на глюкоза в бъбречния гломерул преодолява реабсорбционния капацитет на бъбречната тубула и се получава осмотична диуреза. В крайна сметка това води не само до загуба на вода заедно с глюкозата, но и до излишна екскреция на калий, натрий, магнезий, калций и фосфат с урината. Размерът на общата загуба на електролит в тялото зависи от продължителността и тежестта на хипергликемията.
Основните симптоми при умерен дефицит на инсулин са полиурия и последваща жажда и полидипсия. При по-тежък и продължителен дефицит на инсулин загубата на големи количества глюкоза в урината може да доведе до загуба на тегло. Ако хиперосмоларността не се компенсира от адекватно увеличаване на приема на вода, пациентите могат да развият променен психически статус и обтурация. При пациенти в старческа възраст с диабет тип 2 тази последователност може да доведе до животозастрашаващо състояние на некетотична хиперосмоларна кома.
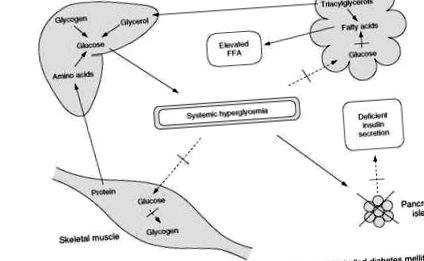
При диабет тип 1 клиничната картина на лошия контрол се различава от описаната по-рано по това, че дефицитът на инсулин е по-тежък (Фигура 3). Поглъщането на глюкоза от мускулите намалява, а производството на глюкоза от черния дроб се увеличава. Отбелязаната инсулинопения обаче също води до бърза, неконтролирана липолиза. Разграждането на триглицеридите води до ускорено освобождаване на свободни мастни киселини и глицерол. Повишеното доставяне на глицерол от мастната тъкан до черния дроб допълнително насърчава чернодробната глюконеоген-еза. При липса на инсулин освободените свободни мастни киселини се поемат от черния дроб и се преобразуват с ускорена скорост в кетонни тела (фи-хидроксимаслена киселина, ацетооцетна киселина и ацетон).
В състояние на гладно при недиабетни индивиди кетонните тела се метаболизират под въздействието на дори ниски нива на инсулин като източник на енергия, особено в скелетните и сърдечните мускули. При екстремни състояния на дефицит на инсулин, използването на кетонното тяло се възпрепятства едновременно с увеличаване на синтеза. С увеличаване на продължителността на инсулинопения нивата на кетокиселините в кръвта се повишават. Кетоните, подобно на глюкозата, се разливат в урината или като свободни киселини, или, в зависимост от рН, като натриеви или калиеви соли, влошавайки осмотичната диуреза и дефицита на електролити. В крайна сметка капацитетът за буфериране на кръвта за киселина е претоварен и възниква системна ацидемия. Ацидемията има пагубен ефект върху всички клетъчни мембрани и много клетъчни функции и, когато е тежка, може да причини аритмии, сърдечна депресия и съдов колапс. В комбинация с описаната по-рано хиперосмоларност и дехидратация, диабетната кетоацидоза е животозастрашаваща ситуация.
В обобщение, лошият контрол може да доведе до опасни метаболитни последици и от време на време до смърт. Основната цел на терапията е заместването на инсулина, което е необходимо, за да се обърне производството на глюкоза и кетокиселини от черния дроб, да се насърчи усвояването на мускулна глюкоза и кетони и да се инхибира по-нататъшното разграждане на мазнините и протеините. Също толкова важна цел на терапията трябва да бъде попълването на загубени извънклетъчни и вътреклетъчни течности и електролити.
Фигура 3 Метаболитни събития, водещи до развитие на кетоацидоза при неконтролиран захарен диабет.
Вижте също: Захарен диабет: етиология и епидемиология; Диетичен мениджмънт. Глюкоза: химия и хранителни източници; Метаболизъм и поддържане на нивото на кръвната глюкоза; Глюкозна толерантност. Чернодробни нарушения.
- Нова информация за отслабването на метформин в полза на диабет
- Ново лекарство за диабет, одобрено само за отслабване Health24
- Ползите от тиквените семки тук; s как консумирането му може да ви помогне при загуба на тегло, диабет и коса
- Шери Шепърд за отслабване и диабет
- Ново лекарство за диабет понижава кръвната захар, без да предизвиква повръщане, загуба на тегло