Резюме
Заден план
Мускулната дистрофия на Дюшен (DMD) се причинява от загуба на експресия на дистрофин и води до тежък спад в амбулаторната и сърдечната функция. Въпреки това, дефицитът на дистрофин mdx миши модел на DMD развива само много лека форма на заболяването. Нашата група и други са показали съдови аномалии в животински модели на МД, вероятно следствие от факта, че кръвоносните съдове експресират същите протеини, свързани с дистрофин гликопротеинов комплекс (DGC) като скелетните мускули.
Методи
За да се тества приносът на кръвоносните съдове за увреждане на мускулите при DMD, mdx 4cv на мишките бяха дадени повишени липидни нива чрез нокаут на гена на аполипопротеин Е (ApoE), комбиниран с нормална чау или богата на липиди западна диета. Амбулаторната функция и сърдечната функция (чрез ехокардиограма) са оценени на възраст 4 и 7 месеца. След жертвоприношението, мускулната хистология и аортното оцветяване бяха използвани за оценка на мускулната патология и развитието на атеросклероза, съответно. Плазмените нива на общия холестерол, липопротеините с висока плътност (HDL), триглицеридите и креатин киназата (CK) също са измерени.
Резултати
Въпреки че имаше увеличение на обема на сърцето на лявата камера в mdx-ApoE мишки в сравнение с тези в mdx мишки, параметрите на сърдечната функция не са били засегнати. В сравнение с див тип и ApoE-null, само mdx-Мишките ApoE KO показаха значителна амбулаторна дисфункция. Въпреки съществената разлика в плазмената CK, хистологичните анализи разкриват, че повишените плазмени липиди при хранене с чау и западна диета mdx-АпоЕ мишките са свързани с тежко обостряне на мускулната патология в сравнение с mdx мишки: значително увеличаване на увреждането на миофибрите и фибро-мастните заместители в мускулите на гастрокнемия и трицепс брахии, напомнящи повече на патологията на DMD при човека. И накрая, въпреки че и ApoE и mdx-АроЕ групи показаха повишени плазмени липиди, mdx-ApoE показва атеросклеротично отлагане на плаки, равно или по-малко от това на ApoE мишки.
Заключения
Тъй като други са показали, че липидните аномалии корелират с тежестта на DMD, нашите данни показват, че плазмените липиди могат да допринесат основно за тежестта на DMD при хората и че прословутият мек фенотип mdx мишките може да се отдадат отчасти на техните ендогенно ниски плазмени липидни профили. Следователно, пациентите с DMD могат да се възползват от терапии за понижаване на липидите и съдова насоченост.
Заден план
Дистрофинът е протеин от 427 kDa, кодиран на късото рамо на Х хромозомата. Той е ключов член на дистрофин-гликопротеиновия комплекс (DGC), който обхваща плазмената мембрана и свързва извънклетъчния матрикс с вътреклетъчния цитоскелет [1]. Дистрофинът се свързва с цитоскелетните актинови нишки и с други DGC протеини в плазмената мембрана, създавайки точка на свързване, необходима за поддържане на сарколемалната структура и защита от механичен стрес [2]. Загубата на функционална експресия на дистрофин води до развитие на мускулни дистрофии на Дюшен (DMD) и Becker (BMD), характеризиращи се с тежка и прогресивна мускулна слабост и загуба поради повишена крехкост на сарколема и податливост към нараняване на миофибър [2,3,4].
DMD е най-често срещаният тип МД, който се среща при почти 1 на 3600–6000 раждания при мъже по света и представлява приблизително 80% от всички случаи на МД [5, 6]. Децата обикновено имат анормална походка, прогресивна мускулна слабост, телешка псевдохипертрофия и повишени нива на серумна креатин киназа (CK). Въпреки това, мускулната хипертрофия постепенно отстъпва място на значителна мускулна дегенерация и фибро-мастно преустройство [7,8,9], оставяйки 90% от момчетата приковани към инвалидна количка до 12-годишна възраст [10]. Въпреки че пациентите с DMD проявяват опустошителна патология на скелетната мускулатура, кардиомиоцитите също показват повишена податливост на механично натоварване, причинено от стрес, водещо до повишена сърдечна фиброза [11] и развитие на често летална сърдечна дисфункция, обикновено проявена като дилатационна кардиомиопатия (DCM) [12,13,14,15]. В резултат на тежката сърдечна патология, в допълнение към нарушената дихателна функция поради значително увреждане на диафрагмата, продължителността на живота на пациентите с DMD се съкращава до приблизително 30-годишна възраст [10, 16].
Тъй като ние и други документирахме експресия на DGC-свързани протеини в съдови ендотелни клетки и гладкомускулни клетки [27, 28], предположихме, че мутациите на DGC протеини във васкулатурата могат да повлияят на първичната мускулна дисфункция при МД. За да проверите тази хипотеза, mdx мишките получават повишени плазмени нива на липиди, свързани със съдови заболявания и атеросклероза. Това беше постигнато чрез инактивиране на гена на аполипопротеин Е (ApoE), който причинява натрупване на богати на холестерол частици в плазмата [29, 30]. Резултантното mdx-Мишките ApoE показват повишени липидни нива, придружени от значително обостряне на мускулната патология, по-добре рекапитулиращи фенотипа на пациента с DMD. Нашите данни показват, че прословутият мек фенотип на mdx мишките може да се отдадат на техните естествено ниски плазмени липидни профили и превъзходно съдово здраве в сравнение с хората. Тъй като последните доклади разкриха плазмени и тъканни липидни аномалии при пациенти с DMD [31, 32], ние предполагаме, че плазмените липиди могат да допринесат значително за патологията на MD и че пациентите с DMD могат да се възползват от терапии за понижаване на липидите и съдова насоченост.
Методи
Развъждане и отглеждане на животни
Всички животни бяха настанени в 12-часов цикъл светлина/тъмнина, регулирано от температура съоръжение и всички експерименти бяха проведени с одобрението на Комитета за грижи за животните на UBC. Експериментални мишки бяха поставени на обикновена чау (LabDiet 5001) или западна диета (Harlan, TD88137; 0,2% общ холестерол, 21% обща мазнина и 34% захароза спрямо теглото) на 8-седмична възраст. Мишките са умъртвени на 4 и 7 месечна възраст, докато са били под терминална анестезия (3,5% v/v изофлуран при 2 L O2) чрез сърдечна пункция и перфузиран със затоплен разтвор на Krebs [118 mmol/L NaCl, 22,5 mmol/L NaHCO3, 4 mmol/L KCl, 1,2 mmol/L NaH2PO4, 2 mmol/L CaCl2, 2 mmol/L MgCl2 и 11 mmol/L декстроза].
Оценка на амбулаторната функция
Дължината на стъпката се измерва чрез боядисване на задните крака на мишки и като им се позволява да се движат по малък коридор, облицован с хартия с дължина приблизително 1,5 m. Разстоянието между стъпалата на един и същ крак беше измерено и осреднено за три последователни пробега, с изключение на зоните на спиране.
Функция на сърцето in vivo
Мишките бяха упоени, използвайки 0.75–1.25% v/v изофлуран при 2 L O2 със сърдечна честота, поддържана между 400 и 425 BPM и е извършена четирикамерна ехокардиограма, използвайки системата VisualSonics Vevo 2100. Проследяванията на сърдечната камера и вентрикуларната стена бяха анализирани, за да се определят няколко физиологични и функционални сърдечни параметри като сърдечен дебит, фракционно скъсяване, ударен обем, фракция на изтласкване, както и диаметър и обем на лявата камера както в диастолата, така и в систолата.
Анализ на Evan’s blue dye
Съгласно предварително изяснени протоколи [35], под 3,0% изофлуран v/v, мишките се инжектират интравенозно с 200 μL 0,5% синьо багрило на Evan в PBS разтвор в долната куха вена. Животните бяха перфузирани в продължение на 10 минути, преди да бъде извършено жертвоприношение чрез цервикална дислокация и бяха събрани мускули. След 24 часа сушене при 56 ° С, изсушените мускули се претеглят и се поставят в 500 μL формамид за 24 часа при 56 ° С. Взеха се проби, 200 μL от всяка проба се добавят към 96-ямкови плаки в два екземпляра и се измерва абсорбцията при 500 nm. Използвана е стандартна крива за екстраполиране на ng от синьото багрило на Evan, което след това се нормализира до сухо тегло на мускулната тъкан.
Мускулна хистология
Събрани са диафрагма, преден пищял (TA), екстензор дигитурум лонгус (EDL), гастрокнемиус, квадрицепс на бедрената кост и трицепс брахии. Тъканта се фиксира в 10% формалин за 24 часа, след което се прехвърля в 70% етанол. Мускулите бяха вградени в парафин и бяха разделени на предметни стъкла с дебелина 8 μm, които след това бяха оцветени с хематоксилин и еозин (H&E) или трихромни петна на Masson. Червено петно от ализарин също се извършва на избрани предметни стъкла на скелетните мускули, за да се визуализира отлагането на калций. Процентът на мазнини се изчислява чрез проследяване на адипоцитните области в софтуера Aperio ImageScope и чрез разделяне на площта на общата площ на мускула. За да се определи процентът на мускулната площ, заета от здрави миофибърни, немиофибърни области (напр. Адипоцити, натрупвания на холестерол, калцификация и възпалителни клетки), както и увредени, некротични области са извадени от общата мускулна площ. Съдържанието на колаген се измерва с помощта на алгоритъм за положителен брой пиксели в софтуера Aperio ImageScope на трихромно оцветени слайдове на Masson, като се използват следните параметри: стойност на нюанса 0,66 и ширина на нюанса 0,25. Сърцата също бяха фиксирани в 10% формалин, вградени с парафин и оцветени с трихром на Masson’s.
Контралатералните мускули бяха събрани и незабавно вградени в напречно сечение трагакант, замразени в охладен с течен азот изопентан и съхранявани при - 80 ° C. Замразените мускули бяха разделени при - 20 ° C с дебелина 8 μm и бяха оцветени с маслено червено О, за да се визуализират неутрални липиди в мускулната тъкан, следвайки протокола, разработен от Mehlem, Hagberg [36]. За да се визуализира съдовата плътност, CD31 (PECAM-1) беше открит в мускулни криосекции, използвайки анти-CD31 антитяло (разреждане 1: 100, клетъчна сигнализация, D8V9E # 77699) чрез имунохистохимичен (IHC) протокол, предложен от производителя.
Анализ на плазмата
Плазмата се събира в хепаринизирани епруветки чрез сърдечна пункция на незабелязали мишки, завърта се при 4000 RPM за 10 минути при 4 ° C и се съхранява при - 80 ° C. Плазмените проби бяха оценени с помощта на системата Siemens Advia 1800 за нива на креатин киназа (CK NAC), холестерол (CHOL-2), липопротеин с висока плътност (D-HDL) и триглицериди (TRIG-2) и анализите бяха проведени по следния начин инструкции на производителя.
Аортна атеросклероза
Сърцата бяха разрязани по атриовентрикуларната равнина и бяха замразени в съединение с оптимална температура на рязане (OCT), а аортните коренни секции бяха оцветени с маслено червено О [36]. Площта на плаката в корена на аортата е измерена в квадратни милиметри. Цели аорти се фиксират в 10% формалин, изплакват се със 70% етанол и се накисват във филтриран разтвор на Судан IV (5 g Судан IV в 500 мл 70% етанол и 500 мл ацетон) за 20 минути. След изплакване на аортите в 70% етанол, те се накисват в 80% етанол за 20 минути, след това се изплакват в течаща вода в продължение на 1 час и се съхраняват в 10% формалин. Снимки на закрепени отворени аорти бяха направени за анализ и процентът на покритие на плаката беше определен чрез разделяне на площта на плаката на общата площ на стената на съда.
Статистически анализ
Статистически анализи бяха извършени с помощта на GraphPad Prism 6. За сравнение на множество групи в даден момент, беше използван еднопосочен дисперсионен анализ (ANOVA) тест за множество сравнения, за да се сравнят средствата на всяка група. Когато бяха сравнени множество групи в няколко точки от време, беше използван двупосочен тест за многократно сравнение ANOVA. Методът на Tukey’s беше използван за коригиране на множество сравнения. A P стойност по-малка от 0,05 се счита за статистически значима. Фигурите показват данните като средна стойност плюс стандартна грешка на средната стойност (SEM) и н показва броя на мишките за експеримент.
Резултати
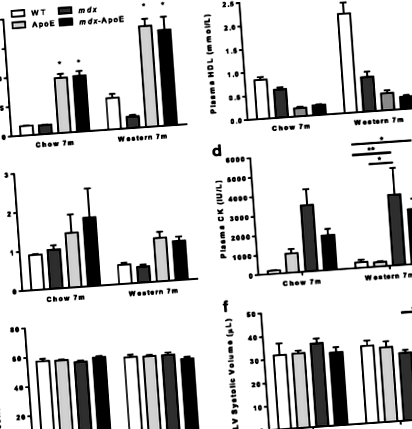
Повишените плазмени нива на липидите причиняват леки сърдечни промени в mdx мишки
Хиперлипидемия mdx мишките показват нарушена амбулаторна функция и устойчива хипертрофия на задните крайници
По отношение на амбулацията видяхме забележимо увреждане на способността за ходене на хиперлипидемия mdx мишки. В сравнение с WT или ApoE мишки, измерванията на дължината на крачка разкриват значително 20-25% намаляване на дължината на крака в mdx-Мишките ApoE хранеха чау или западна диета на 7-месечна възраст, докато mdx мишки показаха незначително намаляване на дължината на крачката (фиг. 2а-б). След евтаназия след 7 месеца забелязахме трайно нарастване на размера на скелетната мускулатура през mdx-ApoE мишки, хранени със западна диета в сравнение с WT (фиг. 2в – г) и подобни резултати са наблюдавани при 7-месечни групи, хранени с чау (данни не са показани). Тъй като хипертрофията на прасците е сравнително ранно събитие при ДМД, направихме подобни анализи във втора кохорта в по-ранна 4-месечна точка и забелязахме още по-тежка хипертрофия на задните крайници в mdx и mdx-АпоЕ мишки, хранени със западна диета, без значителна разлика между групите с дефицит на дистрофин (фиг. 2г).
Повишените плазмени нива на липидите се влошават mdx-свързано увреждане на миофибър и ремоделиране на скелетните мускули
По подобен начин мускулът на трицепс брахии беше силно влошен през mdx-ApoE мишки, както се вижда на фиг. 4а – b. Анализът на общата мускулна площ разкри първоначално увеличение на общата площ на mdx-ApoE triceps brachii на 4 месеца на западна диета (фиг. 4в). Въпреки че тази хипертрофия се изравни до 7-месечна възраст (фиг. 4в), имаше драматични промени в мускулния състав в mdx-ApoE triceps brachii мускули в сравнение с всички останали групи в този момент: увеличено отлагане на мазнини и колаген (приблизително 10 и 20% от общата мускулна площ, съответно) и намалена жизнеспособна мускулна площ (Фиг. 4d-f). Отново, повишено отлагане на колаген и в двете западни диети mdx и mdx-АпоЕ трицепс може да се наблюдава още на 4-месечна възраст (фиг. 4д).
Обратно, наблюдавахме само незначителна, незначителна тенденция към обостряне на мускулната патология в квадрицепс феморис на mdx-АпоЕ мишки: подобно нарастване на фиброзата между mdx и mdx-ApoE групи без значителна инфилтрация на мазнини (Допълнителен файл 6: Фигура S5A – E). По подобен начин хиперлипидемията не повлиява mdx-асоциирана патология в мускула на диафрагмата (Допълнителен файл 7: Фигура S6A): и двете mdx и mdx-АпоЕ мишките на западна диета показват значителни нива на фиброза и увреждане на миофибър със сходни намаления в здравата зона на миофибър на 4 и 7 месеца при западна диета (Допълнителен файл 7: Фигура S6B – E). И накрая, не наблюдавахме никаква драматична мускулна патология в мускулите на предния пищял (TA), soleus или extensor digitorum longus (EDL), събрани (данните не са показани). Заедно нашите данни предполагат повишена мускулна атрофия, увреждане на миофибрите и инфилтрация на фибромазнини при някои, но не при всички mdx-свързани мускули.
Загубата на дистрофин не влошава съдовата атеросклероза
Дискусия
Тъй като нашите данни потвърждават констатациите от предишно проучване, което наблюдава отлагане на притъпена плака през mdx-ApoE мишки в сравнение с ApoE мишки [44] и ние показахме, че има нормална или дори повишена съдова плътност в зоните на мускулно увреждане, обострянето на мускулната патология в mdx-ApoE вероятно не е мускулна некроза в резултат на индуцирани от плака исхемични събития. Вместо това, нашите данни показват, че повишената съдова пропускливост се наблюдава и при двете mdx и mdx-АпоЕ мускулът може да улесни инфилтрацията на плазмени липиди в мускулната тъкан в mdx-ApoE мишки, които имат висок циркулиращ холестерол и липиди. Въз основа на хистологичните особености на тежките мускулни лезии в mdx-ApoE мишки в сравнение с mdx мишки с ендогенно ниско циркулиращи липиди, ние предполагаме, че изтичането на плазмени липиди от кръвоносните съдове в податливи мускулни тъкани води до токсичност на миофибър и че колкото по-високи са плазмените липиди, толкова по-голямо е увреждането на миофибрите надолу по веригата и фибро-мастните заместители.
mdx-ApoE като подобрен модел на DMD
Плазмени липиди: ново завъртане на съдовата теория?
Липиди и липопротеини като основен медиатор на DMD и потенциални терапевтични цели
Да грешим от страна на предпазливостта, докато нашата mdx-Моделът ApoE по-точно съответства на патологията, наблюдавана при пациенти с DMD, отколкото на mdx мишка с нейните ендогенно ниски нива на липидите, някои важни разлики остават. Например, въпреки че ApoE мишките имат липидни нива, по-представителни за липидния профил на човека от мишки от див тип, нивата на циркулиращи остатъци от VLDL и хиломикрон са по-високи от тези, които обикновено се срещат при хората [61]. Независимо от това, трябва да се отбележи, че атеросклеротичните лезии при ApoE мишки се развиват спонтанно чрез подобен механизъм като тези, наблюдавани при хиперлипидемични хора [62]. В допълнение, нашият модел се различава от пациентите с DMD като mdx-АпоЕ мишки показват само малки промени в амбулаторната функция и не успяват да развият значителни DCM, които са важни патологични резултати от DMD.
Като цяло, нашите данни показват, че пациентите с DMD биха могли да се възползват от диети, рутинно препоръчвани на пациенти с хиперлипидемия, които се опитват да повишат антиатерогенния HDL холестерол и да намалят проатерогенния LDL-свързан холестерол. И накрая, безопасното модифициране на липидния профил на пациент с DMD с холестерол или лекарства за понижаване на TG също трябва да бъде изследвано. Това се подкрепя от предишно проучване, което установява, че понижаващите липидите медикаменти симвастатин, член на семейството на статините, значително подобряват мускулната функция и фиброзата без данни за рабдомиолиза при mdx мишки [63]. Смята се обаче, че тази полза се медиира чрез антиоксидантните "плейотропни" ефекти на лекарството оттогава mdx нивата на липидите, макар и ендогенно ниски, не се понижават допълнително при лечение със симвастатин. Интересното е, че много групи са показали предимства при използване на съдово насочени терапии в mdx или DMD, като донори на азотен оксид (NO) и блокери на ангиотензин II рецептори (ARB) [64,65,66,67]. Следователно, оптимизирането на подходи за понижаване на липидите или към съдовете при DMD може да предложи уникални терапевтични и лечебни възможности, които трябва да бъдат проучени.
Заключения
Като цяло нашето проучване разкрива леки сърдечни промени, нарушена амбулаторна функция и драматично влошена патология на скелетните мускули в хиперлипидемията mdx-ApoE модел на DMD, който по-добре рекапитулира тежестта на заболяването, наблюдавана при пациенти с DMD, отколкото стандартната mdx мишки. Следователно, нашите данни предполагат, че циркулиращите липиди могат да допринесат значително за развитието и прогресирането на патологията на DMD и че мишите модели могат да проявяват по-леки фенотипове поради техните естествено ниски плазмени нива на липидите. Тъй като клиничните изследвания показват потенциални съдови и липидни аномалии при DMD, ясно е, че патофизиологията на DMD е по-сложна от досега разбраната и че терапиите за понижаване на липидите и съдовата насоченост могат да бъдат от полза при лечението на DMD.
- Човешка преводимост на модела на безалкохолен стеатохепатит, предизвикан от диета с GAN, предизвикан от диета
- Повишена хранителна фруктоза, свързана с повишени нива на пикочна киселина и по-ниски запаси от енергия на черния дроб -
- Високи нива на холестерол в кръвта MedlinePlus Medical Encyclopedia
- Липиди - Класификация и образуване Британика
- Нива на липазен тест (или серумна липаза), предназначение, процедура, резултати