Резюме
Заден план
Промените в сърдечния енергиен метаболизъм допринасят за развитието и тежестта на сърдечната недостатъчност (СН). При тежка СН, общият митохондриален окислителен метаболизъм е значително намален, което води до намален енергиен резерв. Въпреки високото разпространение на HF със запазена фракция на изтласкване (HFpEF) в нашето общество, не е ясно какви промени в сърдечния енергиен метаболизъм се случват в HFpEF и дали промените в енергийния метаболизъм допринасят за развитието на контрактилна дисфункция.
Методи
Директно оценихме цялостния енергиен метаболизъм по време на развитието на HFpEF при чувствителни към сол плъхове на Dahl, хранени с диета с висока сол (HSD) за 3, 6 и 9 седмици.
Резултати
В продължение на 9 седмици HSD причинява прогресивно намаляване на диастолната функция (оценена чрез ехокардиографска оценка на E ’/ A’). Това беше придружено от прогресивно увеличаване на сърдечната степен на гликолиза (оценено в изолирани работещи сърца, получени на 3, 6 и 9 седмици HSD). За разлика от това, последващото окисление на пирувата от гликолиза (окисление на глюкоза) не е променено, което води до разединяване на метаболизма на глюкозата и значително увеличаване на производството на протон. Повишената експресия на глюкозен транспортер (GLUT) 1 придружава това повишаване на гликолизата. Намаляване на сърдечната окисленост на мастните киселини и общата скорост на производство на аденозин трифосфат (АТФ) не са наблюдавани в началото на СН, но и двете значително намаляват, тъй като СН прогресира до СН с намален EF (т.е. 9 седмици HSD).
Заключения
Като цяло показваме, че повишената гликолиза е най-ранната енергийна метаболитна промяна, която настъпва по време на развитието на HFpEF. Полученото повишено производство на протон от разединяването на гликолизата и окисляването на глюкозата може да допринесе за развитието на HFpEF.
Заден план
Специфичните промени в скоростите на гликолиза и степента на окисление на глюкозата при сърдечна недостатъчност са важни, тъй като е доказано, че разединяването на гликолизата и окисляването на глюкозата нарушава сърдечната функция. Селективното увеличаване на гликолизата спрямо окислението на глюкозата отделя гликолизата от окислението на глюкозата, което може да доведе до производството на лактат и протони (Liu et al. 1996; Liu et al. 2002; Folmes et al. 2006). Това повишаване на протоните и спад на рН може да намали контрактилитета на сърцето на възрастен чрез нарушаване на чувствителността на тропонин I към калций и инхибиране на бавния калциев ток (Chesnais et al. 1975; Vogel and Sperelakis 1977; Steenbergen et al. 1977; Schiaffino et al. 1993; Моримото и Гото 2000). В допълнение, АТФ се използва както за отстраняване на тези протони, така и за поддържане на хомеостазата на натрий и калций, което намалява сърдечната ефективност и допринася за намаляване на сърдечната функция (Lopaschuk et al. 2010).
Въпреки че има значително количество доказателства, които показват, че сърдечната недостатъчност с намалена фракция на изтласкване (HFrEF) обикновено се характеризира с цялостно намаляване на окислителния метаболизъм и относително увеличение на гликолизата (което може да доведе до повишено отделяне на гликолизата и окисляването на глюкозата), е недостиг на изследвания върху метаболизма при друга често срещана форма на сърдечна недостатъчност, сърдечна недостатъчност със запазена фракция на изтласкване (HFpEF). Следователно в това проучване ние изследвахме окислителния метаболизъм на митохондриите и гликолизата по време на развитието на HFpEF. Това беше изследвано с помощта на чувствителен към сол плъх Dahl, добре характеризиран модел на HFpEF (Horgan et al. 2014; Rapp and Dene 1985; Klotz et al. 2006), и сърдечният метаболизъм беше оценен след 3 седмици, 6 седмици или 9 седмици на диета с високо съдържание на сол (HSD).
Методи
Протокол за животни
Осемседмични мъжки плъхове, чувствителни към сол на Dahl, са били хранени или със стандартна диета с ниско съдържание на сол, съдържаща 0,3% NaCl (Research Diets, D10012G), или с диета с високо съдържание на сол (HSD) (Research Diets, D11021901), съдържаща 8% NaCl, за да индуцира HFpEF. Контролните плъхове се държат на диета с ниско съдържание на сол, докато лекуваните групи се хранят с HSD в продължение на 3, 6 или 9 седмици. Храната и водата бяха осигурени по желание. Плъховете се държат на 12 часа светлина: 12 часа тъмен цикъл. Всички процедури за животни са одобрени от Комитета по хуманно отношение към животните към Университета на Алберта и са съобразени с насоките на Канадския съвет за грижа за животните (Canadian Council on Animal Care 2017).
Ехокардиография
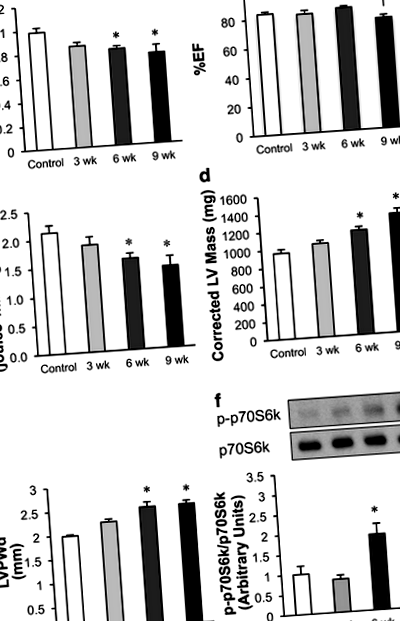
In vivo сърдечната функция се оценява при плъхове, анестезирани с 1–1,5% изофлуран, като се използва система за образна ехокардиография Vevo 770 с висока разделителна способност (VisualSonics, Торонто) с 30-MHz преобразувател (Zhong et al. 2010). За оценка на диастоличната функция са използвани доплер и тъканни доплер изследвания: E ’/ A’, E ’, E/A, E’/E и изоволуметричното време за релаксация (IVRT). Използвани са изображения в М-режим за измерване на% фракция на изтласкване (% EF) и% Фракционно скъсяване (% FS), за извършване на измервания на стената на лявата камера (LV) [Диастола на крайната камера на преградата (IVSd), Диастола на вътрешния диаметър на LV (LVIDd), Крайна диастола на дебелината на задната стена на LV (LVPWd), систола на края на интервентрикуларната преграда (IVS), крайна систола на LV с вътрешен диаметър (LVIDs), систола на дебелина на задната стена на LV (LVPW)] и за измерване на диаметъра и обема на LV диастоличен диаметър, краен систоличен диаметър на лявата камера, LV обемна диастола (LV Vol; d), крайна систола LV обем (LV Vol; s) и коригирана маса на LV].
Изолирани работещи сърдечни перфузии
Western blot анализ
Статистически анализ
Стойностите са представени като средна стойност ± SEM. Извършен е еднопосочен анализ на вариацията (ANOVA) с постхок тест Bonferroni или е извършен тест на Kruskal-Wallis с тест за многократно сравнение на Dunn’s, като се използва софтуер Prism за определяне на статистическа значимост. Разликите се считат за значими, ако p
Резултати
Храненето с диета с висока сол (HSD) на чувствителни към сол плъхове Dahl води до прогресивно развитие на хипертрофия и диастолна дисфункция
Развитието на диастоличната дисфункция е придружено от намаляване на сърдечния митохондриален окислителен метаболизъм при плъхове, чувствителни към сол на Dahl
Степента на общия енергиен метаболизъм се измерва в изолирани работещи сърца, получени на 3 седмици, 6 седмици и 9 седмици на HSD. Прогресивно намаляване на степента на окисляване на мастните киселини се наблюдава след HSD (фиг. 2а), въпреки че значително намаляване на степента на окисление на мастните киселини не се наблюдава до 9 седмици от HSD. В присъствието на инсулин също се наблюдава подобно зависимо от времето намаление на окислението на мастните киселини (Таблица 3). За разлика от това, няма промяна в степента на окисление на глюкозата (фиг. 2б) или скоростта на окисление на лактата (фиг. 2в) по време на развитието на диастолна дисфункция, независимо дали инсулинът е присъствал (таблица 3) или липсва. Основният източник на цялостно сърдечно производство на АТФ във всички сърца произхожда от окисляването на мастните киселини (фиг. 2г). В резултат на това се наблюдава намаляване на общите нива на сърдечна продукция на АТФ до 9 седмици на HSD, което се дължи главно на наблюдаваното намаляване на степента на окисление на мастните киселини (фиг. 2г).
Намалената гликолиза е ранна енергийна метаболитна промяна в сърцата от плъхове, чувствителни към сол на Dahl, хранени с HSD
Най-ранната енергийна метаболитна промяна, настъпила при чувствителни на Dahl плъхове, хранени с HSD, е увеличение на гликолизата, което вече се е увеличило с над 300% за 3 седмици от HSD (фиг. 2д). Това увеличение се наблюдава и когато инсулин е присъствал в перфузата (Таблица 3) и преди началото на HFpEF или HFrEF (Фиг. 1). Тъй като увеличаването на гликолизата по време на развитието на диастолна дисфункция не е било придружено от увеличаване на окислението на глюкозата (фиг. 2б), е настъпило отделяне на гликолизата от окислението на глюкозата, което е довело до значително увеличение на производството на протони, дори от 3 седмици HSD (фиг. 2е). Това повишено отделяне на гликолизата и окисляването на глюкозата и нарастването на производството на протони продължават в сърцата, перфузирани в присъствието на инсулин (Таблица 3). Тъй като разединяването на гликолизата и окисляването на глюкоза и повишаването на производството на протони се случва рано по време на развитието на диастолна дисфункция, може да съществува възможна причинно-следствена връзка между разединяването на гликолизата и окисляването на глюкозата и развитието на HFpEF.
Въпреки че нивата на гликолиза в сърцата остават повишени, тъй като HFrEF се развива (т.е. до 9 седмици от HSD), увеличаването на производството на АТФ, произхождащо от гликолиза, не компенсира намаляването на производството на АТФ, настъпило в резултат на намаляването на мастните киселини окисление (фиг. 2г, таблица 3).
Повишената експресия на GLUT1 може да допринесе за повишеното отделяне на гликолизата от окисляването на глюкозата, наблюдавано по време на развитието на диастолна дисфункция
Изследването на експресията на различни протеини, участващи в метаболизма на глюкозата, показва, че промяната в транспорта на глюкоза може да допринесе за повишаване на гликолизата, наблюдавано по време на развитието на диастолна дисфункция. Постепенно увеличаване на експресията на GLUT1 се наблюдава в сърцата на плъхове, чувствителни към сол на Dahl по време на HSD (фиг. 3а и b). Тъй като GLUT1 медиира усвояването на глюкоза, независимо от инсулина, това предполага, че повишената експресия на GLUT1 може да участва в повишените нива на гликолиза, наблюдавани дори когато сърцата са били перфузирани без инсулин (фиг. 2д). Докато експресията на PGAM1 и GLUT4 (инсулинозависимият глюкозен транспортер) не се променя значително по време на развитието на диастолна дисфункция, LDHA се увеличава значително след 3 седмици на HSD (фиг. 3d). Тази изоформа на LDH благоприятства превръщането на пирувата в лактат. Това предполага, че LDHA може да допринесе за първоначалното увеличаване на разединяването на гликолизата и окисляването на глюкозата, наблюдавани в отговор на HSD. HIF1α, транскрипционен фактор, регулиращ гликолизата, не е променен от HSD (фиг. 3д).
Също така изследвахме експресията на митохондриални ензими, които биха могли да допринесат за промените в сърдечния енергиен метаболизъм, наблюдавани в отговор на HSD. Не са наблюдавани значителни промени в експресията на PDH, ограничаващ скоростта ензим за окисляване на глюкозата (Фиг. 4а). Докато фосфорилирането на PDH от PDH киназа намалява PDH активността, ние не наблюдаваме промяна в pPDH по време на развитието на диастолна дисфункция (Фиг. 4а и b). Тази липса на промяна в pPDH корелира с липсата на промяна в степента на окисление на глюкозата по време на развитието на диастолна дисфункция (фиг. 2б). Разгледахме и експресията на носителя на митохондриален пируват. Интересното е, че експресията на MPC1 се увеличава след 6 седмици на HSD, но експресията на MPC2 не се променя значително (Фиг. 4в и d). В допълнение, експресията на цитохром с протеин не е била значително променена (фиг. 4е). Тъй като е доказано, че ацетилирането регулира окислителния метаболизъм в митохондриите, ние също оценихме ефекта на HSD върху цялостното ацетилиране. Въпреки това, цялостното ацетилиране на лизин не се променя значително в сърцата на Dahl-чувствителни към сол плъхове, хранени с HSD (Допълнителен файл 1).
Дискусия
Въпреки че често се цитира, че при сърдечна недостатъчност сърцето преминава от метаболизъм на мастна киселина към глюкоза, нашите данни показват, че е по-точно да се предположи, че при HFrEF настъпва намаляване на общия сърдечен митохондриален окислителен метаболизъм, придружен от относително увеличение на гликолизата. Въпреки оксидацията на глюкоза, която е основният източник на производство на АТФ, произведена от глюкоза, степента на окисление на глюкозата не се увеличава по време на развитието на систолна дисфункция (Kato et al. 2010; Lopaschuk et al. 2010; Zhabyeyev et al. 2013; Zhang et al. 2013; Liu et al. 1996; Liu et al. 2002). Всъщност при миши модели на HFrEF всъщност наблюдаваме намаляване на скоростите на окисление на глюкозата (Zhabyeyev et al. 2013; Zhang et al. 2013).
Повишеният капацитет за гликолиза или транспортиране на глюкоза също може да е отговорен за нарастването на гликолизата по време на развитие на диастолна дисфункция и сърдечна недостатъчност. Въпреки че не наблюдавахме промяна в експресията на гликолитичния ензим PGAM1, открихме увеличение на експресията на LDHA протеин след 3 седмици на HSD и по-късно повишаване на експресията на GLUT1 протеин (Фиг. 4). LDH изоформите, които съдържат LDHA, са по-склонни да превърнат пирувата в лактат, за разлика от катализирането на обратната реакция. Следователно, повишената експресия на LDHA протеин може да допринесе за ранното покачване на гликолизата и повишено отделяне на гликолизата и окисляването на глюкозата в отговор на HSD.
Повишената сърдечна експресия на GLUT1 също може да допринесе за повишаване на гликолизата. В подкрепа на това гликолизата е повишена в сърцата, свръхекспресиращи GLUT1, и е намалена в сърцата, в които липсва GLUT1 (Liao et al. 2002; Pereira et al. 2014). Въпреки това, проучвания, които регулират експресията на GLUT1, отчитат смесени резултати относно ролята на GLUT1 в развитието на сърдечна недостатъчност. Докато се съобщава за свръхекспресия на GLUT1, за да се предотврати сърдечна недостатъчност, причинена от претоварване на сърцето в сърцата на мишки, заличаването на GLUT1 не влияе върху скоростта на развитие на сърдечна недостатъчност, причинена от претоварване на налягането. Нокаутиращата мишка GLUT1 има повишено окисление на мастните киселини и намалено окисление на глюкозата, което се очаква да намали сърдечната ефективност и може да обясни защо тези сърца не са устойчиви на сърдечна недостатъчност, причинена от претоварване (Pereira et al. 2014). Резултатите от тези две проучвания обаче не изключват възможността, че по-остро регулиране на експресията на GLUT1 може да увеличи гликолизата и да наруши сърдечната функция.
Въз основа на тези резултати ние предполагаме, че стимулирането на окисляването на глюкоза може да бъде обещаваща стратегия за лечение и потенциално предотвратяване на развитието на HFpEF. Както бе споменато по-рано, стимулирането на сърдечната окисленост на глюкозата е свързано с повишаване на сърдечната ефективност и подобряване на сърдечната функция (Kato et al. 2010; Masoud et al. 2014; Yamashita et al. 2009; Ussher et al. 2012; Stanley et al. . 2005; Lopaschuk et al. 2003; Dyck et al. 2006; Dyck et al. 2004). Стимулирането на сърдечното окисляване на глюкозата може да бъде от полза и в контекста на затлъстяването и диабета, което може да доведе до сърдечна недостатъчност (Ussher et al. 2009; Lewis et al. 2016; Nicholl et al. 1991). Освен това, лечението на плъхове, чувствителни към Dahl сол, с дихлорацетат (DCA) намалява плазмените нива на лактат (индиректна индикация за повишена гликолиза) и подобрява сърдечната функция (Kato et al. 2010). В това проучване обаче интервенцията с DCA е на по-късен етап от развитието на сърдечна недостатъчност, което също е свързано с промени в систолната функция. В бъдеще ще бъде важно да се определи дали стимулирането на окисляването на глюкоза с по-мощни PDK инхибитори може да намали или дори да предотврати развитието на HFpEF.
Заключения
Това проучване директно характеризира промените в сърдечния енергиен метаболизъм, които се появяват при диастолна дисфункция. Ние демонстрираме, че най-ранната сърдечна метаболитна промяна, която настъпва по време на развитието на диастолна дисфункция, е повишаване на гликолизата, без промяна в окисляването на въглехидратите или мастните киселини. Повишаването на гликолизата доведе до повишено отделяне на гликолизата и окислението на глюкозата и повишено производство на протони, което се случва рано по време на развитието на диастолна дисфункция. Нашите открития, съчетани с предишна работа, показват, че свързването на гликолизата и окисляването на глюкозата е важно за поддържането на нормална сърдечна функция и може да допринесе за развитието на HFpEF. Въпреки че тези резултати предполагат, че намаляването на разединяването на гликолизата и окисляването на глюкозата може да бъде обещаваща стратегия за лечение на сърдечна недостатъчност, необходима е още работа, за да се определи дали терапевтичното подобряване на свързването на гликолизата и окисляването на глюкозата може да лекува HFpEF.
- Спектърът на свързаните с бременността фенотипи на сърдечната недостатъчност Ехокардиографско проучване
- Защо глюкозата в кръвта ми е толкова висока, когато се събудя- Как да понижа сутрешната кръвна захар
- Нездравословната растителна диета може да увеличи риска от сърдечни заболявания
- Какви храни трябва да ям за здравословна диета на сърцето
- Защо храненето късно през нощта може да навреди на сърцето ви Наука на живо